右侧输尿管肾源性腺瘤1例并文献复习
陆 姣,王钰雄,顾春梅,王远涛,胡 钰
(1.吉林大学第一医院 肾内科,吉林 长春130021;2.吉林大学第一医院 泌尿系统疾病诊治中心;3.吉林大学中日联谊医院 病理科,吉林 长春130033)
肾源性腺瘤(nephrogenic adenoma,NA) 也称肾源性化生,是一种少见的泌尿道良性的肿瘤样病变,可累及泌尿道的任何部位,多发生于膀胱,尿道、输尿管及肾盂较少见,也有报道NA发生于泌尿道憩室内[1]。由于其发病机制尚不明确,易被误诊为其他疾病,本研究回顾性分析吉林大学第一医院收治的1例右侧输尿管肾源性腺瘤患者的临床资料、病理学及免疫组化特征,以提高临床医生对本病的认识,避免误诊。
1 临床资料
男性患者,64岁,13年前因双侧输尿管结石,行经腹双侧输尿管结石切开取石术,术后恢复良好,未规律复查。半年前因“活动时出现肉眼血尿半年”就诊,输尿管多排CT平扫提示:双侧肾盏内见多发点状、结节状钙化影,大小约0.2-0.6 cm。双侧肾盏、肾盂扩张,左侧输尿管走行至约腰4椎体下缘水平腔内见3枚结节样钙化影,长径约0.6-0.9 cm,右侧肾盂输尿管移行处腔内见结节样钙化影,大小约0.7 cm,右侧输尿管未见明显扩张。肾盂分泌造影:腰4、5及骶1左旁见多发小结节高密度影,右侧肾区下方区见多个条状致密高密度影。IVP双侧肾盂、肾盏扩张,左侧为著,左侧输尿管上段稍扩张,下段显影不清或不佳。右侧输尿管上段显示不清,下段间断显示。专科查体:双肾区叩击痛阴性,双侧输尿管走行区无压痛,肋脊点及肋腰点压痛阴性,耻骨上膀胱区无隆起及压痛。
完善术前检查后,行经腹腹腔镜右侧肾盂切开取石术、右侧输尿管支架管置管术。麻醉生效后,经尿道留置F14的双腔气囊导尿管,持续引流尿液。术中见右侧肾盂扩张积水明显,右侧输尿管上段近肾盂输尿管连接部可触及结石。用腹腔镜切开刀在结石上方切开输尿管上段,长度2.5 cm,在肾盂内可见一枚黄褐色类球形结石,表面不光滑,大小1.7 cm×1.2 cm,用分离钳剥离结石,将结石自右侧肾盂腔内完整取出。结石下方可见息肉样组织,切取病理送检。患者术后恢复顺利,5天后拔除导尿管,4周后拔除输尿管支架管。
术后病理:右侧输尿管肾源性腺瘤(肾源性化生),部分尿路上皮脱失,粘膜下充血。镜下可见病变形成管状,管腔大小不一,部分呈囊性扩张。细胞质呈嗜酸性或透明空泡样,胞核圆形或椭圆形,胞核略增大但异型性不明显,未见核分裂像,间质有明显炎细胞浸润(图1,2)。免疫组化:CK7(+)(图3),P504S(+)(图4),Ki-67(+)增殖指数2%(图5)。
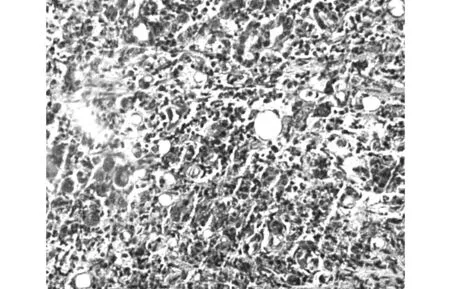
图1 肾源性腺瘤(HE染色×100)
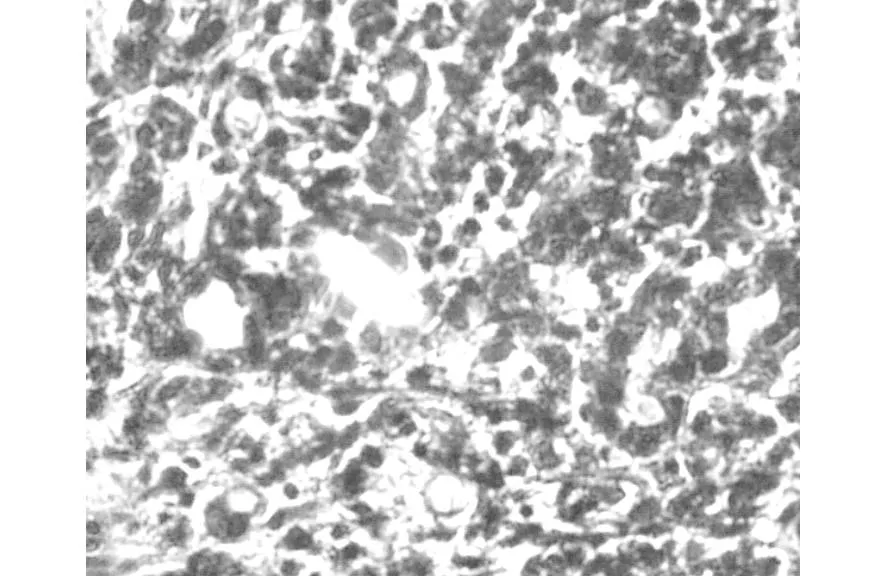
图2 肾源性腺瘤(HE染色×400)
2 讨论
肾源性腺瘤最早由Davis于1949年首次报道,并根据其病理特点命名为“膀胱错构瘤”[2]。1950年Friedman等[3]发现该肿瘤形态与中肾小管相似,将其命名为“肾源性腺瘤”。肾源性腺瘤多见于男性,男女发病比约为2-3∶1[4]。可发生于任何年龄,可见于肾盂、输尿管、膀胱、前列腺、尿道等部位,以发生于膀胱多见[5,6],其临床表现不典型,与发生部位有关,主要有无痛性血尿、尿频、尿急、尿痛等刺激症状。本例发生于输尿管,临床症状为肉眼血尿,临床症状可能与输尿管结石有关,属较少见的NA。
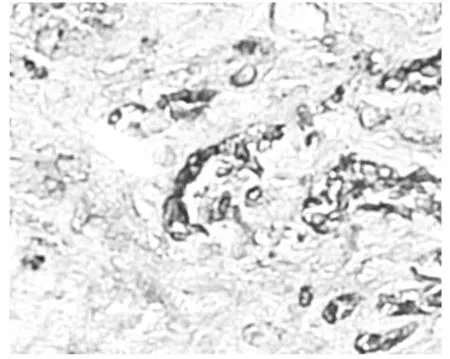
图3 肾源性腺瘤[CK7(+),×400]
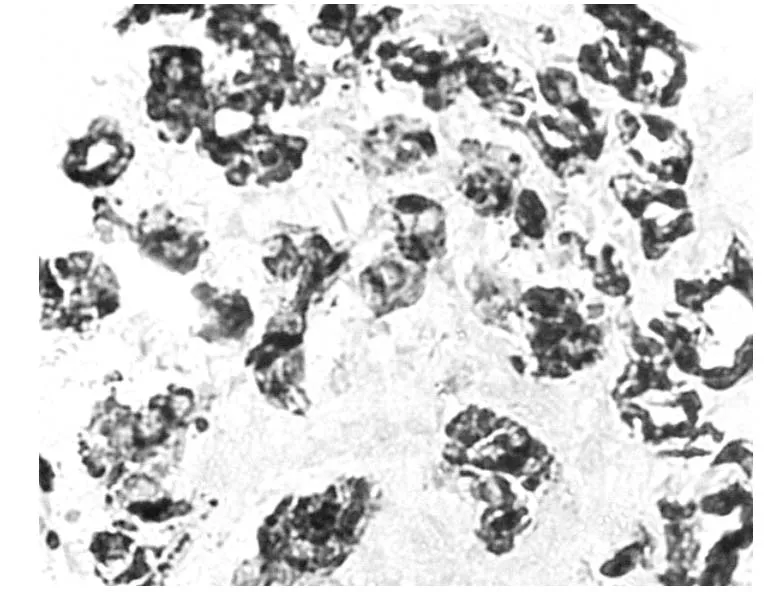
图4 肾源性腺瘤[P504S(+),×400]
图5 肾源性腺瘤[Ki-67(+),×400]
NA肉眼观多呈息肉状、乳头状,以单发为主,20%的病例为多发[7]。镜下表现主要有3种形态:管状、囊状和乳头状,以管状最为常见。管周围绕明显的基底膜,管腔内含嗜酸或嗜碱性分泌物。本例镜下可见病变形成小管状,管腔大小不一,部分呈囊性扩张。细胞质呈嗜酸性或透明呈空泡样,胞核圆形或椭圆形,胞核略增大但异型性不明显,未见核分裂像,间质有明显炎细胞浸润。肿瘤一般位于固有层内,不侵犯肌层[8],但也有少数病例报道可侵犯至周围脂肪组织[9]。NA在免疫组化中,多数标记CK7、EMA、HCK、水通道蛋白-1阳性,部分P504S阳性,而CD31、PSA、CD10、PSA为阴性。NA的 Ki-67增殖指数一般<5%[10],可作为它和其他恶性肿瘤的鉴别依据之一。近年来有文献报道,PAX2和PAX8在NA中特异性表达,因其在前列腺癌中不表达,故可与其他抗体联用为NA的诊断及鉴别诊断提供依据[11]。
NA在膀胱镜或输尿管镜下常需与息肉、泌尿系肿瘤如透明细胞癌、移行上皮癌、前列腺癌等相鉴别,其确诊主要依据病理特征及免疫表型。长时间结石、损伤、炎症的刺激可以导致输尿管息肉,研究表明,息肉的好发年龄在20-40岁,而NA则好发于中老年男性,肉眼观,输尿管息肉多呈柱状或分叶状,边缘平滑,粉红色或棕褐色,镜下可见移行上皮被覆,其下为疏松结缔组织和毛细血管,可与输尿管息肉相鉴别,当鉴别困难时,可考虑术中取快速冰冻活检明确诊断[12]。透明细胞癌镜下细胞可呈立方状或多角形,胞核异型性大,核分裂象多,伴坏死。CEA及CA125表达阳性,Ki-67指数高(常>80%)而PAX2、PAX8不表达。而NA多为管形,胞核偶有异型,核分裂象少见,PAX2、PAX8特异性表达,Ki-67指数<5%。镜下NA乳头状结构常被覆单层上皮,而移行细胞癌的乳头则被覆多层移行上皮;当膀胱移行上皮癌为腺样结构时腺体侵犯固有肌层或以下,间质反应较明显。免疫组织化学染色膀胱上皮性肿瘤通常p63阳性,Ki67> 15%。前列腺癌细胞高分化,两者在镜下均表现为管状结构,仅依靠病理特征难于区分,可用免疫组化染色相鉴别,虽然前列腺癌和NA在P504S标记上均为阳性,但是NA免疫标记PSA阴性,若能检测到PAX2和PAX8阳性,结合形态学特征,则更易与前列腺癌相鉴别。
NA具体发生机制尚不明确,目前较认同的观点是种植起源学说,即由于肾小管上皮剥脱,种植于泌尿系统而产生,类似于子宫内膜异位[4,13]。另外文献报道NA常发生于尿路上皮的损伤刺激之后,常有炎症、结石、外伤、泌尿系手术等病史[14]。本例既往有输尿管切开取石病史,且存在结石、感染等炎症刺激因素,尿路上皮细胞良性增生,与肾源性腺瘤的发生相关性大,这与目前相关文献报道的结论相符合。NA最常见的治疗方式是手术切除。文献报道NA的复发率为0.5%-80%[15]。本例术后随访三年,未见复发。

