1株生防菌的鉴定及其发酵条件优化
陈海念,冯蓉,2,杨胜竹,曹本福,3,文明江,刘丽,2*,陆引罡,2,3
(1.贵州大学农学院,贵阳 550025;2.贵州大学新型肥料资源与技术研究所,贵阳 550025;3.贵州省烟草品质研究重点实验室,贵阳 550025)
以化学农药为主导的植物病害防治策略附带的农药残留超标、病原菌抗药性增强及生态平衡被破坏等问题日益凸显[1-3],而微生物防治表现出的无污染、无公害、长效性、处理费用低廉等优势[4-7],使得生物防治技术成为控制植物病害的最佳选择之一[8-9]。目前,许多有益微生物已应用于植物病害防治中[10-12],包括真菌、细菌和一系列放线菌等[13]。生防菌种类不同,其生物防治的机制也不相同,如枯草芽孢杆菌(Bacillus subtilis)B-916产生的抗真菌蛋白物质通过核糖核酸酶和凝结作用抑制水稻稻瘟病、菌核病、纹枯病及灰霉病病原菌菌丝的生长,从而防治水稻多种病害[14];木霉菌(Trichodermaspp.)可在其他微生物上缠绕生长,同时产生抗菌类物质来抑制该微生物的活性,降低病原微生物的致病能力,促进植物生长。以多粘芽孢杆菌(Bacillus polymyxa)SQR-21制备的生物有机肥施用于香蕉根围土壤中,可提高香蕉植株根尖的蛋白类抗菌物质几丁质酶的活性,显著促进香蕉植株生长,降低香蕉枯萎病的发病指数[15]。HELMY等[16]发现,从荧光假单胞菌(Pseudomonas fluorescens)中分离纯化获得的嗜铁素可有效遏制烟草赤星病菌(Alternaria alternata)、尖孢镰刀菌(Fusarium oxysporum)、黄曲霉(Aspergillus flavus)等多种病原菌的生长。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)FZB42产生的聚酮化合物对由梨火疫病病原菌(Erwinia amylovora)引起的梨火疫病具有良好的防治效果[17];赵青云等[18]发现,枯草芽孢杆菌Y-IVI能促进香草兰生长发育,同时减少尖孢镰刀菌的数量,降低连作障碍,并可产生铁载体、吲哚乙酸等物质,促进甜瓜生长。
上述研究为生防菌更好地应用于农业生产提供了一定的参考依据,展现出生防菌良好的农业应用前景。生防菌株的种属确定、可培养性、发酵效率及其抑菌效果等是保证生物防治效果的前提,也是决定其能否从实验室走向田间的关键。培养基组分及发酵条件皆会明显影响微生物的生长发育和抑菌活性物质的形成[19];而通常,欲提高生防菌抑菌活性物质的产量,则应先保证其细胞产量[20]。鉴于此,我们对课题组前期研究筛选所得的1株对草莓灰霉病菌(strawberry gray mold)具有较佳拮抗作用的菌株F11开展了进一步研究,测试了该菌株对多种常见病原菌的抑菌效果,并结合形态学、生理生化方法、16S rRNA及gyrB的分子生物学方法对其进行了鉴定,最后对该菌株的发酵培养基配方及发酵条件进行了优化筛选。研究结果可为挖掘其作为植物病害防治的潜在资源提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株:F11菌株,由贵州大学新型肥料资源与技术研究所在前期研究时从草莓根际土壤中分离筛选得到,对草莓灰霉病菌具有拮抗性能。
供试病原菌:水稻稻瘟病菌(Pyricularia oryzae)、猕猴桃葡萄座腔菌(Botryosphaeria dothidea)、烟草黑胫病菌(Phytophthora parasiticavar.)、烟草炭疽病菌(Colletotrichum nicotianaeAv.)、樟树胶孢炭疽病菌(Colletotrichum gloeosp orioides)、高粱斑点病菌(Pseudomonas syringaepv.syringaeVan Hall)、玉兰炭疽病菌(Colletotrchum magnoliae camara)、核盘菌(Sclerotiniasclerotiorum)、禾谷炭疽菌(Colletotrichum graminicolaCesati Wilson)、玉米大斑病菌(Setosphaeria turcica)、辣椒炭疽菌(Colletotrichum capsici)、烟草赤星病菌[Alternaria alternata(Freis)Keissler]共12种病原菌,均为贵州省山地农业病虫害重点实验室惠赠。
1.2 培养基
营养肉汤(nutrient broth,NB)液体培养基:3.00 g牛肉膏,10.00 g蛋白胨,5.00 g NaCl,2.00 g/L MgCl2,加水至1 000 mL,pH 7.0,高压(1×105Pa)灭菌30 min,冷却备用。
NB固体培养基:在NB液体培养基的基础上加入琼脂 20.0 g,高压(1×105Pa)灭菌 30 min,冷却备用。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g马铃薯(去皮切块,煮沸0.5 h,纱布过滤),20 g蔗糖,20 g琼脂,加水至1 000 mL,pH自然(7.0),高压(1×105Pa)灭菌30 min,冷却后倒平板,备用。
1.3 种子菌液的制备
取一环F11菌苔于NB固体培养基上画线,在30℃恒温培养箱(GXZ-258A,浙江省宁波江南仪器厂)中培养24 h后,挑取单菌落接种于NB液体培养基中,于30℃、150 r/min下振荡培养18 h(经前期F11生长曲线确定),获得F11种子菌液。
1.4 试验设计
1.4.1 菌株F11对病原菌的抑菌效果分析
采用经典的平板对峙培养法,观察菌株F11的拮抗情况并测定其对各病原菌的抑菌圈大小。具体方法为:将直径为7.5 mm的圆形病原菌苔菌块置于PDA平板的中央,在距平板中心2.0 cm处的4个对角线上接种F11拮抗菌,每个处理重复3次;另在PDA平板中心接种病原真菌作空白对照,在28℃生化培养箱内培养,连续培养6~8 d,测定抑菌圈大小。
1.4.2 菌株F11的鉴定
1.4.2.1 菌株F11的形态特征和生理生化特性鉴定
将稀释的菌株发酵液均匀涂布于NB固体培养基平板上,放入恒温培养箱,28℃条件下恒温培养2 d,出现单菌落后观察菌落形状、颜色、边缘、表面、隆起形状、透明度等,并在Leica DM500电子显微镜(德国徕卡公司)下观察细胞的形状、结构、大小等。菌株的形态特征和生理生化特性鉴定参照2012年修订的《伯杰氏系统细菌学手册》(第二版)[21]。
1.4.2.2 菌株F11的16S rRNA和gyrB基因鉴定
菌株DNA的提取:取对数生长期的菌株F11菌液,以1.2×104r/min离心5 min,收集1.5 mL上清液,将菌体悬浮于400 μL提取液[10 mmol/L NaCl、20 mmol/L Tris-HCl、1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)]中,pH 8.0,加入100 μL终质量浓度为100 μg/mL的蛋白酶K和500 μg/mL的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液。将其轻轻混匀后,于37℃条件下水浴1 h,再在65℃条件下水浴1 h。加入600 μL的酚-三氯甲烷-异戊醇,室温下颠倒混匀后以1.2×104r/min离心10 min,将上清液移入1.5 mL离心管,重复该步骤。向含有DNA的上清液水相中加入1/10体积的3 mol/L乙酸钠(pH 5.5)和2倍体积的无水乙醇,轻颠混匀后于-20℃条件下沉淀1 h。以1.2×104r/min离心15 min,弃上清液。用70%无水乙醇洗涤沉淀,以1.2×104r/min离心15 min,弃上清液,风干。用 50~150 μL TE 缓冲液(10 mmol/L Tris-HCl与1 mmol/L EDTA的混合缓冲液,pH 8.0)溶解基因组DNA,在-20℃条件下储存,备用。
菌株DNA的聚合酶链式反应(polymerase chain reaction,PCR)扩增:以菌株F11基因组DNA为模板进行16S rRNA和gyrB基因扩增。16S rRNA引物序列如下。27F:5´-AGAGTTTGATCCTGGCTCAG-3´;1492R:5´-GGTTACCTTGTTACGACTT-3´。gyrB基因引物序列[22]如下。UP-1:5´-GAAGTCATCATG ACCGTTCTGCAYGCNGGNGGNAARTTYGA-3´;UP-2r:5´-AGCAGGGTACGGATGTGCGAGCCRTC NACRTCNGCRTCNGTCAT-3´。PCR扩增体系为:10 μmol/L正反向引物各1 μL,天根2×TaqPCR混合液12.5 μL,模板DNA 2 μL,用无菌去离子水补足至25 μL。其中天根2×TaqPCR混合液包括:0.1 U/μLTaq聚合酶、各 500 μmol/L dNTP、20 mmol/L Tris-HCl(pH 8.3)、100 mmol/L KCl、3 mmol/L MgCl2及其他稳定剂和增强剂。PCR反应条件:95℃预变性4 min;98 ℃变性10 s,62 ℃退火1 min,72 ℃延伸2 min,30个循环;72℃延伸8 min。将16S rRNA和gyrB基因扩增产物纯化后进行测序分析,通过NCBI数据库(https://blast.ncbi.nlm.nih.gov/)与GenBank中的序列对测序结果进行Blast比对分析,并构建系统发育树,从分子水平上对菌株F11进行鉴定。
1.4.3 培养基配方优化
采用L16(43×26)的正交设计对菌株F11培养基配方进行优化。其中,4水平的3因素分别为牛肉膏、蛋白胨、NaCl;2水平的6因素分别为葡萄糖、Mn、Mo、Fe、B、Mg,共设置1~16号处理(表1)。以NB培养基(处理17)作为空白对照。各处理按1%接种量接种后,在30℃、150 r/min条件下振荡18 h,采用T6-XSJ紫外可见分光光度计(北京普析通用仪器有限责任公司)测定可表征菌悬液细胞浓度的吸光度值D600nm[23-24]。每个处理重复5次,完全随机排列。根据正交试验结果分析各试验因素的适宜水平。
1.4.4 发酵条件优化
对菌株F11进行不同初始pH(6.0、6.5、7.0、7.5、8.0)、不同培养温度(25、30、33、35、40 ℃)和不同振荡速率(100、150、170、180 r/min)的发酵条件优化试验。各处理的F11种子液接种量均为1%。其中,不同初始pH试验的培养温度为30℃,振荡速率为150 r/min;不同培养温度试验的培养基pH为优选确定的pH,振荡速率为150 r/min;不同振荡速率试验的培养基pH为优选确定的pH,培养温度为优选确定的温度。各处理重复5次,完全随机排列。振荡培养18 h,测定发酵液吸光度值D600nm,由此确定菌株F11的最佳培养基的初始pH、培养温度和振荡速率的优化水平。
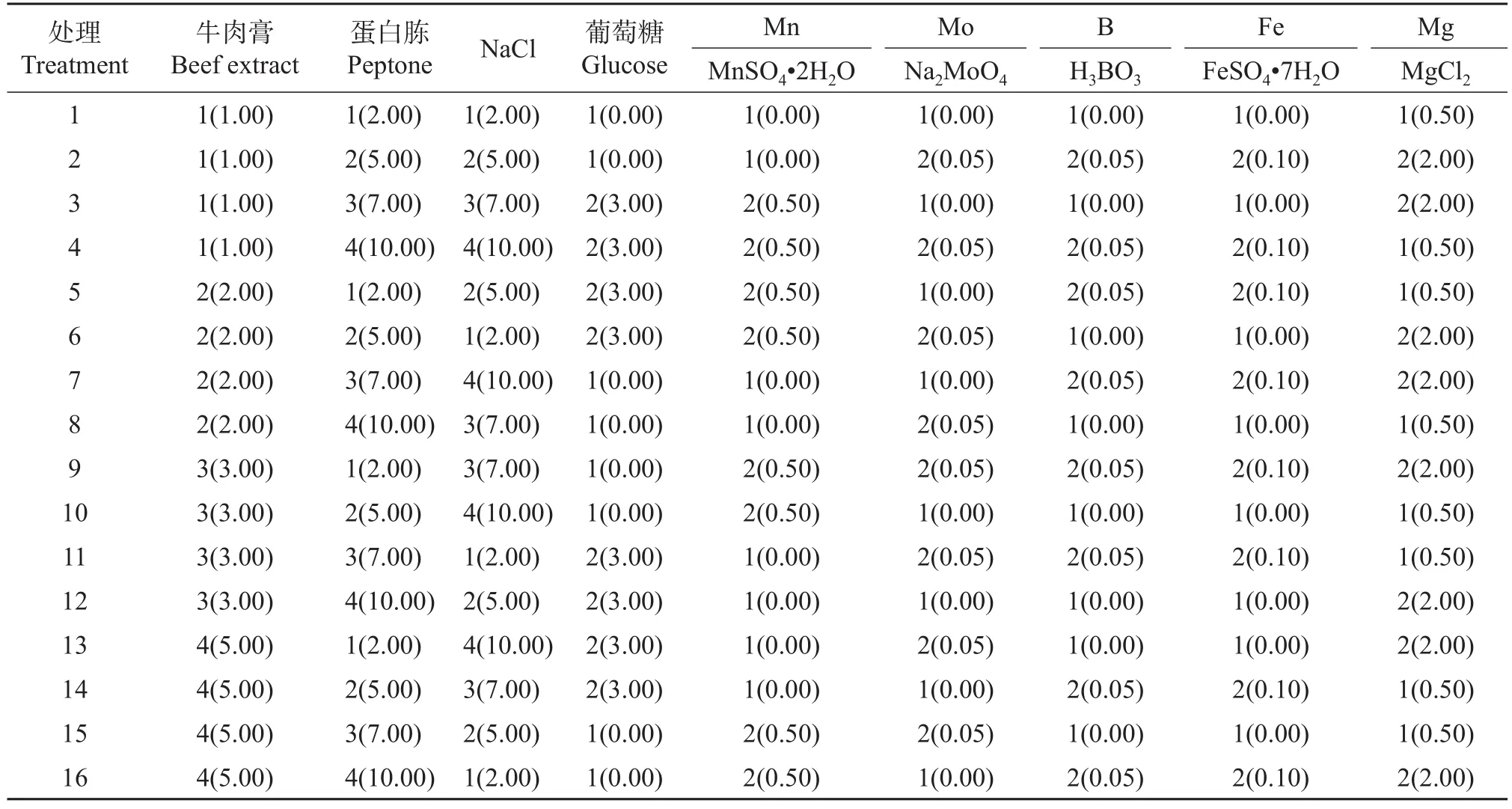
表1 L16(43×26)正交试验设计方案Table 1 Design of L16(43×26)orthogonal array experiment
1.4.5 优化效果鉴定
按1%接种量将菌株F11接种于优选配方培养基上,在最佳发酵条件下振荡培养18 h,获得从对数期刚转入稳定期的菌株F11发酵液,测定发酵液在600 nm处的吸光度值和活菌数。以NB液体培养基为对照,鉴定优化效果。
1.5 数据分析
相对抑制率=(对照菌落直径/mm-处理菌落直径/mm)/(对照菌落直径/mm-7.5 mm)×100%。式中,处理菌落的初始直径为7.5 mm。
试验数据采用Excel 2010整理并作图,采用DPS 14.0进行单因素和正交试验方差分析,采用MEGA 6.0软件中的邻接法构建系统发育树。
2 结果与分析
2.1 菌株F11对多种病原菌的抑制作用
经平板对峙培养试验,对病原菌生长直径进行测定并采用t检验发现,经菌株F11拮抗处理后病原菌生长受到了明显抑制,可见F11对多种病原菌的生长具有拮抗性能(表2)。其中:菌株F11对核盘菌的抑制作用最强,相对抑制率达到100.00%;其次为玉米大斑病菌,菌株F11对其的相对抑制率为94.74%,且对烟草炭疽病菌、玉兰炭疽病菌和猕猴桃葡萄座腔菌等病原菌的抑制率均达79.88%以上。由此说明,F11具有高效、广谱的抑菌效果,表现出良好的生防应用潜能。
2.2 菌株F11的形态特征
如图1A所示,菌株F11菌落呈圆形,边缘不整齐,呈锯齿状,表面干燥,有褶皱,无黏性,不透明,乳白色。光学显微镜下可见该菌株细胞为短杆状(部分椭圆状),有芽孢形成,两端钝圆,很少成链,成单或是成短链排列,初步鉴定为芽孢杆菌属(图1B)。
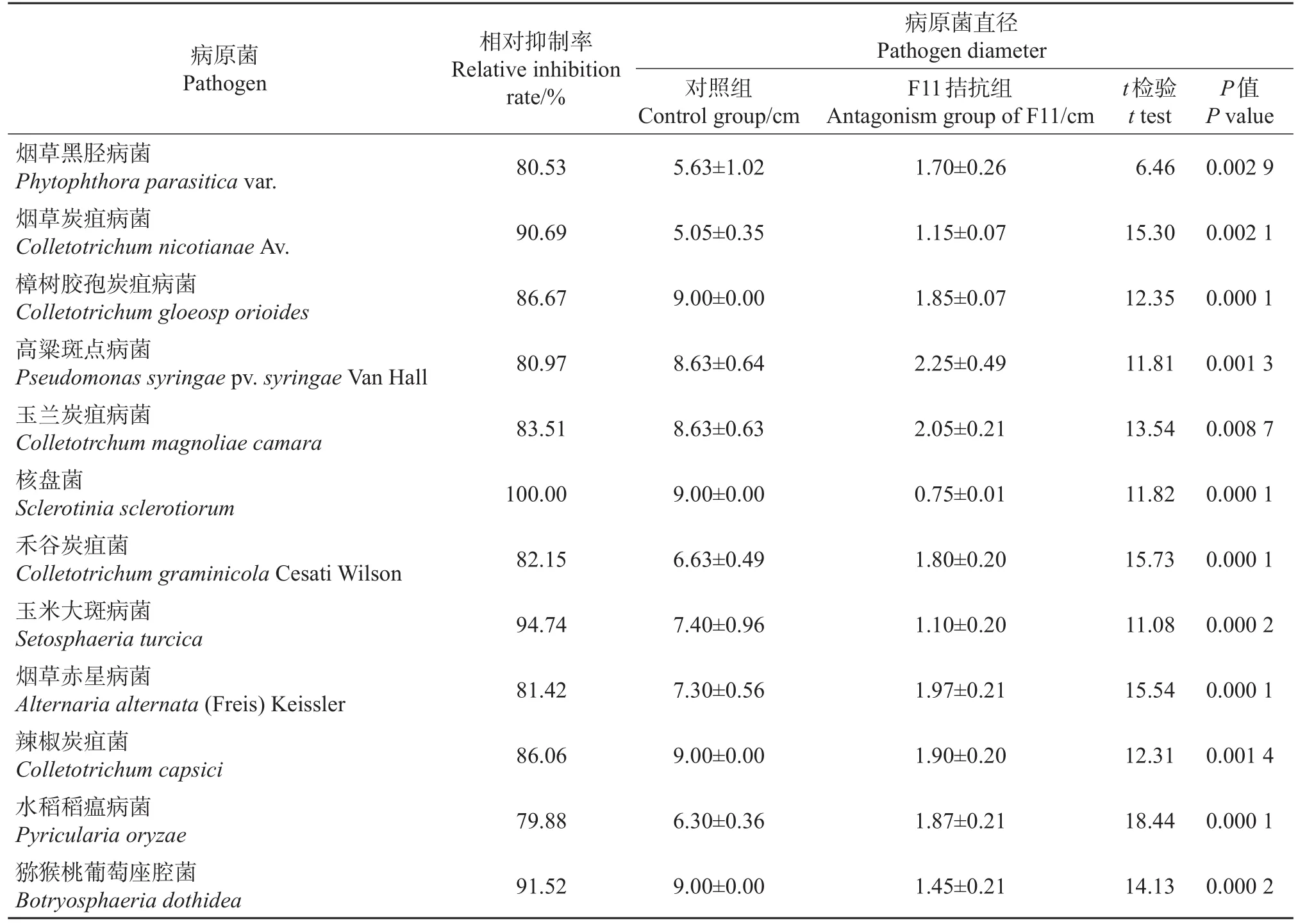
表2 菌株F11对12种病原菌的抑制作用Table 2 Inhibitory effects of strain F11 on 12 pathogens
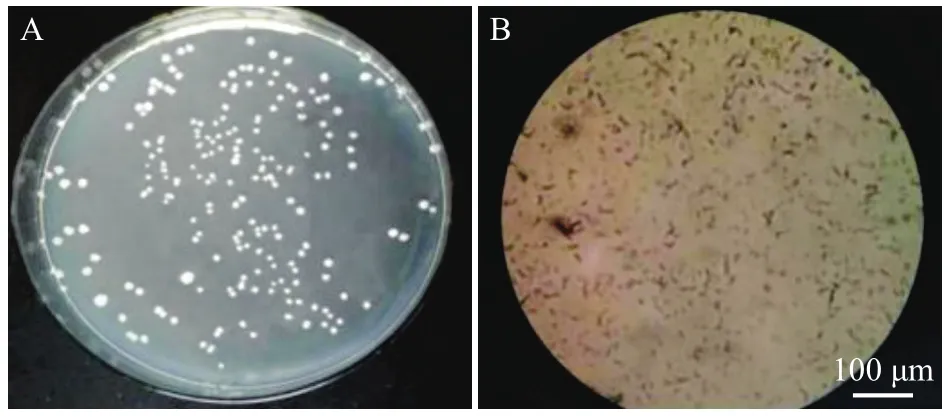
图1 菌株F11的形态Fig.1 Morphology of strain F11
2.3 菌株F11的生理生化特征
生理生化鉴定结果(表3)表明,菌株F11经革兰氏染色呈阳性,在1%~8%NaCl处理条件下均可生长,在鸟氨酸脱羧酶、赖氨酸脱羧酶、甲基红反应、硫化氢实验中结果为阴性,在β-半乳糖苷酶、接触酶、氧化酶、脲酶、精氨酸双水解酶、淀粉水解、明胶水解、酪素水解、硝酸盐还原、柠檬酸生长、50℃生长、VP(Voges-Proskauer)反应的实验中结果为阳性。对比发现,菌株F11的生理生化特征与其他4种解淀粉芽孢杆菌基本一致。结合菌株F11的菌落及细胞形态特征,初步拟定菌株F11为解淀粉芽孢杆菌。
2.4 菌株F11的分子鉴定
在细菌的进化过程中,16S rRNA基因和gyrB基因具有较高的保守性,16S rRNA平均每5 000万年碱基的替换变化率为1%,而gyrB基因每100万年碱基的替换变化率为0.7%~0.8%。gyrB可弥补16S rRNA序列无法区分近缘种的缺陷,能更好地区分近似种。因此,结合2种基因扩增测序方式可使菌株的种属鉴定更为准确。经测序,菌株F11的16S rRNA及gyrB基因序列长度分别为1 457 bp和879 bp。测序结果通过NCBI数据库进行Blast比对,其识别号分别为8TCWE8SN015和8TE5X4BT014,选取相似度较高的序列及大肠埃希菌等相似度较低的菌株序列为外群,采用邻近法构建系统发育树。16S rRNA系统发育树(图2)显示:菌株F11与解淀粉芽孢杆菌B.amyloliquefaciensFito_F321(序列号:MG836692.1)在同一分支上,Blast比对相似性高达99.79%;在gyrB基因系统发育树(图3)上,菌株F11与解淀粉芽孢杆菌B.amyloliquefaciensRx-35(序列号:JN086142.1)在同一分支上,Blast比对相似性高达99.89%。结合菌株形态和生理生化特征,确定菌株F11为解淀粉芽孢杆菌(B.amyloliquefaciens)。
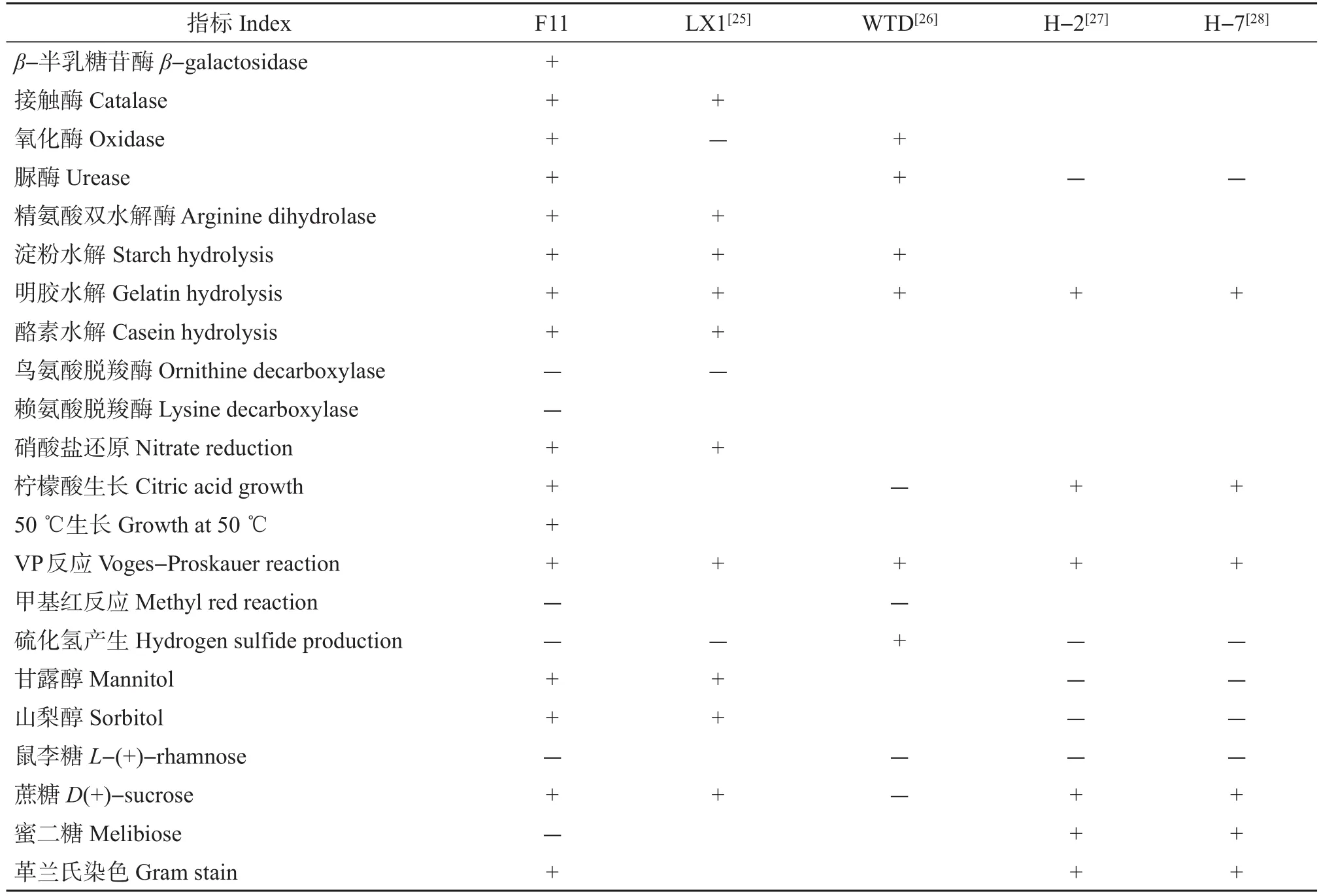
表3 菌株F11与其他解淀粉芽孢杆菌生理生化鉴定结果对比Table 3 Comparison of physiological and biochemical identification results of strain F11 with other Bacillus amyloliquefaciens
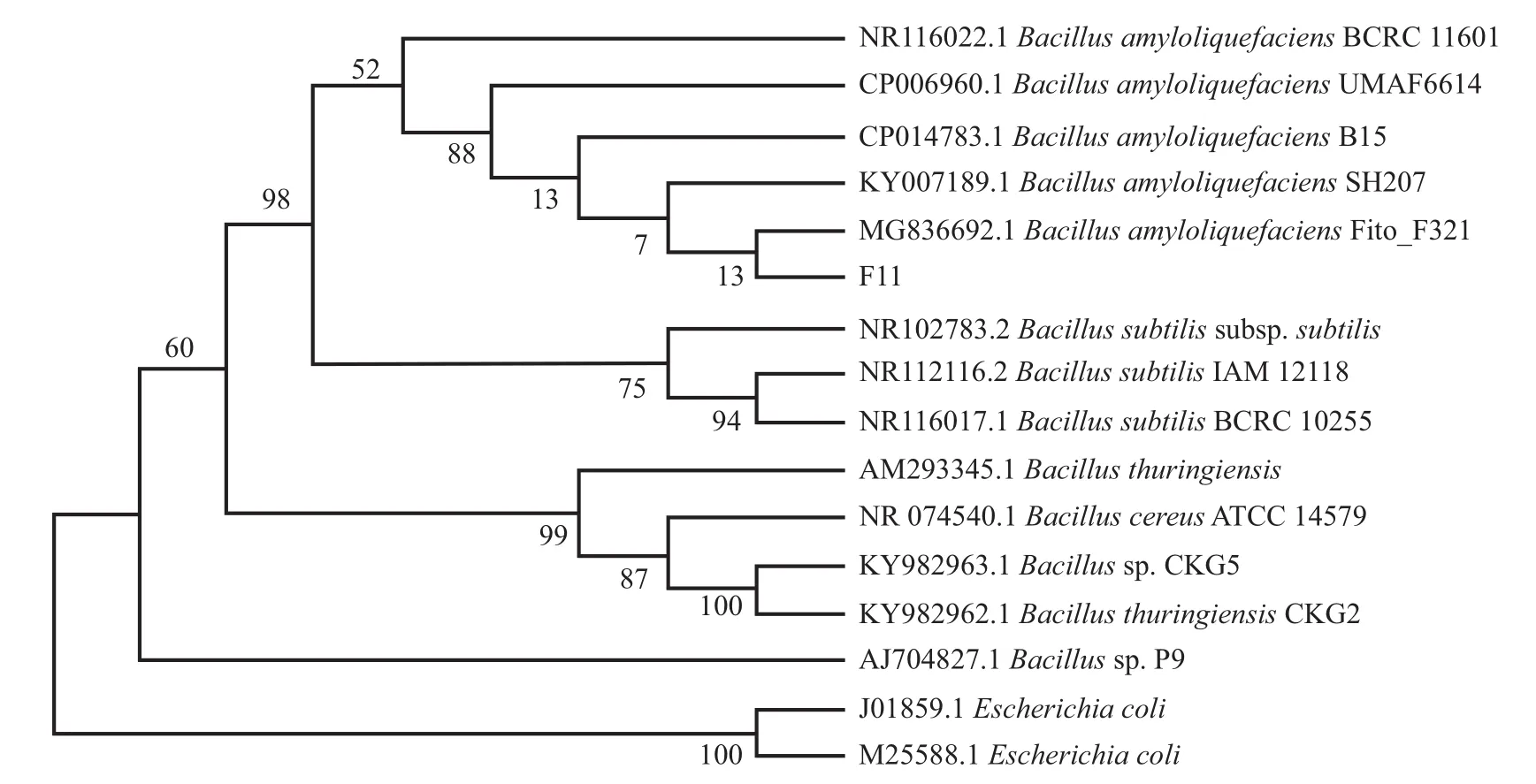
图2 16S rRNA的系统发育树Fig.2 Phylogenetic tree of 16S rRNA
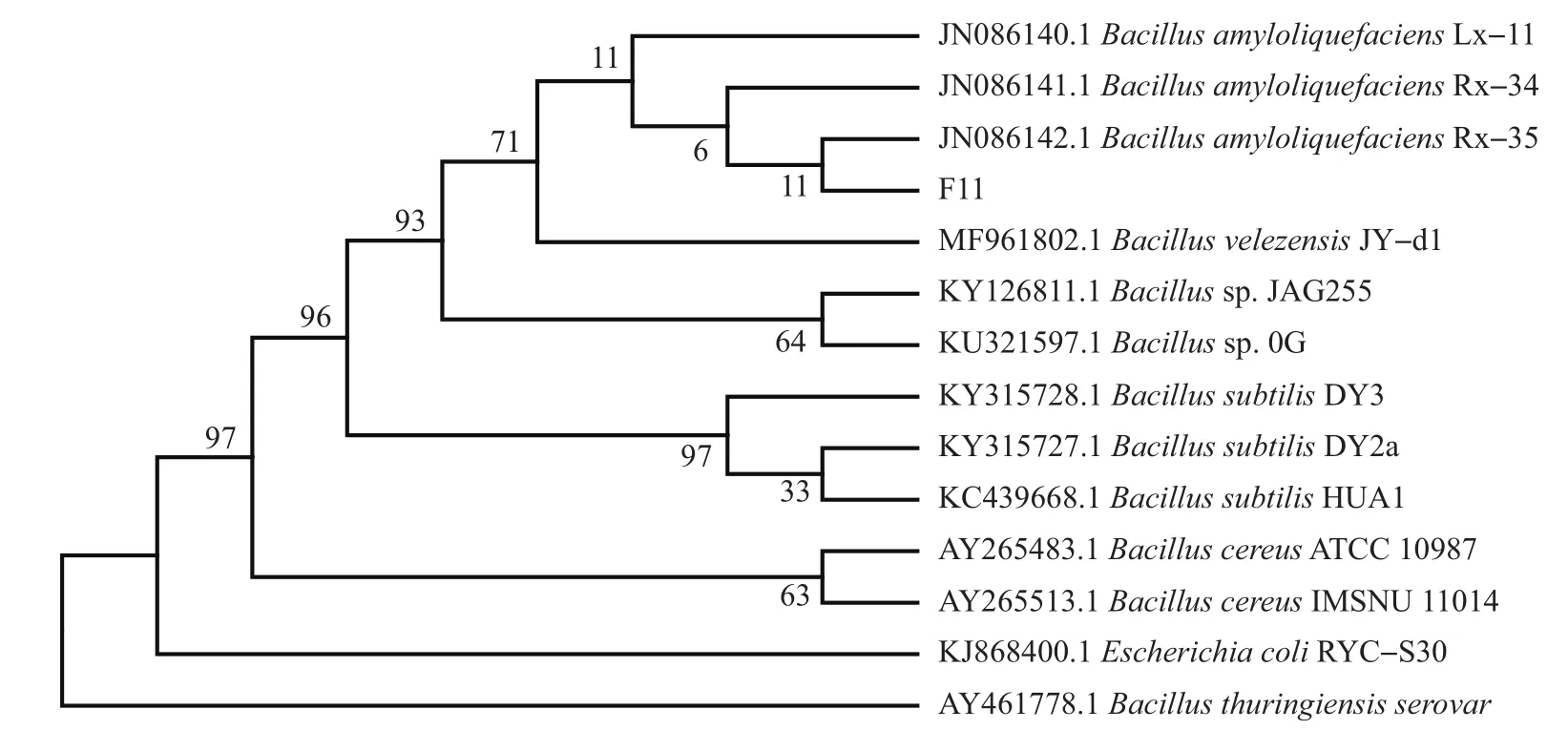
图3 gyrB基因的系统发育树Fig.3 Phylogenetic tree of gyrB gene
2.5 基于NB培养基的配方优化
如图4所示,菌落F11菌悬液D600nm值在处理间存在显著差异(P<0.05),其中正交试验处理12~14的D600nm值均显著高于NB培养基(处理17)的D600nm值(0.59),以处理12的D600nm值(1.41)为最高。
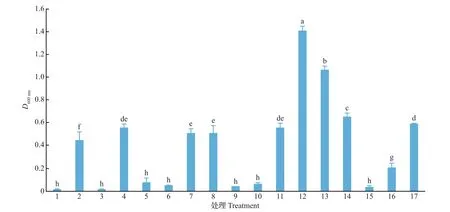
图4 L16(43×26)正交试验各处理及NB培养基处理的F11菌悬液D600 nm值比较Fig.4 Comparison of D600 nmvalues of F11 suspension under L16(43×26)orthogonal test treatments and NB medium treatment
图5与表4显示,在各因子中除B和Fe的2水平间不存在显著性差异外,其余7个因子水平间差异显著(P<0.05)。其中,Mn的添加显著降低了D600nm值,其余因子均表现出正效应。正效应因子中,以蛋白胨、NaCl、葡萄糖、牛肉膏效应较大。值得一提的是,因子牛肉膏、蛋白胨及NaCl的D600nm值总体上随用量的增加而增加,但NaCl水平3显著低于水平2,这可能与其他因子的交互作用产生效应混杂有关[29]。通过统计分析,各因子优选量的确定结果见表4。
当地主要种植玉米、水稻、果树等作物。四川是农业大省,有西南地区“尿罐子”之称。化肥业是支农惠农的战略性资源产业,化肥业仍将得到大力支持,当地化肥行业总体发展趋势良好。但煤化工项目水耗高、环保压力大,煤炭同样存在供应和价高问题,且设备改造成本较大。受环保条例影响,很多工厂被勒令停产,何时开工还未知,这或将拉动化肥价格上涨。
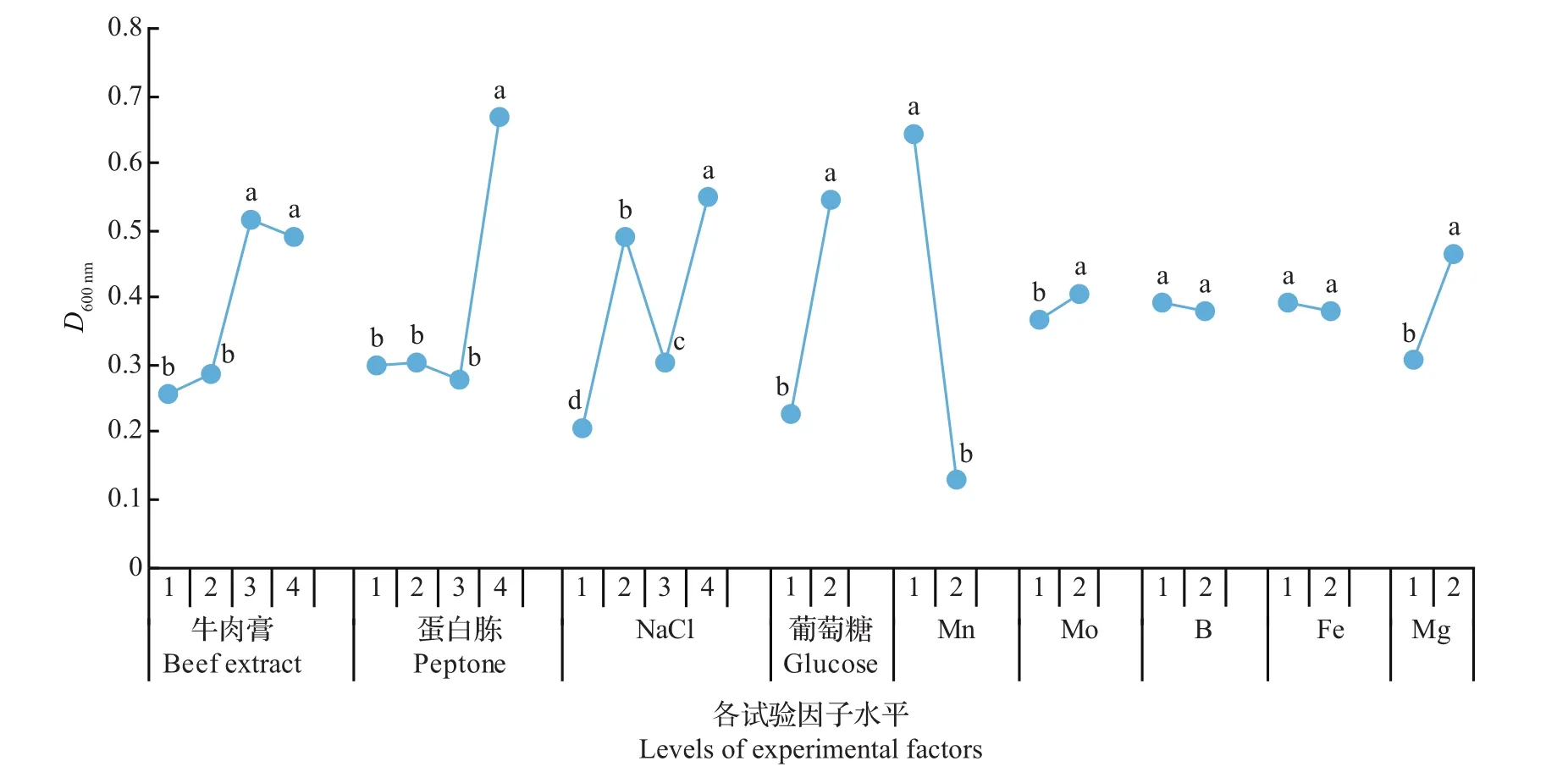
图5 F11菌悬液D600 nm值在各正交试验因子水平间的比较Fig.5 Comparison of D600 nmvalues of F11 suspension in the levels of various factors in the orthogonal test
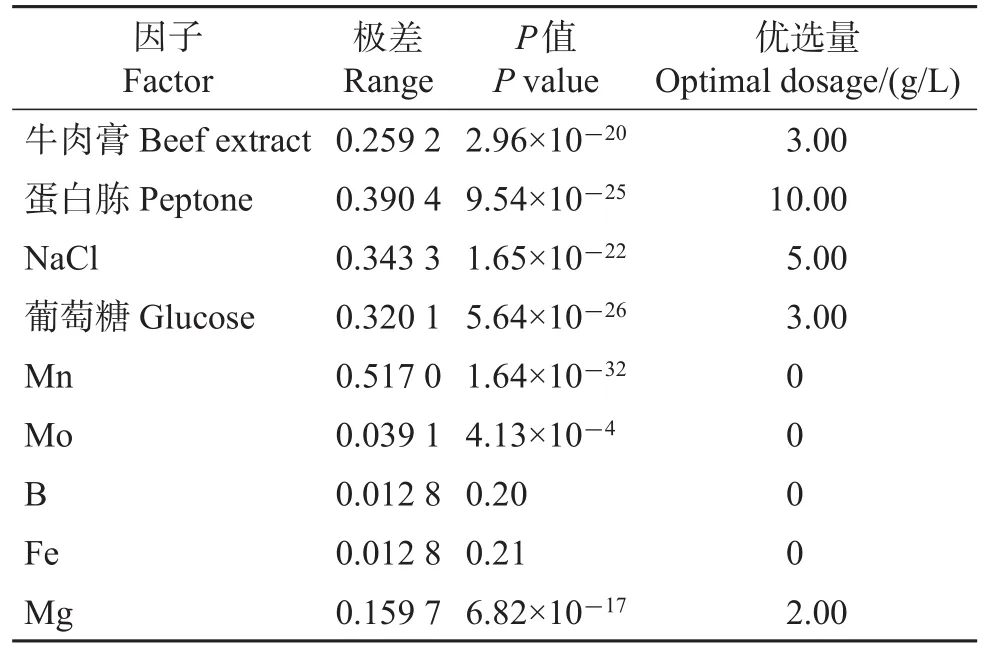
表4 各正交试验因子的极差、P值与优选量Table 4 Range,P value and optimal dosage for each factor in the orthogonal test
2.6 菌株F11发酵条件优选
2.6.1 不同初始pH对菌株F11生长的影响
按表4各因子优选量配制不同初始pH的优化配方培养基及NB液体培养基,以对F11进行对比培养。不同pH条件下2种培养基的F11菌悬液D600nm值如图6所示:D600nm值随pH升高均呈先升高后降低的趋势,方差分析表明,不管是优化配方培养基还是NB液体培养基,pH对菌株F11的D600nm值均存在显著性影响;优化培养基下菌株F11的D600nm值均高于NB液体培养基(pH 8.0除外),且2类培养基的D600nm值均在pH 7.0时达到最高。当pH为7.0~8.0时D600nm值均逐渐降低,在pH 8.0时降到最低:说明该菌株较适宜生长于中性环境而不适宜生长在碱性环境中。上述结果表明,菌株F11最适宜生长在初始pH为7.0的环境中,且基于优化配方的培养基对菌株F11的生长有明显的促进效果。
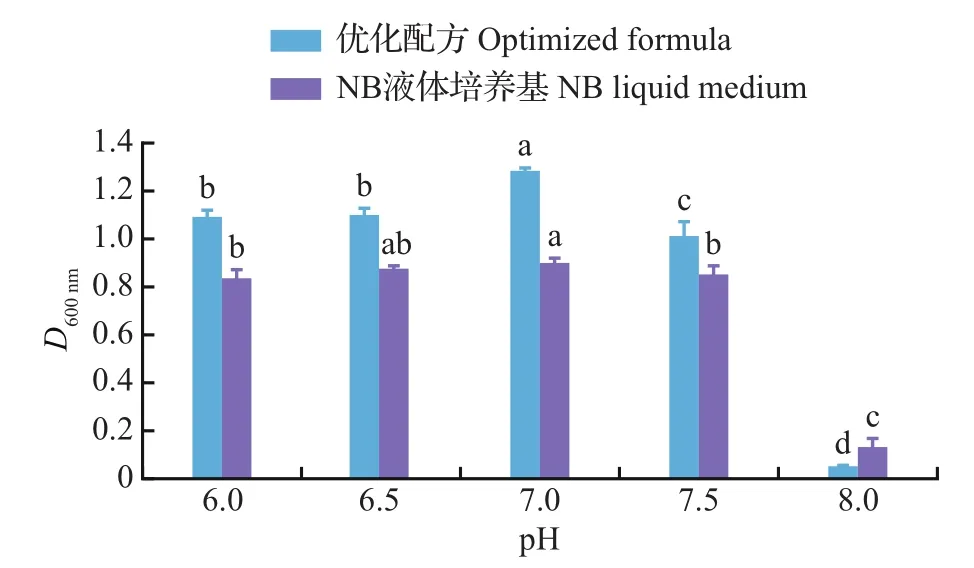
图6 不同初始pH对菌株F11生长的影响Fig.6 Effects of different initial pH on the growth of strain F11
2.6.2 基于优选pH的不同培养温度对菌株F11生长的影响
如图7所示,不管是优化配方还是NB液体培养基,培养温度对菌株F11的生长都存在显著影响(P<0.05)。在25~40℃之间,优化配方D600nm值和NB液体培养基的变化趋势一致,且各温度下都以优化配方的D600nm值较高。就优化配方而言,D600nm值呈先上升后下降的趋势,当温度为30℃时D600nm值达到最高,为1.271,此时NB液体培养基的D600nm值亦最高,但仅为0.557,二者间达极显著差异水平(P<0.01);当温度为33~40℃时,D600nm值显著下降;25℃时D600nm值也显著低于30℃时的。由上可见,当初始pH为7.0时,优化配方发酵菌株F11的适宜温度为30℃。
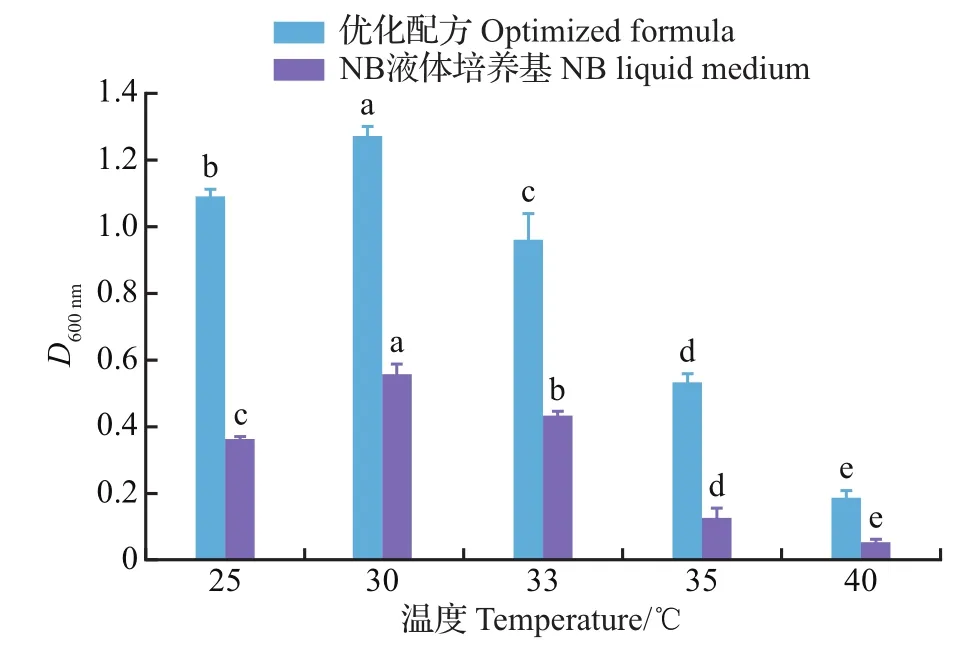
图7 不同培养温度对菌株F11的影响Fig.7 Effects of different incubation temperatures on strain F11
2.6.3 基于优选pH和温度的不同振荡速率对菌株F11生长的影响
菌株F11为好氧菌,因此培养基中溶氧量的多少会影响F11的生长。通过控制发酵过程中的振荡速率调节溶氧量后,菌株F11的生长差异见图8。在优选pH和优选温度条件下,优化配方培养基较NB液体培养基显著提高了F11菌悬液的D600nm值。在100~180 r/min之间,优化配方的D600nm值和NB液体培养基的变化趋势基本一致。就优化配方而言,D600nm值先上升后下降,在振荡速率为150 r/min时D600nm值达到最大,为1.272(此振荡速率下NB液体培养基F11菌悬液的D600nm值亦最大,为0.561);振荡速率为170~180 r/min时D600nm值显著下降。上述结果进一步说明该优化配方有利于促进F11的生长繁殖,且在初始pH 7.0、优选温度30℃条件下,优化配方发酵菌株F11的适宜振荡速率为150 r/min。
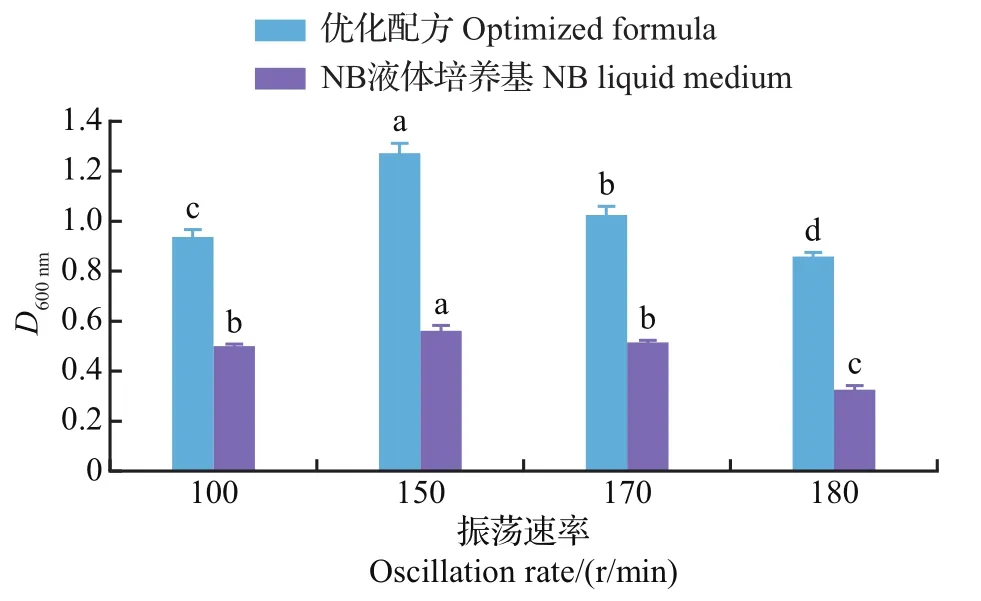
图8 不同初始振荡速率对菌株F11生长的影响Fig.8 Effect of different initial oscillation rates on the growth of strain F11
2.6.4 F11菌株发酵优化对活菌数的影响
如图9所示,基于上述最优发酵条件(初始pH 7.0、温度30℃、振荡速率150 r/min),通过平板计数得优化培养基中活菌数为4.67×109CFU/mL,NB液体培养基中活菌数为1.24×109CFU/mL,优化培养基中的活菌数为NB液体培养基中的3.76倍,二者间达极显著差异(P<0.01)。由此可见,优化培养基培养菌株F11的效果优于NB液体培养基。
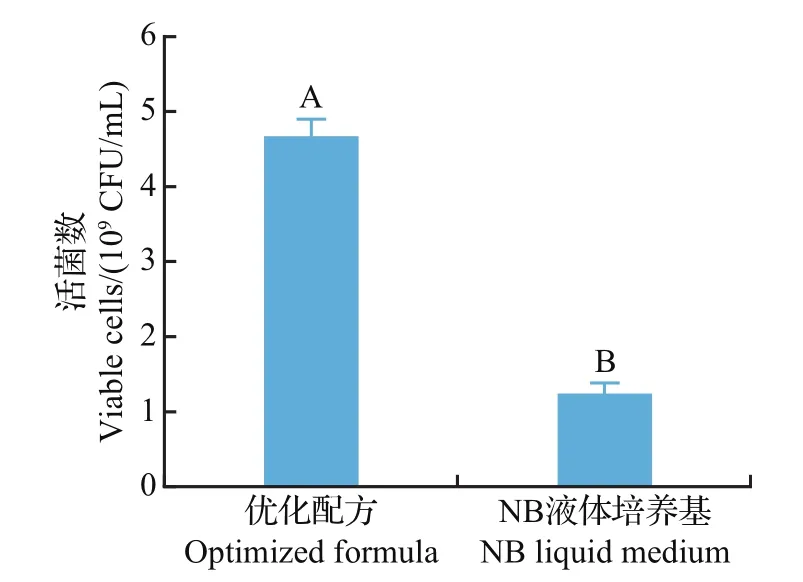
图9 优化配方和NB液体培养基中F11活菌数比较Fig.9 Comparison of viable cells of strain F11 between optimized formula and NB liquid medium
3 讨论
菌株的属种确定可使其更好地应用于生物病害的防治之中。本研究中,根据菌株F11形态特征和生理生化特征,参照文献[21]初步确定该菌株为芽孢杆菌属的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。为了保证生防菌F11鉴定结果的准确性,本研究进一步采用16S rRNA[30-31]和gyrB基因[22,32-33]相结合的生物学方法对该菌株进行了鉴定分析,并基于NCBI数据库的比对结果构建了系统发育树。结果表明:该菌株与解淀粉芽孢杆菌B.amyloliquefaciensFito_F321和解淀粉芽孢杆菌B.amyloliquefaciensRx-35序列的相似性分别达到99.79%和99.89%,二者形态特征、生理生化特征鉴定结果一致,确定菌株F11为解淀粉芽孢杆菌(B.amyloliquefaciens)。
芽孢杆菌属(Bacillus)是一类能够在不利条件下产生特殊抵抗力芽孢和众多抗菌物质的细菌[34],其生长速度快,对环境适应性强,在生物防治中应用广泛[35]。作为芽孢杆菌属中的一种,解淀粉芽孢杆菌(B.amyloliquefaciens)可产生抗生素等次级代谢物质,以抑制有害病原物的生长或直接杀灭病原物;此外,还可产生一系列对病原菌抑制起到重要作用的胞外水解酶[35-36],是一种重要的生防菌种。本研究对解淀粉芽孢杆菌F11(B.amyloliquefaciensF11)的抑菌效果和广谱性进行了探讨。结果发现:除可防治草莓灰霉病外,该菌株对水稻稻瘟病菌、核盘菌等12种常见的供试病原菌都有较高的抑制活性,相对抑制率均在79.88%以上,其中以对核盘菌的抑制率为最高,达100%。可见B.amyloliquefaciensF11具有高效、广谱的抑菌效果。
培养基配方正交优化试验结果显示:牛肉膏、蛋白胨、葡萄糖、NaCl、Mg、Mo对菌株F11的生长繁殖具有显著正效应,Mn具有显著负效应,B和Fe的添加对菌株F11未表现出显著性影响。刘丽等[23]研究发现,对枯草芽孢杆菌F2(B.subtilisF2)而言,Mo的营养效应不显著,Mg、Mn、B和Fe都具有正效应。可见,尽管枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)皆是芽孢杆菌属的成员[37],但影响二者生长的矿质养分因子仍存在较大差异。此外,本试验进一步通过正交设计,确定菌株F11发酵的最优配方为:3.00 g/L牛肉膏、10.00 g/L蛋白胨、5.00 g/LNaCl、3.00 g/L葡萄糖、2.00 g/LMgCl2。
培养基的初始pH、培养温度和振荡速率皆是影响微生物生长代谢的重要环境因子,适宜的培养环境可极大地促进菌株生长,提高产胞能力[38]。本研究在正交设计的优选配方基础上进行了培养条件的优选试验,结果表明:培养菌株F11不适合在碱性环境中生长,最适生长pH为7.0;发酵温度在30℃时,菌株生长良好,不适宜在35~40℃条件下生长;振荡速率以150 r/min为宜。基于优化配方、pH、培养温度及振荡速率的发酵培养条件,经平板计数发现,该菌株的活菌数达4.67×109CFU/mL,极显著高于NB液体培养基中的(P<0.01)。考虑夏季为植物病害的高发期,将其驯化以适应高温环境或在高温环境下能较好地产生抑菌物质是下一步研究的方向。
4 结论
研究结果表明,生防菌F11对水稻稻瘟病菌、核盘菌等12种常见病原菌具有较佳的拮抗性能,抑制率均达79.88%以上,表现出高效、广谱的抑菌效果。经生理生化和基因测序分析鉴定,确定菌株F11为解淀粉芽孢杆菌(B.amyloliquefaciens)。采用正交设计,确定菌株F11发酵的优化配方为:3.00 g/L牛肉膏、10.00 g/L蛋白胨、5.00 g/L NaCl、3.00 g/L葡萄糖、2.00 g/L MgCl2。单因素试验结果进一步表明:基于优化配方,该菌株培养的最佳初始pH为7.0、最适温度为30℃、最宜振荡速率为150 r/min;此外,通过平板计数显示,基于上述优化培养基配方、优化发酵条件,其活菌数相较于NB液体培养基显著提高,为4.67×109CFU/mL。研究结果为该菌株应用于植物病害防治提供了理论依据。

