氨氮及氨基氮检测方法的选择及改进
张兴同
(青岛尚德生物技术有限公司实验室,山东 青岛 266000)
氨氮是以游离氨和铵离子形式存在的氮,是无机氮;氨基氮一般是指以有机自由基团形式存在的氮,大多为有机物中,比如氨基酸中的氮。甲醛滴定法和乙酰丙酮比色法[1]一般用于氨基氮的测定,纳氏试剂比色法[2]通常用于氨氮的测定。
经过理论分析与实验验证发现,如样品未经蒸馏等前处理过程,三种方法检测的均为氨氮与氨基氮的总量。
1 方法的选择
通过对检测准确度、耗时、反应条件和试剂用量及危害四个方面的实验和理论对比发现:纳氏试剂比色法准确度高、批量检测耗时少,操作简便、灵敏度高、试剂用量少且危害小,是微生态发酵生产过程检测最合适的方法。
1.1 准确度

图1 三种方法准确度对比
通过图1可以看出,甲醛滴定法和纳氏试剂比色法相对于乙酰丙酮法在检测结果准确度上具有较大优势。
1.2 检测耗时

表1 三种方法检测耗时对比
由表1可以看出:检测单一样品三种方法检测所需时间差距不大,而八个样品同时检测耗时差距明显。此外甲醛滴定法全程无停顿时间,而比色法可以利用反应时间(10 min或15 min)做一些其它耗时较少的工作。
1.3 反应条件

表2 三种方法反应条件对比
通过表2对比可以看出纳氏试剂比色法对反应条件要求较低,操作更为简便。
1.4 有毒有害试剂种类、用量及挥发性
从表3可以看出:甲醛滴定法有害试剂用量最大,乙酰丙酮法用到两种有毒有害试剂且沸水浴会促进挥发,故两种方法试剂危害都较大;纳氏试剂比色法有害试剂用量少,而且反应温度低(室温),氯化汞溶液微量挥发,危害最小。
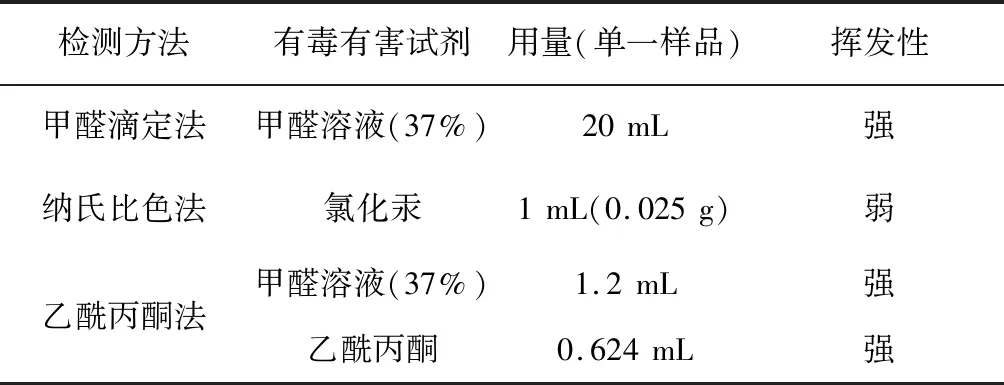
表3 有毒有害试剂种类、用量及挥发性
1.5 小结
对比检测准确率、耗时、反应条件、有毒有害试剂用量及危害,可得出结论:纳氏试剂比色法批量检测耗时少,对反应条件(温度、pH、反应时间)要求不高,试剂用量少且危小,通过补偿校正减小色度与浊度的影响准确度也有了很大提高,是生产过程检测最合适的方法。
2 纳氏试剂比色法方法的改进
2.1 试剂的配置与贮存
2.1.1 纳氏试剂的配置与贮存
国标[2]中纳氏试剂有两种配制方法:HgCl2-KI-KOH和HgI2-KI-NaOH,徐立生等对两种方法进行了多方面的对比[3]得出结论:两种方法均能满足检测需要,方法一虽然配置较为麻烦,但试剂汞含量低,在灵敏度、准确度、空白值、检出限等方面均优于方法二,因此从“清洁分析,节能减排”的理念出发,配置纳氏试剂首选方法为HgCl2法,而HgI2法纳氏试剂可用于应急检测。
通过计算及参阅成春芳等对纳氏试剂配制方法的探讨[4]发现:方法一氯化汞和碘化钾的加入比例应由HJ535-2009方法中为2.5∶5减少2.1∶5,搅拌溶解后,改为滴加饱和二氯化汞溶液继续搅拌,至出现微量朱红色沉淀不再溶解时,停止滴加饱和二氯化汞溶液。
纳氏试剂配置过程反应如下:
(1)HgCl2+2KI=HgI2↓(红色)+2KCl
(2)HgI2+2KI=K2[HgI4](溶解)
(3)2[HgI4]2-=2[HgI3]-+2I-
(4)2I-+ HgCl2(过量)=HgI2↓(红色)+2Cl-
显色基团为[HgI4]2-,它的生成与I-浓度密切相关,开始时,Hg2+与I-按反应(1)式生成红色沉淀HgI2,迅速与过量I-按反应(2)式生成[HgI4]2-,淡黄色显色基团;当红色沉淀不再溶解时,表明I-不再过量,应立即停止加入HgCl2,此时可获得最大量的显色基团。若继续加入HgCl2,反应(3)式和(4)式就会显著进行,促使显色基团不断分解,同时产生大量HgI2红色沉淀,从而引起纳氏试剂灵敏度的降低。
HgCl2-KI-KOH溶液纳氏试剂配制的首选方法,该方法关键在于把HgCl2的加入量,这决定着获得显色基团含量的多少,进而影响方法的灵敏度。方法未给出HgCl2的确切用量,需要根据配制过程中的现象加以判断,经验性强,较难把握。我们依据上述反应原理,根据 (1)式和(2)式得出HgCl2与KI的最佳用量比为0.41∶1。
配置好的试剂应贮存于聚乙烯瓶内,冰箱冷藏保存。
2.1.2 酒石酸钾钠溶液的配置与贮存
酒石酸钾钠溶液配制方法较为简单,但某些分析纯的酒石酸钾钠铵盐含量略高,只靠加热煮沸并不能完全除去,可采取向酒石酸钾钠溶液中加少量碱,煮沸蒸发后,冷却并定容,也可向定容后的酒石酸钾钠溶液中加入少量纳氏试剂,沉淀后取上层清液使用[5]。室温放置时,酒石酸钾钠溶液最多放置30 d,否则会是空白值偏高且不稳定,在冰箱中冷藏,放置时间可达半年,且空白值无明显增大[6]。
2.2 反应条件的确定
2.2.1 显色时间
国标法中仅提到“放置10 min后测定”,在实际的大批量检测分析工作中,因无终止反应的操作,很难控制在刚好反应10 min进行比色,因而确定显色时间对测定结果的影响十分有必要。经实验测定,在室温(20~30℃)下显色不足10 min,吸光度会随显色时间的增加而增大,而10~25 min后的吸光度无明显变化,因此显色时间控制在10~25 min之间即可。
2.2.2 温度
温度会影响纳氏试剂与氨氮和氨基氮的反应速度,进而影响测定结果,选择显色时间10 min,温度在低于15℃时显色不完全,吸光度明显低于20到30℃之间反应的吸光度,而高于30℃,吸光度会略微降低。因而无需对反应温度进行严格的控制,在气温较高或较低时在空调间进行实验即可。
2.2.3 反应体系pH
R-NH2+2[HgI4]2-+3OH-=[Hg2O·R-NH]I+2H20+7I-
由反应公式可知,OH-浓度影响反应平衡,因而反应需在较强碱性环境下才能进行完全,而微生物发酵液如未经酸化处理,稀释到检测倍数后基本为中性,纳氏试剂中OH-含量较高(15%或16%),样品稀释液加入酒石酸钾钠和纳氏试剂后反应体pH值均大于11.8[6-7],为碱性环境,反应体系中OH-含量远大于氨氮及氨基氮含量,故检测微生物发酵液中的氨氮和氨基氮除酸化处理后的样品外无需调pH。
2.3 干扰因素的影响及消除
2.3.1 色度与浊度
因比色法是一种基于显色反应所产生的颜色对透光度具有吸收的性质的方法,若待测样自身带有颜色或浑浊则会对结果产生影响,如何消除色度与浊度干扰,是准确测定的关键。经实验验证:对浑浊且色度深的微生态发酵液进行检测时,纳氏试剂法可以通过补偿校正[8]消除色度与浊度的干扰:空白除不加显色物质碘汞酸钾外,其它与分析水样完全相同。
2.3.2 金属离子
钙、镁、铁离子可与试剂中的强碱产生沉淀,对显色反应产生影响,显色前加酒石酸钾钠可络合钙、镁,避免干扰。
2.3.3 Cl-
当反应体系中氯离子含量达到接近氨氮和氨基氮含量两倍时[9]才开始对测量结果产生影响,而微生物发酵液中氯的含量要远低于氨氮和氨基氮的量,故无需加硫代硫酸钠来消除氯离子的干扰。
3 结语
理论分析和实验证实纳氏试剂比色法批量检测耗时少、准确度较高、对反应条件(温度、pH、反应时间)要求不高、试剂用量少危害小,是最适合微生物发酵样品的批量检测的方法。通过补充说明和改进,纳氏试剂比色法试剂的配置和贮藏、反应条件(温度、时间和pH)的控制和干扰因素对测定结果的影响,方法的细节得到了优化,准确度得到了提高。
此外,纳氏试剂比色法除了能应用于微生物发酵样品中氨氮和氨基氮含量的检测,还可应用于污水中氨氮的测定、氨水含量的测定,另外通过微波消解等手段还可用于食品中蛋白质含量的测定。

