骨性关节炎动物模型研究进展
夏梦熊, 韩海慧, 梁倩倩, 翟伟韬, 徐 浩
(1.上海中医药大学附属光华中西医结合医院, 上海 200052;2.上海中医药大学附属龙华医院, 脊柱病研究所,教育部筋骨理论与治法重点实验室, 上海 200032)
骨性关节炎(osteoarthritis,OA)是一种退行性疾病,其全球患病率在不断上升。目前该病的发病机制尚不明确。OA 的动物模型是研究该病发病机制、预防干预、治疗研究的重要手段。针对OA 的发病特点,目前采用的造模方案主要分为转基因模型和实验诱导模型两种,在这两大类下又根据研究的侧重点形成多种操作方法。各造模方案均有其优点及局限性,故本文针对OA 造模方案进行归纳、分析、整理,综述如下。
1 OA 的动物模型分类
基于OA 疾病的发病原因,OA[1]通常被分为原发性OA(primary osteoarthrosis, POA)和继发性OA(posttraumatic osteoarthritis, PTOA)。POA 是由于关节的退行性变化引起的自发现象,而PTOA 是由危险因素导致的继发性关节炎症,包括创伤、先天性疾病和其他疾病、代谢紊乱或骨骼丢失[2]。在进行实验动物造模时,应根据所研究的方向选择合适的动物模型(图1)。POA 模型主要为转基因模型和自发性模型。转基因模型是通过基因敲除的方式使动物的OA 易感性增加,自发性模型则指未经任何人工处置,在自然条件下发生或由于基因突变的异常表现通过遗传育种保留下来的动物模型。实验室诱导模型通常需要对关节外部进行破坏,从而营造出类似于人类创伤后OA 发病的情况。随着研究的深入,非侵入模型越来越多进入我们的视野。我们将在以下部分中讨论这些模型的优缺点。
2 POA 模型
POA 模型主要为转基因模型和自发性模型。自发性模型指不借助手术、药物注射等人为操作就能发病的动物模型。某些动物的疾病发展较为缓慢,如小鼠、豚鼠、犬,兔和马等,这类动物和人类POA的缓慢进展类似,通常用于自发性OA 模型的研究。此外,各种转基因小鼠模型同样无需手术干预就能形成OA。由于自发性模型动物需要长期观察其骨赘或软骨变化,确保其疾病发展过程更加类似于人类POA的发展过程,所以动物实验的周期会增加,很难进行短期实验。且实验动物的成本也相应提高,如饲养费用和场所费用等,这也给研究带来了一定的困难。这是自发性模型比较突出的一个问题。
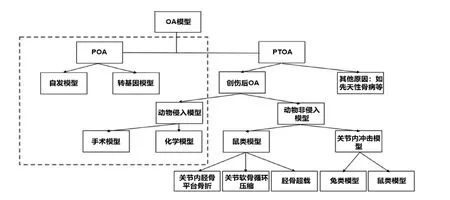
图1 OA 的分类及造模方式
2.1 转基因动物模型
小鼠模型在OA 研究中的主要优点是易于进行遗传修饰。模型中单个基因的丢失或突变,如Ⅸ型胶原蛋白(c o l I X)[3]、Ⅱ型胶原纤维α1(col2α1)、Ⅺ型胶原纤维 α1(col11α1)、聚集蛋白聚糖、膜型基质金属蛋白酶-1(MT-1-MMP)[4]和血小板反应蛋白解整合素金属肽酶5(ADAMTS5),可导致类似于OA 患者的软骨退化。更具体地说,软骨细胞的破坏会导致软骨基质的形成和重塑的中断[5-6]。近期研究[7]显示,在Dot1 基因敲除小鼠可观察到OA 的易感性增加,实验同时表明增加小鼠体内的Dot1 活性可预防OA 的发生,并延缓疾病进展。
富含亮氨酸重复序列的小分子蛋白多糖(SLRP)是与转化生长因子β(TGF-β)、胶原蛋白和其他分子结合的细胞外分子。在体外,SLRP可以显示调节胶原纤维的形成。二聚糖(BGN)和纤维调节素(FM)是两种最突出、表达最为广泛的SLRP。环化重组酶 Cre-loxP[locus of X (cross)overin P1]位于编码骨形态发生蛋白(BMP)受体1a(Bmpr1a)的基因侧翼。编码生长分化因子5(Gdf5)基因的启动可以消除该BMP受体并指导Cre表达[8]。因此,Cre-Gdf5/Bmpr1afloxP这种条件性敲除小鼠不能在关节发育过程中选择性地产生BMP1a型受体[9-11]。B G N 缺陷型小鼠、FM 缺陷型小鼠、BGN/FM 双敲除小鼠和Cre-Gdf5/ Bmpr1afloxP小鼠关节炎出现得更早也更加严重。P t c h 1+/-、Col2A1-Gli2、COL2-rtTA-Cre、Gt(ROSA)26Sortm1(Smo/YFP)AM 转基因小鼠也被用于OA发展进程研究。其中,Col2A1-Gli2 转基因小鼠在软骨细胞中的C o l 2 A 1 调节元件下过表达hedgehog(Hh)激活转录因子Gli2[12]。Gt(ROSA)26Sortm1(Smo/YFP)AM 转基因小鼠通过Cre 介导的重组表达平滑受体SMO同源蛋白(SmoM2)的成型活化W539L点突变。当在多西环素给药下将该突变小鼠与COL2-rtTA-Cre 小鼠杂交时,SmoM2在软骨细胞中表达。其他突变小鼠如TNF转基因小鼠就会产生严重的关节破坏,并出现骨赘和软骨下骨僵硬[13]。
2.2 自发性模型
目前研究OA 自发性模型的重点聚焦在小型动物上, 例如STR/ORT 小鼠、C57BL/6 和BALB/c小鼠[14]。小鼠用于检查软骨退化[15],包括软骨基质中糖胺聚糖的损失,Ⅱ型胶原降解[16],软骨细胞中蛋白质转运和糖合成的干扰,以及半月板前段游离边缘的不规则性。交叉韧带胶原代谢速度会加快[17],且小鼠会在晚期出现步态的退化[18]。小鼠模型缺乏形态学变化,例如软骨基质的纤维化,软骨细胞聚集,骨赘形成或炎症,这些形态改变都很难在小鼠的关节内观察到,其原因可能是小型动物关节较小、关节修复能力差。
自然界中同样存在一些动物随着年龄的增长会自然出现OA 的病理表现,既不需要使用基因修饰手段,也不需要进行外科手术操作对其关节进行破坏。长寿命的动物可以通过年龄增长自然地发生OA,因此认为猕猴模型适用于软骨胶原变化的研究。形态学研究表明,猴和人类一样,OA 发病的特征在于软骨细胞密度的持续变化,包括钙(Ca)、磷(P)、镁(Mg)、硫(S)、钾(K)、糖胺聚糖(GAG)和胶原蛋白[19]在低龄动物体内的增加[20]。猴类动物模型患病率高,且大型动物的关节很大,更容易进行放射学和形态学研究。但是使用灵长类动物的缺点也很明显,如成本高、生存环境因素难控制、道德问题等。
3 PTOA 模型
如前所述,PTOA 是在特定原因或风险因素存在的情况下发生的。这些原因包括先天性钙沉积,骨骼、关节和代谢疾病。PTOA 由于受影响关节的损伤而发生,我们可以通过直接或间接诱导关节损伤引起关节炎症,即:侵入性模型和非侵入性模型。
3.1 侵入性动物模型
3.1.1 手术模型 Hulth-Telhag模型是最为经典的OA 模型,方法为将动物半月板完全切除,并剪短胫骨侧副韧带[21]。术后3 周就可以在该模型动物中观察到II 型胶原的降解[22]。近几年流行的手术模型是前交叉韧带切断(ACLT)[23]和部分半月板切除模型。髌骨切除与ACLT 的结合可以在手术后约2 周加速OA 的发生并推动其发展[24]。此外,还有内侧半月板不稳定手术(DMM)[25],部分内侧半月板切除术(PMM)[26],内侧副韧带切除和内侧半月板切除术(TMCL/MM)[27]。其中,TMCL/MM可以通过步态分析检测出明显行为学改变[28],该模型中关节炎症状及其修复过程主要在软骨和滑膜中发生。将成年兔前十字交叉韧带切断,可以造成结缔组织的成纤维变化,破坏软骨形态[29]。Marijinissen 等[30]提出的关节划痕模型通过一次性创伤诱导软骨退化,且该模型不引起原始模型的滑膜炎症特征。此方法有效提高了针对软骨保护和修复治疗缺陷检测的灵敏度。此外还可以通过切除大鼠卵巢降低雌激素水平,模拟更年期OA患者的症状[31]。
3.1.2 化学模型 在OA 结构模型中,关节中的一个或多个结构组织成分降低。一般来说,该OA 模型基于它们对靶组织或组织成分(例如胶原蛋白、蛋白多糖、软骨细胞或滑膜细胞)的作用被分为不同种别(例如物理、化学和酶)。内分泌调节如关节内皮质类固醇给药,高脂肪饮食或口服喹诺酮类似物可以全身性地促进OA 发展。这些动物模型可以帮助研究OA 的发病机制,尤其是在细胞和分子水平[32]。
化学改变是指在关节腔内给予化学试剂,如加热剂、固定剂、蛋白质变性剂、酸碱或离子溶液,以降解基质和浅表关节软骨[33]。对大鼠关节注射单碘乙酸可以诱导OA 的疼痛反应,造成非常快速严重的骨破坏[34]。
目前用于建立模型最常用的技术是酶促改变。这类模型可由木瓜蛋白酶、胰蛋白酶、透明质酸酶和胶原酶诱导的蛋白水解产生[35]。木瓜蛋白酶可以分解软骨基质中的蛋白多糖,从而降低软骨弹性及抗压性,减弱其对软骨细胞的保护作用,木瓜蛋白酶分解后产物可刺激滑膜及关节腔内炎性反应,该方法是研究关节炎滑膜和软骨改变进展情况的造模方式之一[36]。木瓜蛋白酶模型成模速度快,关节破坏严重,难以观察到骨关节炎的进展过程,适用于短期PTOA 的观察和研究。
3.2 非侵入性动物模型
几十年来,PTOA 的研究主要使用侵入诱导模型。这些模型在造模过程中需要使用无菌技术来避免感染,感染引起的炎症变化会严重影响实验结果[32]。这些模型的成功还取决于研究人员在手术过程当中能否在同批次动物身上重复相同手术的能力。这些问题都可以通过非侵入模型来解决。非侵入模型对实验动物产生的损伤无需外科手术和物理化学方法进行干预,这类模型由机械驱动对关节造成损伤而不会导致皮肤破损,因此就杜绝了手术过程中感染的可能。另外,因为将动物绑定在固定位置进行操作,可以确保同批次造模动物的可重复性。这些都是非侵入模型的优势所在[38]。
3.2.1 鼠类模型 非侵入性小鼠模型的使用是为了在动物模型中消除人类创伤损伤时可能诱导OA发病的混杂因素。这类模型可用于OA 研究的早期阶段,可能成为开发PTOA 早期干预治疗的必要条件[40]。小鼠模型的测量手段包括微型计算机断层扫描、对蛋白多糖含量进行染色等,这些方法均遵循临床上对OA 的病理研究标准[41]。聚集蛋白聚糖是软骨中的主要成分,对关节切片进行番红固绿染色显示番红染色的丢失,提示蛋白多糖损失[42],由此来证明软骨缺损。
非侵入性OA小鼠模型主要有: ①关节胫骨平台骨折,是非侵入性小鼠模型最早的模型[43]。在该模型中,将麻醉后小鼠的膝盖弯曲并固定在三角形支架上,利用压头提供冲击力。压头会引起关节的闭合性骨折,通过调整压头的施加力度可以调整关节损坏的程度。这些骨折可以复制由高能量冲击(例如机动车事故)造成的人体损伤。关节内胫骨平台骨折也可以跟踪OA 中炎症的早期影响[44],也是研究急性损伤后关节退变中发生致病性变化的理想模型。②关节软骨胫骨循环压缩,在该模型中,向膝关节施加轴向载荷,导致胫骨相对于股骨的前移[45]。通过在一段时间内多次循环并调节关节上的载荷可以研究长期损伤对关节的影响。而通过短时间内重复负载可用于研究软骨下骨的变化。但该模型中对侧肢体不能用作同侧肢体所承受负荷的对照[46]。该模型中可见膝关节骨赘加速增加,负荷较高时可见更快速的软骨退变[47]。关节软骨胫骨循环压缩模型是研究慢性损伤对发育影响的首选模型。③关节过载,与关节软骨循环压缩模型一样,关节过载模型依赖于类似胫骨前半脱位机制产生损伤。前者存在的问题是需要长时间多个循环来诱导OA 的严重症状。这种胫骨压缩过载导致交叉韧带的中间物质破裂。由于周期性胫骨压迫引起的交叉韧带撕裂与人类交叉韧带损伤病理相似。如果负荷和速度足够强,交叉韧带会从中间部位撕裂,如果负荷或速度较低则从胫骨平台下方撕裂[48]。该模型非常适合研究早期OA 的变化以及急性低能量影响后早期治疗的效果(如膝关节运动损伤)[49-50]。
3.2.2 关节内冲击模型 关节内冲击模型主要应用在犬和兔类。造模的装置都是落塔装置,该装置可以敲击髌骨,并对髌骨造成损害,使动物关节呈现髌骨性关节炎的病理特征。
①犬类模型。目前已开发多种非侵入性犬模型用于OA 各个方面的研究[51]。犬科动物模型中使用了拉布拉多犬、金毛猎犬和德国牧羊犬等多种品种,而比格犬是非侵入性模型犬类中最常用的动物。利用落塔装置撞击髌骨可用于模拟因关节撞击后关节软骨出现的OA 早期病理变化[52]。且此法可以产生较高的软骨病变[53]。有研究[54]表明,犬类模型可以使用自体骨移植,并在12 个月时明显改善关节症状。对OA 犬类使用富血小板血浆治疗改善跛行症状[55]。犬类模型还提供了一种新的可能,即利用MRI 及mCT 影像结果取代组织病理学来对OA 发病程度进行测量[56]。
②兔类模型。类似于犬类模型,兔类模型也是通过关节内冲击对兔的髌骨造成机械性损伤。亚骨折是导致兔膝盖OA 变化的原因之一,有的兔模型则利用过量运动来诱导骨重塑[57-58],此外还有大量利用摆锤撞击股骨髁导致膝外伤的模型[59]。然而,撞击股骨髁模型和兔关节拉伸后冲击模型在进行造模过程中或多或少会采取手术方式,此举会带来一些不利影响,在前文中有所提及。
4 总结
OA 实验动物模型种类繁多,造模方式各异,不同的造模方式有不同的适应范围,但其基本原理大都为模拟人体OA 发病过程中的生物力学改变、局部软组织生理病理改变、整体激素水平改变等。大型动物关节结构较人体结构更为相似,但由于饲养成本高、伦理审批难以通过等原因在普通的实验研究中难以使用;而小动物虽容易饲养但关节腔的体积非常小,很难利用影像学进行分析。各种动物不同模型各有利弊。综上所述,合理地选择实验动物和造模方式可以使我们在动物模型上更好地模拟人类OA 的发病机制和过程, 更全面地阐释中医药治疗OA 的药效机制。

