国内外大鼠和小鼠微生物、寄生虫检测标准的比较
陶凌云, 周 洁, 胡建华, 高 诚
(上海实验动物研究中心, 上海 201203)
实验动物作为研究材料或研究条件,其标准化程度是至关重要的。如果缺乏优质、标准的实验动物,我们将很难取得准确、可靠、重复性好的科学实验结果。
美国纽约科学院早在1944年就率先提出了实验动物标准化问题,日本也于1952年成立实验动物中央研究所, 专门从事实验动物标准化工作[1]。我国于1988年颁布第一部实验动物管理法规——《实验动物管理条例》。1994 年颁布第一套实验动物质量国家标准,并先后于2001 年和2010 年进行了修订。
实验动物质量标准化是实验动物标准化的重要内容之一,主要包括遗传学质量和微生物学质量。虽然各个国家或组织制定的质量标准内容不完全相同,但基本要求都是一致的。由于大鼠、小鼠个体小,生产繁殖快,饲养管理方便,质量易于控制,对其研究最为深入。本文以大鼠、小鼠为代表,介绍国际实验动物科学协会(International Council of Laboratory Animal Science,ICLAS)、欧洲实验动物学会联盟(Federation of Laboratory Animal Science Associations, FELASA)、美国杰克逊实验室(JAX)、美国查士瑞华实验室(Charles River Laboratories, CRL)、美国Taconic Bioscience, Inc和日本实验动物中央研究所(Central Institute of Experimental Animals, CIEA)这6家国际知名机构和公司的大鼠、小鼠微生物和寄生虫检测指标, 并与我国实验动物国家标准(GB 14922.1-2001、GB14922.2-2011)进行分析比较,为我国实验大鼠、小鼠质量检测提供借鉴。
1 国内外大鼠、小鼠微生物和寄生虫检测指标比较
一些发达国家及地区实验动物机构建议实验动物生产和使用单位在制定健康监测方案时,不仅要考虑实验动物等级标准,而且应根据自身实际情况,制定个性化的健康监测方案[1]。
ICLAS 主要通过建立标准及资源支持,促进高质量实验动物的监控与生产[2]。ICLAS 实验动物质量检测中心2012年所规定的微生物和寄生虫检测项目[3],与我国实验动物质量检测国家标准(GB14922.1-2001、GB14922.2-2011)规定项目[4-5]相比,有一定差别。ICLAS要求检测的项目更多,其中小鼠病毒检测项目14 个、大鼠6 个(表1); 小鼠病原菌检测项目19 个、大鼠9 个(表2); 小鼠和大鼠寄生虫检测项目均为1 个(表3)。
FELASA 每隔几年更新一版最新的啮齿类、家兔繁殖和实验单元的健康监测指导意见[6]。2014版FELASA指导意见涵盖的病毒检测项目小鼠13 个、大鼠12 个(表1); 病原菌检测项目小鼠13 个、大鼠9 个(表2); 寄生虫要求排除所有体内和体外寄生虫(表3)。FELASA强调其指导意见是健康监测的最低要求。
美国JAX、CRL 和Taconic 公司是全球最有实力的实验动物产品和技术服务供应商之一,他们的健康监测方案具有很高的参考价值。JAX[7]要求在饲养单元内必须排除的病原体有: 病毒17项(表1)、病原菌10 项(表2)、寄生虫8 项(表3);CRL[8-10]健康监测方案涉及病毒检测项目小鼠19项、大鼠15 项(表1),病原菌项目分为上呼吸道微生物和胃肠道微生物检测,大鼠、小鼠上呼吸道细菌检测项目均为12项,胃肠道细菌检测大鼠3项、小鼠8 项(表2), 寄生虫检测项目大鼠2 项,小鼠1 项(表3); Taconic[11]的全球健康监测系统表明,无病原体小鼠必须排除病毒20 项、病原菌21 项、寄生虫16 项,无病原体大鼠必须排除病毒13 项、病原菌20 项、寄生虫16 项(表1、表2 和表3)。3家公司均强调指出要根据实际情况制定适合的健康监测方案。
CIEA[12]将大鼠、小鼠微生物监测项目分为核心检测项目和备选检测项目。核心检测项目列明小鼠病毒项目4 种、大鼠病毒项目4 种(表1),小鼠病原菌项目11 项、大鼠病原菌项目10 项(表2),大鼠、小鼠寄生虫项目均为5 项(表3)。
我国实验动物国家标准《实验动物 微生物学等级及监测》(GB14922.2-2011)[4]、《实验动物 寄生虫学等级及监测》(GB14922.1-2001)[5]规定实验小鼠病毒检测项目11 个, 其中必检项目6 个,必要时检测项目5 个, 大鼠病毒检测项目8 个,全部为必检项目(表1); 小鼠病原菌检测项目15 个,其中必检项目8 个,必要时检测项目7 个,大鼠病原菌检测项目15 个,其中必检项目9 个,必要时检测项目6 个(表2); 大鼠、小鼠寄生虫检测项目7 个,其中必检项目5 个,必要时检测项目2 个(表3)。
从以上对比可以看出,一些病原体如小鼠轮状病毒、微小病毒、诺如病毒、螺杆菌、CAR杆菌(Cilia-associated respiratory bacillus)、柠檬酸杆菌(Citrobacter rodentium, CBR)、牛棒状杆菌(Corynebacterium bovis)等早已被国外机构和公司列入必检范围,但我国的SPF 级动物国家标准中却没有列入。小鼠轮状病毒能引起乳鼠流行性腹泻,主要发生于第1 胎的哺乳小鼠,本病发病率高,病毒传染性很强,而且病愈小鼠及其亲代母鼠可长期带毒,对实验鼠群构成严重威胁[13];小鼠诺如病毒在我国的感染率很高,广东省2010年首次检出小鼠诺如病毒,携带率高达37.38%[14],它可以导致一些先天性免疫缺陷小鼠发生致死性的感染;小鼠微小病毒(MPV)是鼠脾细胞培养物潜在的污染物,小鼠感染后通常无临床表现,但在涉及免疫系统、肿瘤和移植的实验中,体内外感染 MPV 可影响小鼠体内的免疫调节,从而对实验研究结果造成严重偏差[15]; 啮齿类动物螺旋杆菌在全球范围内广泛存在,该菌对不同品系的大鼠、小鼠均有感染,对雄性鼠的肝损伤略大于雌性鼠,大多以慢性感染的潜伏形式存在,但对于免疫缺陷动物或免疫力降低的正常动物,可表现为多类炎症、肿瘤甚至死亡[16],国外机构和公司均将其列入必须检测项目,但我国国家标准还未将其纳入必须检测项目; CAR杆菌多与肺支原体和病毒协同感染,引起细支气管扩张、化脓性支气管炎、气管炎、肺脓肿、肺不张,该菌不能在无活细胞的人工培养基上生长,因此该菌的检测具有一定困难,菌株的差异使PCR 方法在我国也无法开展[17]。本文所列六大机构和公司除FELASA外,其余5 家均将CAR 杆菌列入检测方案中,而我国没有将其列为实验动物检测项目,对该菌的研究基本为空白,缺乏病原学、流行病学资料。
国内外寄生虫检测项目总体一致,但国外标准的要求更高,FELASA 要求排除所有体外寄生虫和体内寄生虫(追溯到“属”); JAX 也要求排除小鼠的体外寄生虫(跳蚤、虱子、皮毛螨)和体内寄生虫(绦虫、蛲虫、其他蠕虫),还有机会性原生动物例如贾第鞭毛虫、锥虫。国外的标准也更为细化, 有些机构特指需要排除四翼无刺线虫、艾美尔球虫、膜壳绦虫属、鼠肉螨、鼠癣螨等。
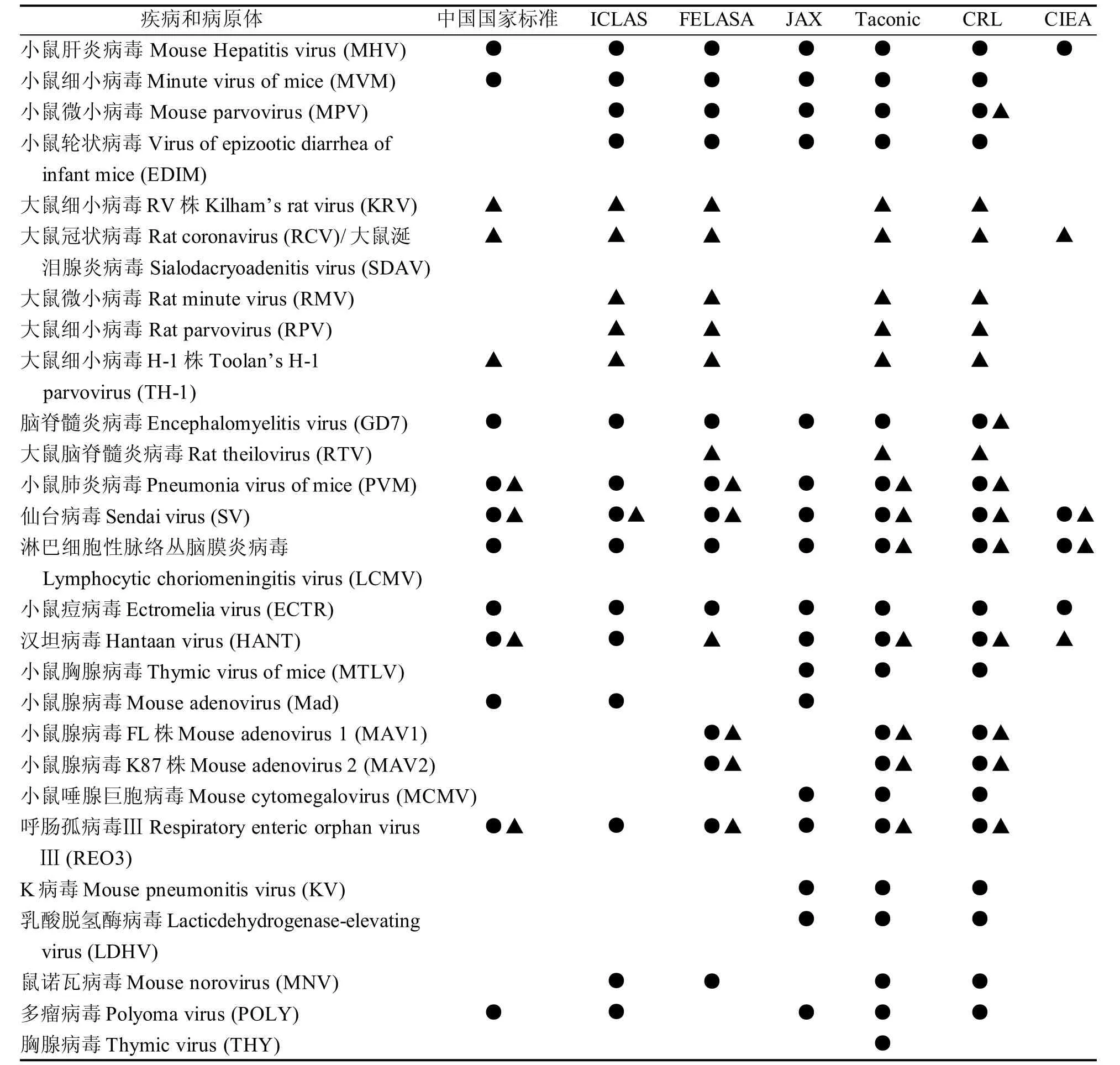
表1 SPF 级啮齿类实验大鼠、小鼠病毒学标准对比Table 1 Comparison of virological standards for SPF rats and mice
2 国内外大鼠、小鼠微生物和寄生虫检测方法比较
国内实验动物的检测方法主要有: 酶联免疫吸附试验(ELISA)、免疫荧光试验(IFA)、血凝试验(HA)、血凝抑制试验(HAI)、补体结合试验(CF)、免疫酶染色试验(IEA)、斑点免疫试验(DIA)、放射免疫诊断实验(RID)、培养法(Culture test)、聚合酶链式反应法(PCR test)、镜检法(Microscopy)等,其中病毒项目首次检测多选用E LISA 和IEA,验证多选用IFA 和HAI 等方法。国外机构和公司采用的方法包括多重荧光免疫分析(MFIA)、ELISA、IFA、HAI、乳酸脱氢酶血液生化分析方法或生物化学方法(CHEM)、杂交免疫印迹试验(WB)、PCR、培养法和镜检法等。其中,病毒项目首次检测多选用MFIA或ELISA,对可疑或阳性结果会采用其他方法,如IFA、WB、PCR 等进行验证。2000 年Notomi 等建立了一种环介导恒温扩增(Loop-mediated isothermal amplification, LAMP)的核酸扩增新技术[18],短短几年,该技术在病毒的快速检测方面发展迅速,可对多种病毒进行检测和鉴定,已经发展成为最有前景的快速诊断手段,例如:鼠痘病毒、仙台病毒、小鼠肝炎病毒等的LAMP 检测方法均已建立[19-21]。

表2 SPF 级啮齿类实验大鼠、小鼠病原菌标准对比Table 1 Comparison of bacteriological standards for SPF rats and mice

表3 SPF 级啮齿类实验大鼠、小鼠寄生虫学标准对比Table 1 Comparison of parasitological standards for SPF rats and mice
3 国内外大鼠、小鼠微生物和寄生虫检测频率比较
我国国家标准中SPF级动物的检测频率为每3 个月一次, 检测项目是固定的。而国外机构和公司在检测频率上的设定更为合理、细致。JAX根据所检病原体的流行性和多发性确定检测频率[22], 大部分病原体都是6 周检测一次, K 病毒和乳酸脱氢酶病毒(LDHV)是一年一次,梭状杆菌(Clostridium piliforme)是一个季度一次;CRL则按照所检病原体的特性制定检测频率,更为灵活,每13 周就会对3 个不同年龄段的12~16 只动物进行血清学、细菌学、寄生虫学的检测,每4 周从屏障房间内的排风口和垫料中搜集样品进行检测;在野生啮齿类和实验动物设施中都很常见的螺杆菌属,每个季度所有的种群都会采用PCR的方法检测。
4 讨论
李灵恩等[23]对2016 年1 月—2016 年12 月来自于美国、德国、日本的170批次不同品系的340只实验小鼠,以及来自国内各科研单位119 批次不同品系的232 只实验小鼠,进行LCMV、HV、ECT、SV、MHV、MVM、MPV 和TMEV 共8种常见病毒的检测;结果表明,来自国外的实验小鼠检测结果均是阴性,国外引进的小鼠检出率低,而来自国内的小鼠MH V、SV、TME V、MPV、MVM 均有一定程度的检出率。该研究结果说明美国、德国、日本等发达国家在实验动物方面拥有较为完善的组织机构和管理应用体系,按照要求定期对动物质量进行严格的检测,且对动物健康及标准参数有明确规定; 国内来源的小鼠背景复杂, 质量管理水平参差不齐,存在隐性感染的情况。
在日常工作中,要求管理者采用最严格的微生物控制标准排除所有病原体,使用者使用最高级别的实验动物不一定是最合适的。因为,对于动物饲养机构而言,采用最严格的控制措施会浪费很多资源,完全消除这些病原体也是不现实的。对于实验动物使用者而言,实验动物健康监测方案如能根据研究目的来制定,而不是不同的研究项目使用同一种健康监测方案,更为简单有效[1]。通过健康监测可以防止直接接触的感染,但病原体感染易感实验动物比较难以控制的是间接传播,即空气、饲料、水、用具、节肢动物、野生动物和人;在实验动物环境与设施国家标准中,技术指标多为物理参数,如温度、压差和洁净度等等,化学参数仅有一个氨浓度,生物学参数仅为沉降菌。最近有报道[24-25]采用PCR方法检测IVC 排风口碎片和盖子过滤材料进行小鼠种群和啮齿类微生物病原体检测比较,检测参数包括细菌、病毒和寄生虫(线虫和螨)。采用宏基因组方法对实验动物环境设施进行生物学参数检测可以反映和评价实验动物环境设施状况,预警动物种群的健康。
随着肿瘤学、免疫学、药品与生物制品的安全性评价及有效药品的筛选等实验推广,裸小鼠以及转基因小鼠的应用越来越多,对其质量检测要求也越来越高。而传统的间接 ELISA 方法检测血清抗体并不适用这类实验动物,因裸小鼠有免疫缺陷,因此感染病毒后不易产生抗体,用ELISA 方法检测裸鼠的病毒抗体易产生假阴性。在我们日常检测工作中还发现转基因小鼠存在非特异性抗体增高的现象,即特异性抗原孔吸光度(A)值增高的同时,对照孔的 A 值也同时增高,说明用间接 ELISA 方法检测转基因小鼠病毒抗体的本底值较高,易产生假阳性。作者单位实验室建立的几种小鼠易感病毒环介导等温扩增可视化检测方法就是一种高效、便捷、稳定的直接检测抗原的方法[20],相比较传统 PCR 而言有着检测更迅速、灵敏,适用于各种实验条件(尤其是县市基层) 的快速检测使用等优点,因而有很大应用潜力。
我国国家标准与ICLAS以及欧洲、美国和日本的相关机构相比,涉及的检测项目相对较少,近年来流行的影响实验动物及动物实验的一些病原体未能涉及,检测的频率也过于固定(3 个月一次),不够灵活;一些阳性率极低的检测项目,例如大鼠HV 病毒、小鼠Ect 病毒,可以适时减少检测频次,根据不同病原体的特性调整监测计划,既能保证动物质量,又可节省经费,使质量检测工作在确保实验动物质量方面起到应有作用。为使我国实验动物标准尽快与国际接轨,保证我国生物医药领域中动物实验结果在国际上具有可比性、得到公认,现有检测标准应参照国际知名机构和公司拓展更多项目,检测方法也应更加多样化,只有采用几种方法联合应用,取长补短,才能提高检测结果的准确性和可靠性。
[感谢上海润诺生物科技有限公司王娱、上海交通大学医学院李垚博士、 诺华(中国)生物医学研究有限公司黎明、 迪哲(上海)医药有限公司卢晓博士、上海药明康德新药开发有限公司贾敏为本文提供的资料支持]。

