精胺普鲁兰-siRNA复合物转染白血病细胞方法的研究
万 严,刘 红,赵 昀,马文娟
(1.苏州大学唐仲英血液学研究中心,江苏 苏州 215123;2.苏州大学附属第一医院,江苏 苏州 215006)
白血病是一种起源于造血干细胞的恶性克隆性疾病。虽然,随着科技和医疗水平的发展,其诊疗方法得到很大的改善,但仍有大量患者面临复发的风险[1-2],因此,寻找有效治疗方案依然是该疾病目前需要解决的难题。为了更有效地治疗白血病,仍需阐明该疾病的细胞与分子致病机制,而白血病细胞普遍难以转染,因此需要寻找有效的递送载体以促进白血病致病机制的探索。小干扰RNA(siRNAs)是短的双链核酸,它特异性地抑制靶基因表达并阻止特定蛋白质的合成[3],可以在研究白血病细胞与分子致病机制中发挥重要作用。此外,白血病干细胞及静息期(G0)细胞被认为是该疾病维持和产生抗药性的原因,所以根除白血病干细胞及G0期细胞对于疾病的治疗至关重要[4-6]。因此,能有效递送siRNA进行白血病细胞,包括干/祖细胞或G0期细胞的方法将有利于白血病致病机制的探索。
体内递送siRNA到靶组织是一个比较复杂的过程。目前,可以用病毒和非病毒载体将siRNA递送至细胞。病毒载体能够较非病毒载体实现更有效的基因递送;但病毒载体可能会引起插入突变,具有致癌作用并引发免疫反应[5]。非病毒载体递送效率较低,但也具有其自身优势,例如分子组成的精确控制,改性后的多功能性及载体尺寸的耐受性[7-8]。许多文献报道使用阳离子载体和穿透肽将siRNA递送到各种细胞[9-10],包括来自黑酵母的非离子多糖普鲁兰(pullulan)。由于普鲁兰的无毒、无免疫原性、非诱变性和非致癌性的特性,它已被开发为新型基因递送载体[11]。它可以被包括精胺在内的多种材料修饰,能够将质粒DNA和siRNA传递至多种细胞中[12-13];本实验室的前期工作表明以精胺普鲁兰(spermine-introduced pullulan, Ps)为载体,可有效递送miRNA至慢性髓细胞白血病(CML)干/祖细胞中[14]。然而,该载体能否也应用于siRNA的递送,以及该方法能否适用于更多种类的白血病细胞和特殊状态的白血病细胞(比如,静息期干/祖细胞)都值得继续探讨。
本文将详细介绍如何利用Ps递送siRNA到白血病细胞,包括静息期的白血病干/祖细胞。该方法有望为进一步系统研究白血病细胞与分子致病机制及治疗策略提供新工具。
1 材料和方法
1.1 细胞 人CML细胞株K562、人急性T淋巴细胞白血病(T-ALL)细胞Hut78、人B细胞淋巴瘤(B-cell lymphoma)细胞Raji购于中国科学院上海细胞生物所细胞库,人急性髓细胞白血病(AML)细胞株SHI-1由苏州大学附属第一医院陈苏宁教授馈赠,CML患者骨髓样本由苏州大学附属第一医院血液科提供。使用含有10%胎牛血清(56 ℃灭活30 min)的RPMI 1640培养基培养上述各种细胞株;利用含有细胞因子的IMDM培养基培养骨髓样本,培养基中含有20% BIT、1% β-巯基乙醇、1%谷氨酸、100 ng/mL SCF、100 ng/mL FLT-3L、20 ng/mL G-CSF、20 ng/mL IL-3和20 ng/mL IL-6。细胞在含5% CO2的培养箱中37 ℃培养。
1.2 Ps转染siRNA Ps由北京协和医学院刘健研究员和许海燕教授馈赠[13]。使用DEPC水溶解Ps粉末,配制浓度为250 μg/mL的母液,经0.22 μm滤器过滤后,置4 ℃备用。将订购于上海吉玛生物科技有限公司的siRNA用DEPC水配制成20 μmol/L的母液。实验前取一定量的Ps和siRNA混匀,并加DEPC水补至50 μL,室温放置15 min。将待转染的细胞用1×PBS洗2 遍,用Opti-MEM培养基重悬(1×105个/mL)。将1 mL细胞重悬液(1×105个)置于1个细胞培养孔中(24孔培养板),并加入预制好的Ps-siRNA的混合液(50 μL),孵育6 h后用1×PBS洗2 遍,加入相应的培养基继续培养。1.3 细胞活性检测 将经转染的细胞接种在96孔板(1×104个/200 μL)中,37 ℃培养48 h后,在每个孔中加入CCK-8(Cell Counting Kit-8,Beyotime,Shanghai,China)试剂(10 μL),继续培养4 h后用酶标仪(SpectraMax M5,Molecular Devices,Sunnyvale,CA,USA)检测。
1.4 流式细胞术(Flow Cytometry) 收集3×105个经Ps-siRNA复合物转染的细胞,1×PBS洗2 次后,用500 µL PBS重悬细胞。使用流式细胞仪(CaliburTM,Becton-Dickinson,Franklin Lakes,NJ,USA)检测转染效率。
1.5 静息期细胞的分离 在无血清培养基中培养CML患者细胞过夜。第二天清洗细胞,并在含有2%FBS的Hank'缓冲液中加入Hoechst 33342(Hst,10 mmol/L),37 ℃避光、温浴45 min,再加入Pyronin Y(Py,2.5 mg/mL)温浴45 min,最后使用CD34-APC抗体和PI(1 mg/mL)染色细胞20 min。而后,使用FACS分离HstloPyloCD34+细胞(G0细胞)和Hstlo/hiPyhiCD34+细胞(G1/S/G2细胞)。
2 结果
2.1 利用K562和Raji细胞检测Ps-siRNA复合物的毒性将配置好的siRNA(1.06 μg)与不同量的Ps(结构如图1A,范围0.625~7.5 μg)混合以形成复合物(N/P范围为0.6~7.2),然后将这些复合物与K562和Raji细胞共同孵育,24 h后检测细胞活性。结果显示,K562和Raji细胞的IC50分别为2.45和2.5 μg Ps,即N/P值分别为2.35和2.4。并且,当Ps为1.25 μg时,K562和Raji细胞的活性都在90%以上(图1,见封二)。

2.2 不同剂量的Ps对递送效果的影响 为检测Ps剂量对siRNA转染效率的影响,根据毒性检测结果,分别选取0.625、1.25和1.875 μg的Ps与FAM标记的siRNA混合(1.06 μg),然后对K562、SHI-1、Hut78和Raji等白血病/淋巴瘤细胞进行转染。结果显示,siRNA量不变时,转染效率和荧光强度随着Ps的增加而增强(图2)。

图2 不同剂量的Ps对siRNA转染效率的影响Fig.2 Effects of Ps amount on the delivery of Ps-siRNA nanoparticles to various leukemic cells
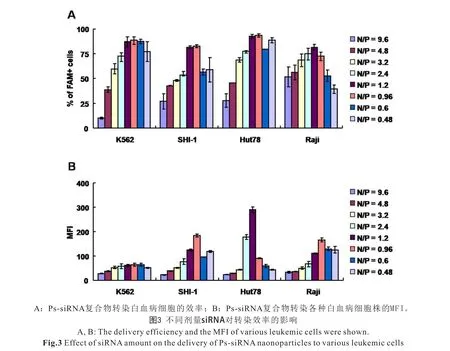
2.3 不同剂量siRNA对递送效率的影响 为了进一步检测不同剂量siRNA对递送效率的影响,我们固定Ps的剂量与不同剂量的siRNA混合,然后检测其转染效率。从图2可以看出1.875 μg的Ps转染效率高于90%,但是该剂量对细胞毒性比较大,而Ps为1.25 μg时,细胞活性在90%以上,转染效率在80%以上。于是,我们固定Ps的剂量为1.25 μg,分别与不同剂量siRNA(0.13~2.67 μg)混合,孵育6 h后检测转染效率。结果显示:当加入1.06和1.34 μg的siRNA时,具有较好的转染效率。综合上述实验结果,选取1.06 μg的siRNA和1.25 μg的Ps为最佳剂量,即N/P=1.2(图3,见封二)。
2.4 Ps-siRNA能有效抑制白血病细胞中靶基因的表达 为验证Ps-siRNA复合物在携带siRNA进入细胞后能抑制靶基因的表达,以K562细胞为模型,对靶向ID2的siRNA进行研究。结果显示,在转染结束后的2~8 d内,ID2的mRNA表达都受到显著抑制;Western检测则显示转染后2~4 d时ID2蛋白表达受到显著抑制,但第8天时ID2的表达与对照细胞几乎一致。这表明Ps-siRNA复合物在转染后2~4 d能有效地抑制靶基因的表达(图4)。

图4 Ps-siRNA复合物对K562细胞中ID2表达的影响Fig.4 Effect of Ps-siRNA nanoparticles on ID2 expression in K562 cells
2.5 Ps-siRNA可以有效转染静息期白血病细胞 静息期细胞是指暂时脱离了细胞周期,停止分裂的细胞,一旦收到信号刺激,会很快返回细胞周期进行分裂和增殖的一个细胞群落。白血病的复发与处于静息态的干/祖细胞的耐药性密切相关。
选取K562细胞为模型,研究Ps-siRNA复合物对处于不同细胞周期状态中细胞的转染能力。使用Hochest/Py的染色方法,分离处于G0和G1/S/G2期的K562细胞,在转染后进行流式检测发现PssiRNA复合物可以有效地转染未经处理、G0和G1/S/G2期的K562细胞(图5)。

图5 Ps-siRNA复合物转染处于不同周期状态的K562细胞Fig.5 Ps-siRNA nanoparticles effectively transfect K562 cells in various cell-cycle stages
而后,使用相同条件转染CML患者处于不同细胞周期的CD34+细胞。结果显示,Ps-siRNA复合物也能有效地转染各类CML患者CD34+细胞(图6)。

图6 Ps-siRNA能有效转染CML干/祖细胞及静息期细胞Fig.6 Ps-siRNA nanoparticles effectively transfect CML CD34+ and subsets of these cells in different cell-cycle stages.
3 讨论
我们的研究显示Ps-siRNA在N/P值为1.2时,不影响细胞活性。虽然,已有报道证实普鲁兰可以递送DNA和siRNA到不同类型的细胞中,但是普鲁兰作为递送工具递送siRNA到白血病细胞,尤其是比较难以转染的白血病干/祖细胞及处于静息态细胞的研究尚未见报道。我们的研究显示Ps-siRNA复合物可以实现对多种不同类型的白血病细胞的高效转染,而且在转染后2~4 d内能有效抑制靶基因的转录本和蛋白表达,为各类研究提供了实验窗口。另外,该复合物还能高效地转染患者来源的干/祖细胞。以CML为例,我们的数据表明超80%的患者CD34+细胞可被转染;另外,处于静息期的CD34+细胞也可获得类似的转染效率。这是对我们前期工作的重要延展[14]。
综上,我们的研究为在实验研究中向多种白血病细胞递送siRNA提供了一个简洁(转染过程仅6 h)而高效(针对患者CD34+细胞>80%)的瞬时基因递送方法。它有望为白血病发病机制的研究、特异治疗靶标的鉴定等工作提供有力的研究工具。

