SiO2固载刀豆蛋白印迹材料的制备及性能
谭娟娟,赖嘉嘉,林心乐,邱小真,许文宏,李艳霞
(闽江学院海洋学院,福建 福州 350108)
分子印迹技术是一种合成具有特异性吸附的高分子材料技术。印迹技术的基本原理是,利用目标分子充当模板分子(印迹分子)和单体在交联剂和引发剂的作用下合成印迹聚合物。利用物理或化学反应除去模板分子,印迹材料就形成与模板分子尺寸、结构相应的印迹腔穴,这样的印迹材料对目标分子具有特异性识别功能。目前,分子印迹技术已在分离纯化、生物传感、手性识别中得到广泛应用[1-2]。早期的蛋白印迹材料的制备方法较为简单,由于蛋白质分子体积大而且纯度不高,因此,印迹分子去除困难,专一性识别能力低,容易发生非特异性吸附。现在小分子印迹技术已发展得比较成熟,而对大分子蛋白质印迹的进展却不明显。蛋白质印迹方法可分为:包埋法、表面印迹法、抗原决定基法。与小分子印迹相比蛋白质分子印迹存在蛋白质体积大、结构复杂、构象易变和识别位点的精准性不够等缺陷,生物大分子印迹识别机理尚无完整的系统理论,大分子复杂的空间结构和印迹材料作用的多样性都是当前印迹机理研究的主要问题[3-5]。

本文以KH570修饰的二氧化硅纳米为载体粒子,以丙烯酰胺、丙烯酸作为功能单体,甲叉双丙烯酰胺作为交联剂,Con A作为模板分子,模板分子与修饰基团之间的相互作用能将模板分子限制在纳米粒表面, 在单体溶液发生聚合的同时产生印迹位点,TEMED催化引发剂APS产生大量自由基加速聚丙烯酰胺聚合,通过离心除去未交联的功能单体以及洗脱模板分子得到印迹聚合物(MIPs)。先后对印迹材料聚合条件、测试条件等进行了优化,探究材料对不同蛋白的亲和性以及在实际应用的可能性,以期实现对Con A高选择性的分离富集。
1 材料与方法
1.1 仪器与试剂
纳米二氧化硅(KH570处理,粒径20 nm,纯度99%(质量分数),购自于南京先丰纳米科技有限公司)、丙烯酰胺、甲叉双丙烯酰胺、丙烯酸、过硫酸铵(APS)、四甲基乙二胺(TEMED)、冰乙酸(HAc)、无水乙醇、十二烷基硫酸钠(SDS)、氯化钠(NaCl),以上试剂均为分析纯。Con A(刀豆球蛋白)、OVA(卵清白蛋白)、Hb(牛血红蛋白)、BSA(牛卵清白蛋白)、HRP(辣根过氧化物酶)、GOD(葡萄糖氧化酶)、Lyz(溶菌酶)以上蛋白纯度≥95%,胎牛血清(优级纯),购自福州鼎国生物科技有限公司),所用水均为超纯水。
吸附容量采用UV-2550紫外可见光吸收光谱仪(日本岛津公司)测定蛋白吸附前后最大吸光度的变化;采用FTEM 透射电子显微镜(FEI Tecnai G2 F20);Nicoler iS50 傅立叶转换红外光谱仪(美国赛默飞尼高力);TG-DSC分析仪(德国耐驰)用于印迹材料的表征。
1.2 Con A印迹材料的制备
称取 15 mg Con A、30 mg 纳米SiO2加入适量的超纯水用超声波混匀,再加入 15 mg 丙烯酰胺、5 mg 甲叉双丙烯酰胺、2 μL 丙烯酸,用超纯水分散至5 mL,振荡预组装1 h 后,再加入10 μL,10% APS、2 μL TEMED在室温下振荡,聚合反应 4 h 后,得到含有Con A印迹聚合材料。离心洗去未反应的单体、模板蛋白等,超纯水清洗3遍,10%的乙酸溶液浸泡1 h,去除印迹蛋白,再用超纯水清洗残留乙酸,反复3次,然后将材料于烘箱中低温40 ℃烘干,干燥器中保存,备用。由此得到了Con A印迹材料(MIPs)。作为对照实验,非印迹材料采用相同的合成方法,但要省略加入Con A模板蛋白这一步骤,所制备的材料记为NIPs。
2 结果与讨论
2.1 印迹材料的制备
2.1.1 印迹材料的制备路线设计
通过TEMED催化引发剂APS产生大量自由基,将丙烯酰胺和丙烯酸作为功能单体和辅助单体,甲叉双丙烯酰胺作为交联剂,与模板蛋白Con A共聚合于 SiO2表面,经洗脱,得到Con A印迹聚合物材料可特异性识别目标蛋白。本设计方案的特点在于,首先,SiO2价格低廉,其表面富含的不饱和键,利于表面印迹层的形成;其次,两种功能单体,丙烯酰胺富含的氨基和丙烯酸富含羧基,用于增加识别位点,利于目标蛋白的识别。Con A分子印迹合成路线,如图1所示。
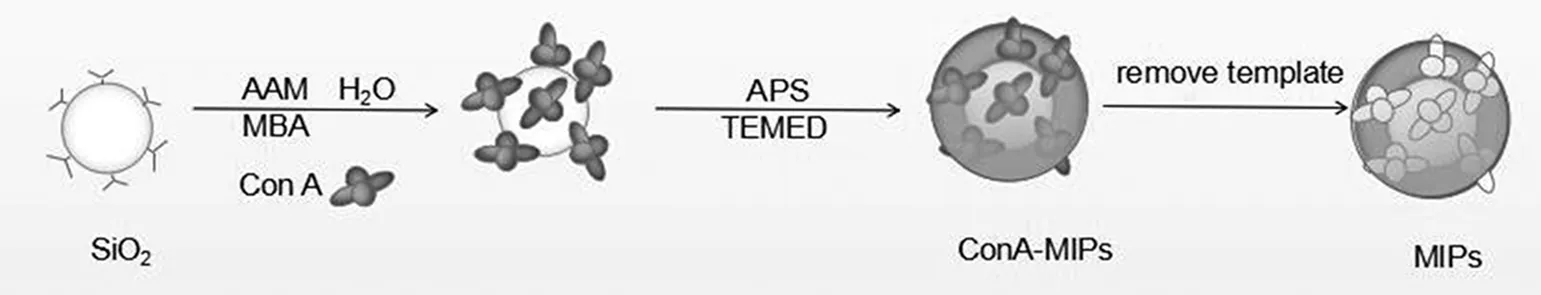
图1 印迹聚合物合成路线图Fig.1 Synthesis route of MIPs
合成Con A印迹材料后,需要对该材料的一些功能,选择性,吸附容量等做一些测试:蛋白质的吸附量根据以下公式计算[19]
Q= (Ci-Cf)V/m
(1)
式中:Q为单位质量材料吸附的蛋白量(mg·g-1);Ci为蛋白质的原始浓度(mg·mL-1);Cf为吸附后的蛋白质浓度(mg·mL-1);V为混合溶液的体积(mL);m为印迹材料的质量(g)。
2.1.2 TEM表征分析
利用TEM对KH570-SiO2、和MIPs的形貌进行了表征。图2(a)和(b)中可以看出MIPs与SiO2的颗粒呈现球形,粒径均一,通过测量得到SiO2的平均粒径约18 nm,MIPs粒子平均粒径约23 nm。与图2(a)中的二氧化硅相比,MIPs的颗粒表面较为粗糙且载体颗粒的界面被一层透明物质包裹,说明纳米二氧化硅周围包裹一层颜色较浅的膜,成功地形成了印迹层。

图2 TEM表征图Fig.2 TEM images of SiO2 (a) and MIP (b)
2.1.3 傅立叶转换红外光谱分析(FTIR)
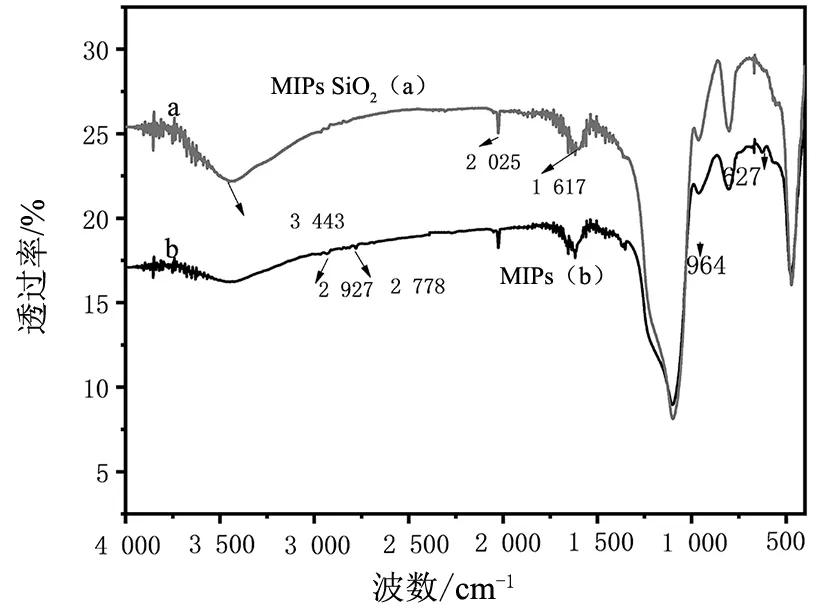
图3 印迹材料的FTIR图Fig.3 FTIR spectra of SiO2 and MIPs SiO2(a);MIPs(b)
由图3可知,曲线a中3 443 cm-1宽峰为二氧化硅分子间氢键-OH的伸缩振动峰,2 929 cm-1,1 627 cm-1处出现=CH2和C=O(-COO)的伸缩振动吸收峰,1 100 cm-1处的强宽峰为Si-O-Si的反对称伸缩振动峰,800 cm-1为Si-O键的对称伸缩振动峰。曲线b中,在2 927 cm-1和2 778 cm-1出现的峰是-CH2-的伸缩振动峰,1 655 cm-1处出现的是C=O(-COOH)的伸缩振动峰,1 617 cm-1和1 358 cm-1的峰是由C=O(-CONH2)的伸缩振动和-CH2-的变形振动引起的,这些现象表明印迹材料的合成设计路线是合理的。
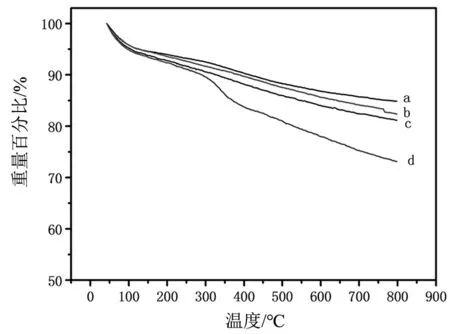
图4 材料的热重分析曲线Fig.4 Thermo gravimetric analysis curves of different materials
2.1.4 热重分析
采用热重表征Con A印迹聚合物的组成,从40 ℃升温至800 ℃,氮气保护,升温速率约10 ℃/min,通过对中间产物的热重分析,可推测分析出纳米材料表面聚合有机层的组成。如图4所示,从上到下分别为MIPs (a),NIPs(b),KH570-SiO2(c),Con A+MIPs(d)的失重曲线。失重过程可以分为3个阶段:在温度100 ℃左右,失重的成分是纳米材料吸附的水分;当温度从100 ℃升高到300 ℃时,为失重的主要阶段,重量出现的持续下降,MIPs,NIPs,KH570-SiO2,Con A + MIPs四者整体失重趋势接近,这主要是由于SiO2表面功能化配体和有机聚合物层的逐步分解挥发失重。随着温度的升高,Con A+ MIPs曲线失重量大且呈现大幅度下降较难趋于稳定,200~400 ℃出现较快的失重,代表印迹蛋白的受热分解,证明大量Con A被MIPs吸附。接着曲线持续下降,仍然为聚合物层的逐步热分解及SiO2的氧分解。
2.1.5 聚合时间优化
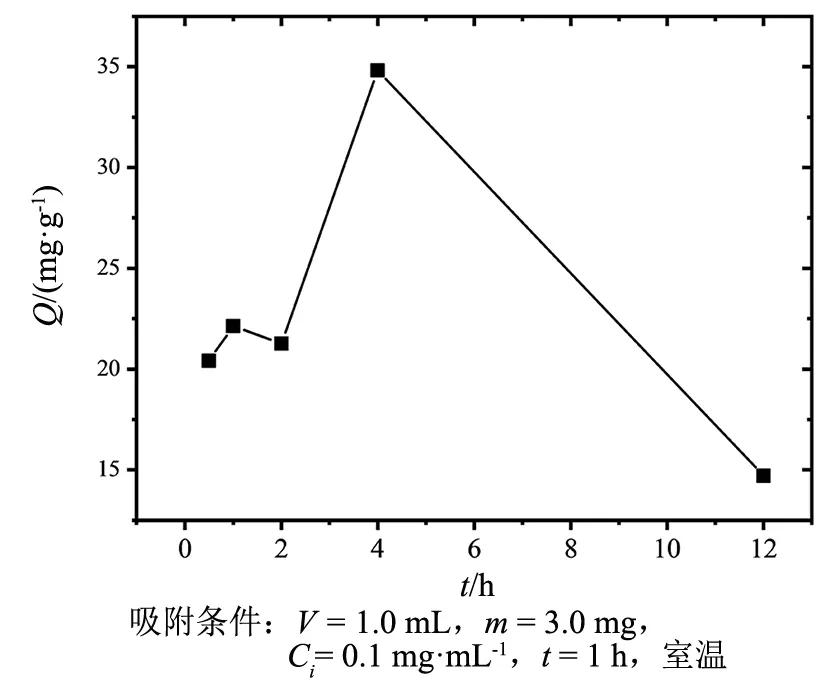
图5 聚合时间对MIPs吸附量的影响Fig.5 Effect of polymerization time on MIPs adsorption capacities
经过预组装的纳米二氧化硅在APS与TEMED的催化下,在0.5、1、2、4、12 h以上不同的时间条件下加速聚丙烯酰胺在氧化硅表面聚合的五组样品。进行模板蛋白(Con A)的吸附后,Con A吸附量如图5所示,聚合时间为 0.5,1,2 h得到的印迹材料,由于聚合时间短,印迹层未完全形成,模板蛋白结合点的印迹腔穴深浅不均,数量少,蛋白与腔穴的结合力小且容易脱离,因此蛋白吸附量低。聚合反应4 h后,二氧化硅上的印迹层已包裹完整,模板蛋白易洗脱,形成的印迹腔穴数量多,此时对模板蛋白的响应强,吸附量最大。聚合反应12 h以上时,模板蛋白大部分被包埋在聚合层深处,由于空间位阻效应,不易将聚合层深处模板蛋白洗脱去除,印迹层深处的结合位点少,因此对模板蛋白的吸附量低。

图6 不同洗脱液对MIPs吸附量Fig.6 Adsorption capacities of MIPs with different eluents
2.1.6 洗脱液的选择
洗脱液的选择影响到MIPs对模板蛋白的响应值,因此模板分子的洗脱是分子印迹制备中的关键一步。在模板蛋白洗脱过程中,往往难以彻底洗去模板分子,尤其对于空间结构复杂的蛋白分子,这将影响到印迹材料的吸附性能。为尽可能洗去模板蛋白,本文采用10% HAc,10% SDS,1 mol·L-1NaCl,5% HAc + 5% SDS等洗脱液对模板蛋白进行洗脱,对蛋白吸附后的吸附量变化作图,比较不同洗脱液的洗脱效果。图6可见,使用5% HAc + 5% SDS混合洗液进行洗脱的印迹材料对蛋白的吸附量明显高于其他的洗脱液,说明用5% HAc + 5% SDS洗液得到的特异性空穴多,因此对蛋白的吸附量大。
2.1.7 洗脱时间的优化
以5% HAc + 5% SDS作为洗脱液进行洗脱,其洗脱效果如图7所示,随着洗脱时间的增加,蛋白的吸附量逐渐增加,0~20 min洗脱时间较短,模板蛋白洗脱量少,产生的印迹空穴数量较少。洗脱至20~60 min时MIPs的吸附容量变化较小,40 min后逐渐趋于平稳,表明模板蛋白已基本洗脱完全,形成大量印迹空穴,达到最佳吸附容量,因此选择40 min作为最佳洗脱时间。
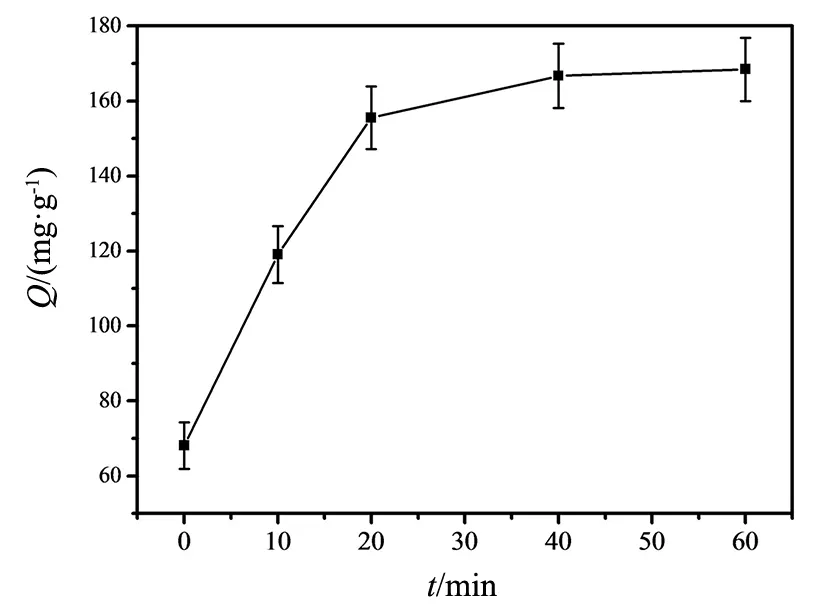
图7 不同洗脱时间下MIPs的吸附量Fig.7 Adsorption capacities of MIPs under different elution time
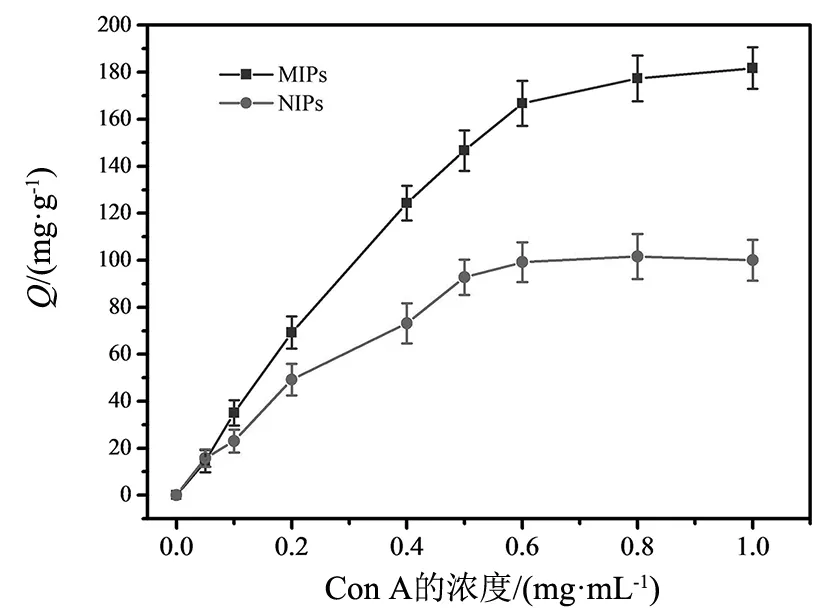
图8 Con A在MIPs和NIPs上的吸附等温线Fig.8 Adsorption isotherms of Con A on MIPs and NIPs
2.2 印迹材料的性能
2.2.1 吸附等温曲线
考察MIPs和NIPs的吸附容量可以判断聚合材料的印迹效果。设定的浓度范围为0~1.0 mg·mL-1的Con A溶液,进行吸附 1 h,随着Con A浓度的增加,观察吸附量曲线的变化趋势。图8可看出,MIPs和NIPs的吸附量Q随着Con A浓度的增加而逐步提高,当初始浓度增加到0.6 mg·mL-1时吸附量变化趋于平稳,这由于Con A分子与印迹层的空穴结合达到饱和吸附,MIPs和NIPs的饱和吸附量分别为166.76和99.17 mg·g-1,两者表现出显著差异,证明MIPs的印迹层形成的印迹空穴可有效吸附目标蛋白。Con A分子印迹材料对蛋白浓度在0~1.0 mg·mL-1范围内表现出较好的动态响应,而非印迹材料缺少印迹腔,对蛋白的吸附是为物理吸附。这一结果表明MIPs在模板蛋白参与的聚合过程中产生了与Con A分子结构与官能团相匹配的印迹腔穴。
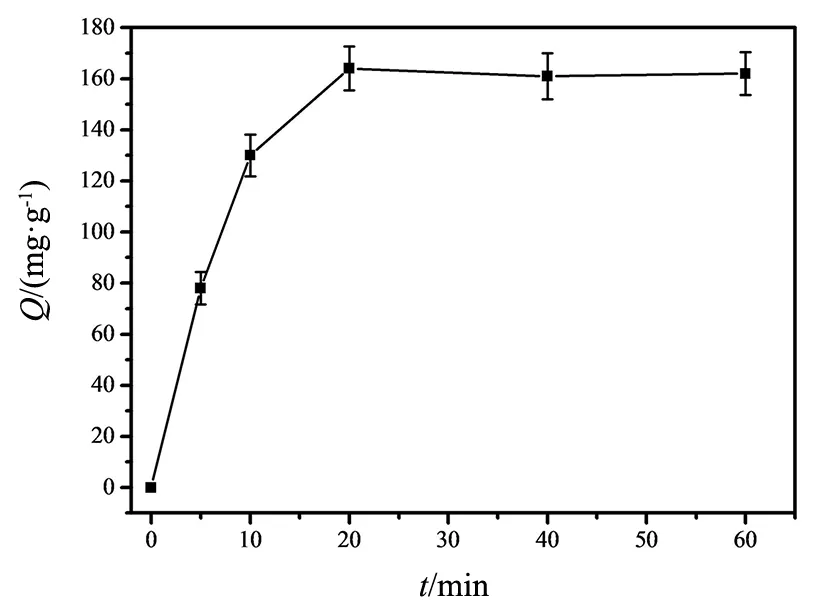
图9 MIPs对Con A的吸附动力学影响Fig.9 Adsorption kinetics of MIPs to Con A
2.2.2 吸附动力学
吸附动力学是考察MIPs对模板蛋白(Con A)进行特异性吸附所需要的平衡时间。如图9显示了MIPs吸附量随时间变化的趋势图,图中前10 min目标蛋白的吸附量急剧增加,伴随着吸附时间的延长,Con A特异性吸附速率开始降低。10 min前蛋白快速被吸附,10 min后蛋白吸附缓慢的原因可能是前期蛋白主要与印迹层表面的位点结合,后期由于印迹层表面的结合点被饱和后,印迹聚合物内部与蛋白结合时间延长,也就是后期蛋白吸附速率较为缓慢。当吸附时间到达20 min后分子印迹的吸附量不再上升,说明MIPs对Con A特异性吸附达到饱和平衡,表现出快速吸附能力。
2.2.3 不同材料对Con A 的吸附能力
对KH570-SiO2、MIPs、NIPs及Con A-MIPs进行模板蛋白吸附量测试,如图10所示,MIPs因为具有与刀豆蛋白结构大小相同的印迹腔穴,所以对蛋白的吸附量是最高的,而NIPs的吸附量仅次于MIPs是因其非特异性的物理吸附蛋白,作为固载材料的KH570-SiO2本身是一种介孔材料,载体分子间存在空隙,因此对蛋白存在一定的非特异性物理吸附,含有刀豆蛋白的MIPs对Con A存在最弱的吸附能力,由于印迹分子与印迹腔穴处于吸附-解吸的动态过程,与MIPs相比,而被饱和吸附的印迹空穴对Con A的吸附能力显著减弱。结果显示,MIPs对Con A有良好的吸附能力。
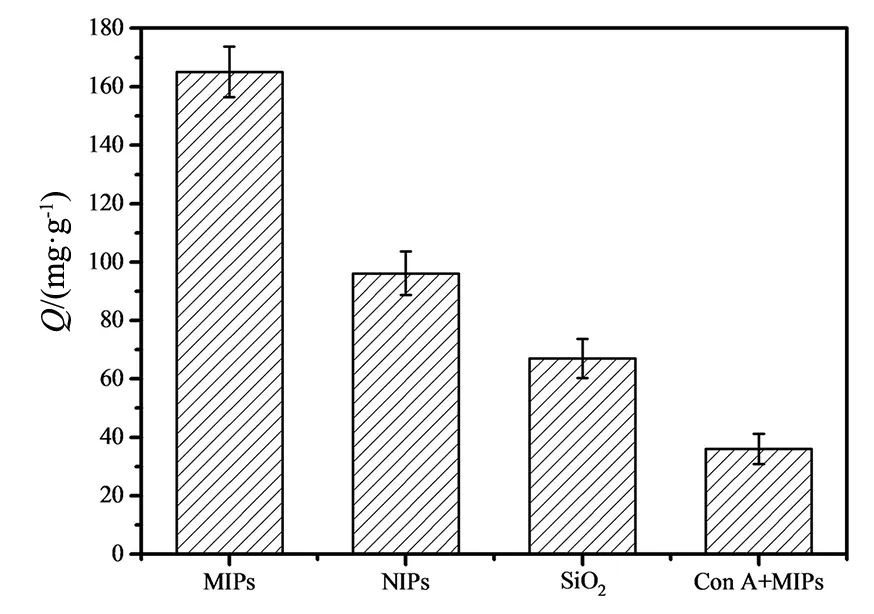
图10 不同材料对Con A的吸附效果Fig.10 Adsorption effect of different materials to Con A
2.2.4 选择性吸附

图11 MIPs和NIPs对不同蛋白的吸附容量Fig.11 Adsorption capacity of MIPs and NIPs to different proteins
为了考察MIPs对模板蛋白的特异选择性能力,除模板蛋白Con A以外,另选蛋白质OVA、 BSA、Hb、HRP、GOD、Lyz 检验MIPs和NIPs的选择吸附能力,如图11,结果表明实验所制备的分子印迹聚合物对上述非模板蛋白特异性吸附不明显,因为分子量大的蛋白分子在MIPs吸附时空间位阻效应大,对模板蛋白Con A的特异性吸附量明显高于其他蛋白。而NIPs对非模板蛋白的吸附主要以非特异性吸附为主。
印迹因子IF和选择系数k可以看出MIPs对不同蛋白间识别能力的大小[20-21],可作为MIPs的特异选择性评价的指标之一。IF和k值越大,MIPs的选择性能越好,结合效果越强。
对IF的定义是MIPs与NIPs的吸附容量之比,即:
IF=QMIPs/QNIPs
(2)
分配系数Kd选择性系数k分别为
Kd=[(Ci-Cf)/Ci]V/m
(3)
K=KdMIPs/Kd NIPs
(4)
根据公式(2)、(3)和(4)计算,结果如表1所示,MIPs对ConA、BSA、OVA、HRP、GOD、Hb和Lyz的IF分别为1.67,0.97,0.95,0.67,0.52,0.36和1.03,除Con A蛋白外,其余非模板蛋白的印迹因子均接近1,则表明本文制备的MIPs含有与Con A相对应的印迹结合腔,能够对模板蛋白Con A产生有效的特异结合,MIPs和NIPs对非模板蛋白的吸附量没有明显的差异,是由于MIPs、NIPs中没有与非模板蛋白结构相应的结合腔穴,不能对蛋白产生高效的选择,只能依靠材料本身的非特异性的物理吸附来与蛋白结合。可见,MIPs具有良好的特异识别能力。MIPs对BSA、OVA、HRP、GOD、Hb和Lyz的选择性系数分别为1.73,3.10,4.91,12.80,15.98和14.44,该数据说明MIPs对非模板蛋白具有良好的选择性能,尤其是对GOD,Hb,Lyz蛋白有非常高的选择性。

表1 MIPs对不同蛋白的选择性参数Tab.1 Selectivity parameters of different proteins on MIPs
2.2.5 实际样品分析
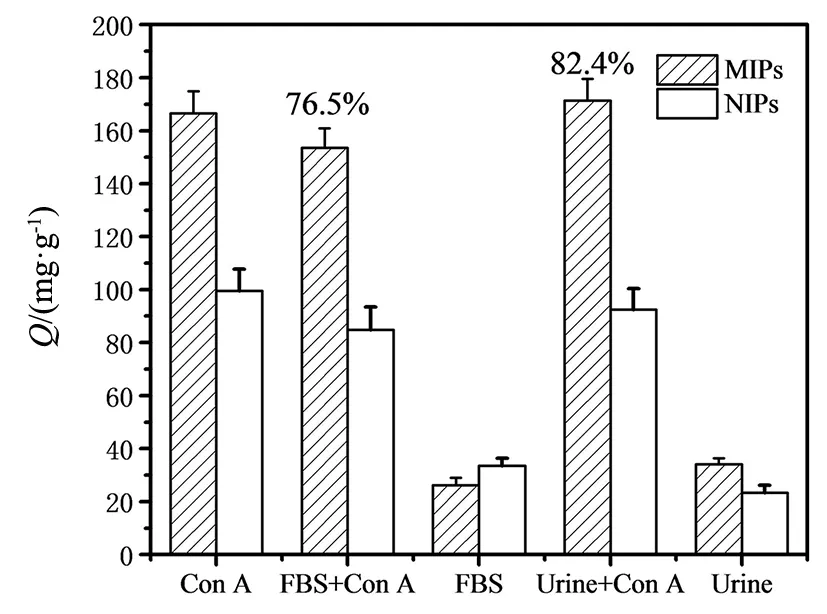
图12 MIPs和NIPs在FBS和尿液中对Con A 的吸附效果Fig.12 Adsorption effects of Con A on MIPs and NIPs in FBS and urine
为进一步考察所制备的MIPs实际应用价值和分离效果,选择空白胎牛血清(FBS)和人体尿液(Urine)作为生物样品,进行添加回收实验。牛血清中主要包含大量的BSA和少量BHb蛋白,而尿液中主要包含尿酸、尿素、水、无机盐和葡萄糖等生物小分子。将稀释20倍的FBS、稀释5倍的尿液分别添加一定量Con A,使其终浓度均为0.6 mg·mL-1,通过吸附实验,测MIPs和NIPs 对这些样品的吸附量(Q),结果如图12所示。可以看出,MIPs和NIPs对FBS和尿液表现出较弱的非特异性吸附,当添加Con A 后,吸附量显著增加,扣除背景非特异性吸附,MIPs在FBS溶液中,对Con A回收率为76.5%,在尿液溶液中,对Con A回收率为82.4%,这一结果证明高浓度干扰蛋白和生物小分子在Con A吸附过程中干扰较小,可望用于生物样本中Con A的分离与富集。
3 结论
本文以丙烯酰胺、丙烯酸作为功能单体,甲叉双丙烯酰胺作为交联剂,以Con A作为模板分子,KH570处理的SiO2纳米粒子作为载体制备Con A 印迹材料。SiO2表面富含的不饱和键,利于表面印迹层的形成,引入的羧基用于增加识别位点,利于目标蛋白的识别。所制备的材料具有较高的吸附容量和选择性,表现出快速的吸附解吸过程。该材料制备简单,有望作为复杂样品中富集分离目标蛋白的材料, 同时也为其他的蛋白印迹合成提供了思路。

