微生物和硬毛藻对天鹅湖不同湖区沉积物氮磷释放的影响
魏烈群,徐书童,王效昌,高丽
烟台大学海洋学院,山东 烟台 264005
近年来,随着人类开发利用活动日益增多,湖泊等水体的富营养化程度日益加剧,藻华频繁暴发。在整个水体系统,沉积物既是氮磷等营养盐的“汇”,又是营养盐“源”(Brito et al.,2018)。沉积物和水体间存在着动态平衡,随着输入型外源污染(点源和面源)逐渐得到控制,沉积物中氮磷等营养盐的释放以及藻类的堆积降解等内源污染成为水质恶化的主要原因(薄涛等,2017;Cavalcante et al.,2018)。影响沉积物氮磷等营养盐释放的因子有很多,其中微生物活动和藻分解具有重要作用(魏全源等,2009;Zhu et al.,2013)。
微生物可通过同化、异化作用及改变环境条件来影响沉积物中营养盐的转化与分布(Acharyya et al.,2012;左乐等,2015;吴玲等,2020)。Zhu et al.(2013)研究蓝藻爆发对太湖水土界面营养盐释放的影响时发现,微生物活动可以增加沉积物耗氧,提高沉积物磷的的释放速率。Maitra et al.(2015)的研究表明,在解磷菌作用下沉积物磷的释放风险较高。朱苏葛等(2016)在研究微生物活动对阳澄湖间隙水磷含量的影响时发现,沉积物中 NaOH-P和BD-P与解磷微生物作用下的磷释放过程关系密切,有利于溶解态磷的释放。另一方面,藻类分解过程中水体氮磷质量浓度也会发生明显变化。有研究报道,硬毛藻分解明显促进了天鹅湖沉积物中氮磷营养盐的释放,且对不同湖区的促进作用存在差异(孟祥森等,2017)。微生物和藻类分解可以相互促进,藻体分解向水体释放大量营养盐利于微生物生长,微生物又能促进藻体分解。可见,在藻华频繁爆发的水体,微生物对营养盐含量的影响较为复杂。目前,国内外学者就其单一因素对氮磷影响的研究较多(Acharyya et al.,2012;左乐等,2015;林玉清等,2019),但研究多涉及淡水湖泊及微藻影响,有关不同底质类型、微生物和大型藻类多重作用对沉积物氮磷释放影响的报道较少。
近年来,在中国沿岸海域及泻湖等水域,绿潮藻类频繁爆发,死亡时大量堆积在沉积物表面,严重恶化了水质(Gao et al.,2013;徐书童等,2019)。荣成天鹅湖为一天然泻湖,在其东南端与荣成湾相连,沉积物包括泥质和砂质两大类型,大型丝状硬毛藻在湖内常年爆发。本研究以荣成天鹅湖为研究对象,以绿藻硬毛藻为试验材料,通过室内模拟试验,探讨了不同类型沉积物在不同微生物活性及硬毛藻有无条件下氮磷释放能力的差异,研究结果可为天鹅湖内源污染的控制提供理论依据。
1 材料与方法
1.1 样品采集
2019年4月,在天鹅湖3个湖区分别采集表层沉积物(0—10 cm),采样位置如图1所示。S1位于西北部,沉积物为泥质,黑臭,多藻碎屑;S2位于湖中心,水较深,硬毛藻和大叶藻大量繁殖,沉积物为粘质,水生植物根系等分布较多;S3位于湖南部,水较浅,藻类较少,沉积物为砂质。沉积物混匀后,避光冷藏保存(4 ℃)。在湖中心采集硬毛藻,用海水洗净后冷冻保存(-20 ℃,48 h),将藻类杀死;试验前将藻解冻控水,切碎(约1 cm)后备用。海水部分灭菌备用。沉积物与水体的基本理化性质见表1。

图1 3个样点位置示意图Fig.1 Location distribution of sampling sites
1.2 试验设计
试验材料为3个不同湖区的新鲜沉积物、死亡硬毛藻和海水,每个样点设置4个处理(有无藻类,是否灭菌),试验共12个处理,3次重复。4个处理分别为:沉积物+水、沉积物+水(甲醛灭菌)、沉积物+水+藻、沉积物+水+藻(甲醛灭菌),其中灭菌处理沉积物中甲醛浓度为25 mL·kg-1,水中为10 mL·L-1。布置试验时,准确称取0.30 kg沉积物于2.0 L的高型烧杯中,使其平铺于烧杯底部,灭菌处理加入甲醛,将 30 g硬毛藻平铺在沉积物表面,之后缓慢加入1.8 L过滤处理过的海水,静置。
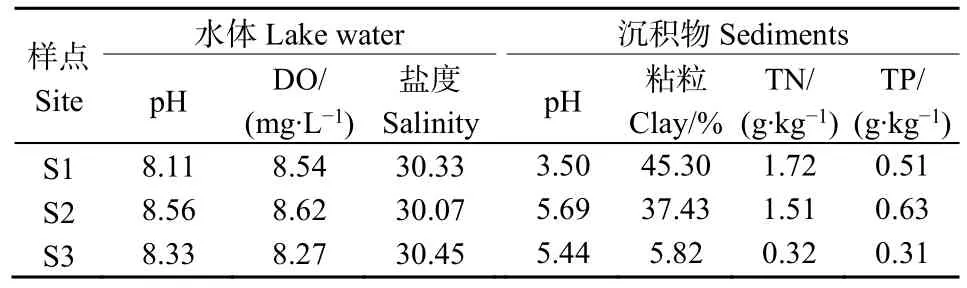
表1 天鹅湖沉积物与水体理化指标Table 1 Physico-chemical parameters of the sediments and the overlying water
模拟试验在18 ℃进行,周期为15 d,每2天采取一次水样,测定相应指标。在距水土界面3 cm处用注射器抽取水样150 mL,用以测定TN、氨氮(NH4+-N)、TP、可溶性磷(SRP)质量浓度;并同步在水土界面测定pH,DO等水体理化性质。取样后补充等体积原始海水,最终计算营养盐浓度时考虑补水影响,进行相应换算。
1.3 测定指标与方法
水体TN采用过硫酸钾氧化-紫外分光光度法测定,NH4+-N采用蒸馏-滴定法,TP采用过硫酸钾消解-钼锑抗分光光度法,水样过滤后采用钼锑抗分光光度法测定SRP(国家环保总局,2002);沉积物中微生物活性使用FDA法测定(贾建丽等,2010);DO质量浓度用溶氧仪(SG6-FK2)测定;pH用多参数测试仪(SG78)测定。
1.4 统计分析
采用SPSS 19.0统计分析软件,进行三因素方差分析,检验沉积物、微生物和藻类三因素分别对水体TN、NH4+-N、TP、SRP的影响效应,并进行Duncan’s多重比较。
2 结果与分析
2.1 不同微生物活性条件下水体氮水平的变化
2.1.1 水体总氮质量浓度的变化
图2a、b显示,无藻条件下,未灭菌处理水体TN质量浓度变幅为1.28—5.33 mg·L-1;试验前期(0—6 d)浓度呈上升趋势,3样点差异不大,之后随时间有所下降,后期 TN质量浓度表现为S2>S1>S3;灭菌组质量浓度变幅为 0.11—8.96 mg·L-1,总体趋势为前期较高,之后随时间下降,而试验中后期S3质量浓度一直较低。无藻条件下,试验前期灭菌组明显高于未灭菌组,而后期未灭菌处理较高,是否灭菌对S1(西北部)、S2(湖中心)处理影响较大。
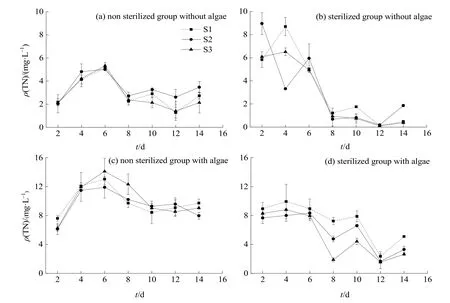
图2 微生物活性对水体TN质量浓度的影响Fig.2 Effects of microorganisms on total nitrogen mass concentration in water
由图 2c、d可知,有藻条件下,未灭菌组 TN质量浓度变幅为6.13—14.11 mg·L-1,在试验前期急剧上升,第6天达峰值后缓慢降低,3样点差异不大。初期灭菌组质量浓度高于未灭菌组,但随时间变化其明显低于未灭菌组;不同沉积物处理相比,表现为S1(西北部)>S2(湖中心)>S3(湖南部),其中S3受微生物活性影响较大。
相同微生物处理下,有藻条件水体TN质量浓度高于无藻条件。比较图2a、c可知,未灭菌组有藻与无藻处理的变化趋势基本一致,前期(0—6 d)TN质量浓度迅速增加,后期总体呈下降趋势;在试验前期,有藻条件TN质量浓度远高于无藻条件。在灭菌组中,各处理后期TN质量浓度较初期明显下降(图 2b、d)。综合可见,未灭菌条件下有无藻类处理TN质量浓度的差异大于灭菌条件。
2.1.2 水体氨氮质量浓度的变化
由图3可知,无藻条件下NH4+-N质量浓度明显低于有藻条件。无藻未灭菌处理下,S1、S2、S3 3样点 NH4+-N质量浓度变幅分别为 0.09—1.68、0.37—1.12、0.09—1.68 mg·L-1,S1、S3 变化趋势相似,S2波动较大;灭菌处理各样点NH4+-N质量浓度较未灭菌处理低,3样点在2—12 d呈下降趋势,晚期有所上升(图2a、b)。
有藻条件下,未灭菌处理组NH4+-N质量浓度变幅为3.92—7.00 mg·L-1,试验前期S1含量较高,后期S2较高;灭菌处理组NH4+-N质量浓度随时间变化明显,3样点在前4 d呈明显上升趋势,之后逐渐下降,晚期略有上升(图 2c、d)。未灭菌处理组明显高于灭菌组,这可能由于未灭菌沉积物在微生物作用下,有机物进行一定程度降解,从而促进了向氨氮的转化。可见,藻体分解可以促进NH4+-N释放,且有藻条件和微生物双重作用对S2水体NH4+-N质量浓度的促进较为明显。
相同微生物处理下,有藻组NH4+-N质量浓度明显高于无藻组。未灭菌处理NH4+-N质量浓度波动较大,灭菌处理中试验中后期(8—12 d)较平稳,12—14 d有所上升。可见,有藻条件下水体氨氮质量浓度高于无藻条件,且未灭菌处理下差异更明显。
2.2 不同微生物活性条件下水体磷水平的变化
2.2.1 水体总磷质量浓度的变化
由图4a、b知,无藻条件下,未灭菌处理组S1、S3样点TP质量浓度均呈先上升后下降,8 d后持续上升的趋势,S2波动较大,其质量浓度显著高于S1、S3;灭菌处理组质量浓度变幅为 0.019—0.047 mg·L-1,变化趋势与未灭菌组相似,样点间差异较未灭菌组小。无藻条件下S2受微生物活性的影响较大。
图4c、d可见,试验过程中有藻条件下水体TP质量浓度大致呈下降趋势,未灭菌处理组TP质量浓度变化在0.27—1.41 mg·L-1之间,在4—10 d期间S2浓度一直较高;灭菌条件TP质量浓度下降趋势更为明显,变幅为0.31—1.27 mg·L-1,试验前期(0—8 d)3样点差异较大,表现为:S1>S3>S2,后期样点间差异很小。有藻条件下,S2处理TP质量浓度受微生物活性的影响较大。
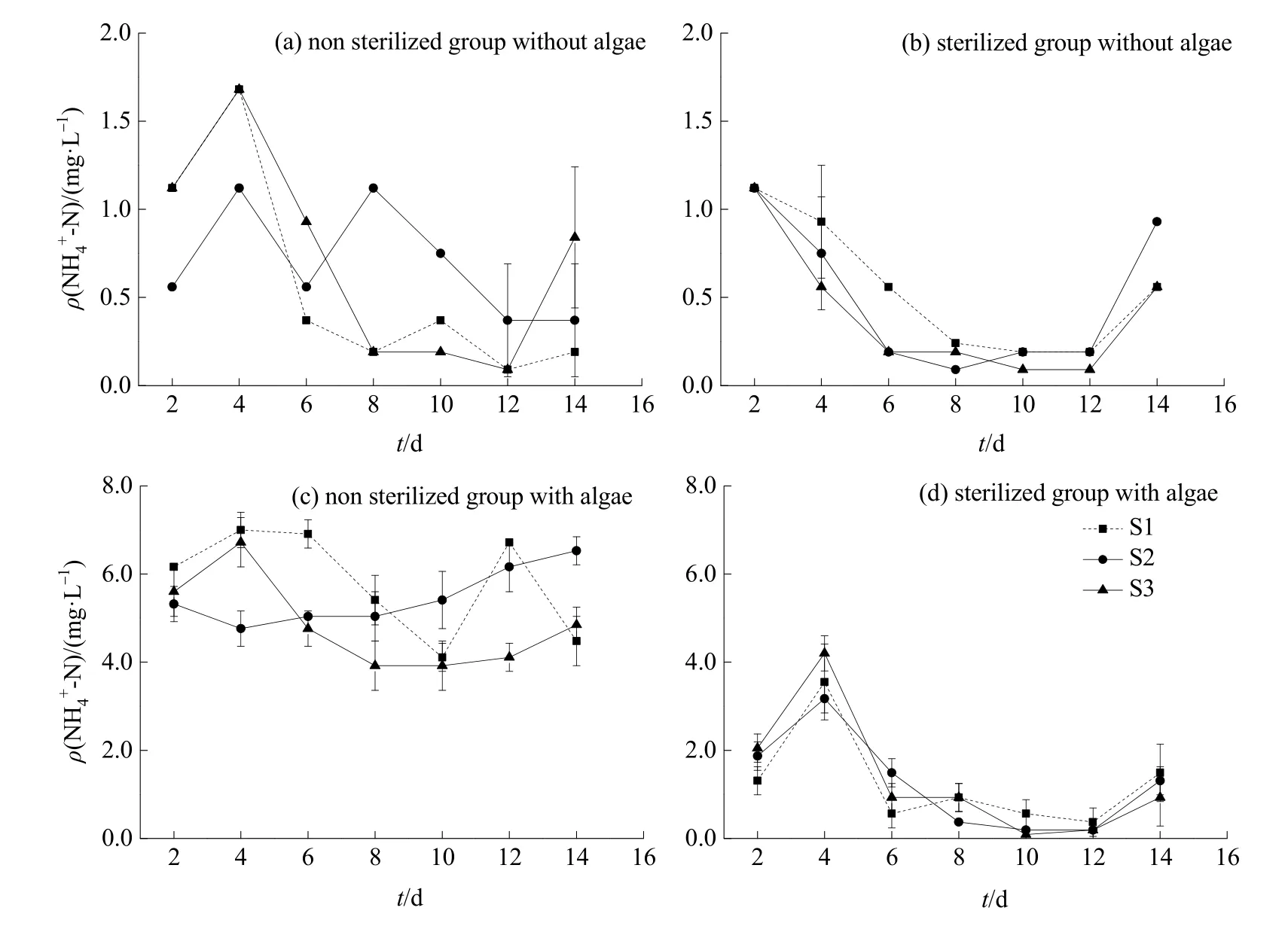
图3 微生物活性对水体NH4+-N质量浓度的影响Fig.3 Effects of microorganisms on ammonia nitrogen mass concentration in water
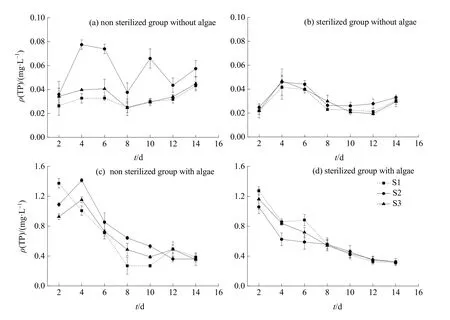
图4 微生物活性对水体TP质量浓度的影响Fig.4 Effects of microorganisms on total phosphorus mass concentration in water
相同微生物处理下,有藻条件水体TP质量浓度明显高于无藻条件。无藻条件下TP质量浓度总体呈上升趋势,有藻条件总体均呈下降趋势。灭菌处理下,3样点TP质量浓度差异略小。
2.2.2 水体可溶性磷质量浓度的变化
无藻条件下,未灭菌处理水体SRP质量浓度变幅为 0.004—0.039 mg·L-1,灭菌处理组为 0.003—0.016 mg·L-1(图5a、b)。试验初期(0—4 d)各样点未灭菌处理SRP质量浓度低于灭菌处理,中后期(8—14 d)则相反。未灭菌处理S2的水体SRP质量浓度明显高于S1和S3,而灭菌处理前期(0—6 d)S1略高于S2和S3,后期(8—14 d)S2略高。
由图 5c、d可知,有藻未灭菌组 S2、S3在 2—6 d期间SRP质量浓度急剧上升至约0.5 mg·L-1,第8天降至0.07 mg·L-1后保持较稳定水平,试验中期(6—10 d)3样点差异较小。有藻灭菌组SRP质量浓度明显高于未灭菌组,随时间呈持续下降趋势;试验前期(0—8 d)S1质量浓度明显高于S2、S3,后期样点间差异减小。可见,有藻灭菌处理水体SRP质量浓度明显较高,灭菌与否对单一样点影响较大,但样点间差异试验后期不明显。
未灭菌组中,有藻条件SRP质量浓度约为无藻条件的 10倍,但有藻条件随时间呈下降趋势,而无藻条件略有上升;灭菌组中,有藻条件SRP质量浓度明显降低,无藻条件变化不明显。相同微生物处理下,有藻条件 SRP质量浓度明显高于无藻条件,且灭菌条件下差异更为明显。

图5 微生物活性对水体SRP质量浓度的影响Fig.5 Effects of microorganisms on soluble phosphorus mass concentration in water
2.3 不同微生物及藻分解条件下水体理化性质的变化
2.3.1 水土界面pH的变化
藻分解使水体理化性质发生一定变化,进而影响沉积物营养盐的释放能力,从而使水体氮磷水平发生变化。图6a可见,与初始值相比,无藻未灭菌组水体 pH总体随时间呈上升趋势,变幅为 7.66—8.52,不同湖区有所差异,表现为S3>S1>S2。灭菌组pH明显低于未灭菌组,变幅为6.65—8.17,不同沉积物间差异较小,变化趋势基本一致。
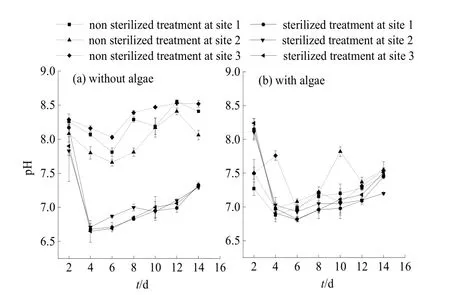
图6 微生物活性对水体pH的影响Fig.6 Effects of microorganisms on pH value in water
由图 6b可知,有藻分解条件下,未灭菌组和灭菌组水体 pH变幅分别为 6.88—7.82和 6.81—8.24。试验初期各样点未灭菌处理 pH明显高于灭菌处理,随试验进行逐渐低于灭菌组。相同微生物处理下,有藻条件pH低于无藻,且未灭菌处理差异更为明显;无藻条件下是否灭菌对水体pH影响较大。
未灭菌组,无藻条件 pH变幅为 7.66—8.52,有藻条件为 6.88—7.82,无藻条件明显高于有藻条件;灭菌组中,不同藻类条件下pH差异不大,试验后期基本一致。可见,未灭菌处理下藻类对水体pH影响较大。
2.3.2 水土界面DO质量浓度的变化
图 7a显示,无藻条件下未灭菌处理水体 DO质量浓度变幅为 1.54—4.56 mg·L-1,灭菌处理为1.04—5.04 mg·L-1;各处理水体DO质量浓度随时间呈明显下降趋势,12 d后处于低氧状态(<2.0 mg·L-1);S1、S2未灭菌处理下 DO明显低于灭菌处理,而S3差异不大。

图7 微生物活性对水体溶解氧(DO)质量浓度的影响Fig.7 Effects of microorganisms on dissolved oxygen (DO) mass concentration in water
有藻条件下灭菌组水体DO质量浓度明显高于未灭菌组(图7b)。灭菌组质量浓度变幅为1.60—4.92 mg·L-1,样点间差异较小,各处理随时间均呈明显下降趋势。未灭菌组随时间波动较大,前期(0—8 d)S3明显高于S1和S2,S2在试验后期几乎一直处于低氧状态,S1前期低于2.0 mg·L-1,后期略有上升。试验前期,S1处理受微生物影响较大。有藻组DO质量浓度明显低于无藻组,有藻条件下各样点受微生物活性影响较大。
未灭菌处理中,不同藻类条件下DO质量浓度差异不大;灭菌处理中,有藻条件DO质量浓度明显低于无藻条件,有藻条件试验中后期一直处于低氧状态。可见,灭菌处理下各样点受藻类影响较大。
3 讨论
营养盐在沉积物-水界面的迁移和转化过程中,微生物和藻类等起着不容忽视的作用(Zhu et al.,2013;詹旋灿等,2013)。Gao et al.(2013)在研究硬毛藻分解对上覆水营养盐影响时发现,总磷质量浓度初期表现为30 g藻+水>30 g藻+水+沉积物>水+沉积物,随试验进行30 g藻+水+沉积物处理的总磷质量浓度显著高于30 g藻+水处理,表明水体营养盐含量增加试验前期以藻分解为主,后期以沉积物释放为主。
本试验中,微生物、硬毛藻、微生物×硬毛藻的交互作用对水体总氮、氨氮质量浓度的影响均显著(P<0.01)(表 2)。总氮、氨氮质量浓度均表现为有藻组高于无藻组,且有藻条件下各处理差异较为明显,这可能因为藻类死亡堆积后可直接向水体释放营养盐,并在残体分解过程中改变水体理化性质,从而促进沉积物中营养盐释放(王永平等,2012;Han et al.,2015)。有藻条件下,3样点总氮、氨氮质量浓度均表现为灭菌处理显著低于未灭菌处理(P<0.01),不同沉积物处理顺序为西北部>湖中心>湖南部。在天鹅湖,3样点春季沉积物微生物活性分别为:0.89、1.17、0.78 μg·g-1·min-1,其中湖中心最高;试验结束时不同处理沉积物微生物活性不同,灭菌处理低于未灭菌处理;相同微生物处理下,S1、S2均表现为有藻条件高于无藻条件,可能原因为藻体分解释放大量营养盐,利于微生物生长,且有藻条件下湖中心沉积物(S2)微生物活性较高(表 3)。有研究表明,微生物活动可促进藻体分解,藻体自身释放的营养盐增多,且藻体对沉积物释放的促进作用也增强(张佳等,2019),这导致了有藻条件下未灭菌组氮质量浓度明显较高,湖中心沉积物处理是否灭菌差异较大(图 2—3)。3样点水体总氮质量浓度表现为:沉积物+水+藻>沉积物+水+藻(灭菌)>沉积物+水>沉积物+水(灭菌),可见灭菌使得沉积物营养盐释放能力明显降低。三因素对水体氮质量浓度的影响顺序为:藻类>微生物>沉积物。

表2 三因素方差分析检验微生物、硬毛藻、沉积物对水体氮质量浓度的影响Table 2 Three-way ANOVA for effects of microorganisms,Chaetomorpha and sediments on nitrogen mass concentration in water
微生物矿化作用可将沉积物中有机磷分解转化成无机磷,将不溶性磷转化为可溶性磷,导致沉积物磷不断释放到上覆水中,进而增加了湖泊发生富营养化的可能(范乐等,2014;Wang et al.,2016)。由表4可知,硬毛藻分解对水体总磷质量浓度具有极显著影响(F=636.120,P=0.000),有藻条件下总磷质量浓度显著高于无藻条件。三因素对水体磷质量浓度的影响顺序为:藻类>微生物>沉积物。在有藻、无藻条件下,各样点总磷质量浓度均表现为未灭菌>灭菌,无藻条件下S2未灭菌显著高于其他处理(P<0.05)。可见湖中心沉积物磷的释放能力受微生物活性影响较大。微生物、藻类、微生物×硬毛藻的交互作用对水体可溶性磷的影响效应为极显著(P<0.01),无藻条件下可溶性磷质量浓度顺序为S2+未灭菌>S3+未灭菌>S1+未灭菌,S1+灭菌>S2+灭菌>S3+灭菌,S2+未灭菌与其他处理存在显著差异(P<0.05);而有藻条件下顺序为 S1+灭菌>S2+灭菌>S3+灭菌,S1+未灭菌>S2+未灭菌>S3+未灭菌,未灭菌组低于灭菌组,这可能是由于甲醛灭菌促进颗粒态及有机磷转化,致使可溶性磷质量浓度升高,尚需进一步验证。
沉积物中营养盐的释放受许多因素的综合影响,如沉积物营养盐的赋存形态、碱性磷酸酶活性(APA)、沉积物粒度及水土界面的理化性质等(Yin et al.,2011;梁文等,2011;Shen et al.,2013)。因此,同一湖泊不同湖区沉积物营养盐的释放潜力也有很大区别。本研究表明,天鹅湖不同湖区氮磷释放潜力有很大差异。氮在不同藻类条件下大致为西北部>湖中心>湖南部;磷在无藻条件下表现为湖中心>西北部>湖南部,有藻条件下则为西北部>湖中心>湖南部,且湖中心沉积物受微生物活动影响较大。这可能与天鹅湖沉积物营养盐等的空间分布特征有关。在天鹅湖,湖东南部与外海相通,与海水的交换能力较强,南部主要为砂质沉积物,不易形成藻类覆盖,西北部和湖中心沉积物颗粒较细;且西北部和中部沉积物 APA较高,湖南部则偏低(Gao et al.,2014;邵雪琳等,2015)。受到水动力作用、人为活动等因素影响,表层沉积物中营养盐也呈现出不同的空间分布。TN和TP质量浓度均表现为湖中部和北部较高,南部较低,且西北部铁铝结合态磷等活性磷质量浓度较高(高丽等,2010),这与本研究中西北部沉积物氮磷释放能力较强相吻合。有研究表明,随着动力扰动强度的增加,表层沉积物悬浮和营养物质释放量增加,远大于静态条件下的分子释放过程(Fan et al.,2014)。在荣成天鹅湖,由于受潮汐等影响,水动力作用较强,扰动条件下微生物和藻类对沉积物营养盐释放的影响有待于进一步研究。
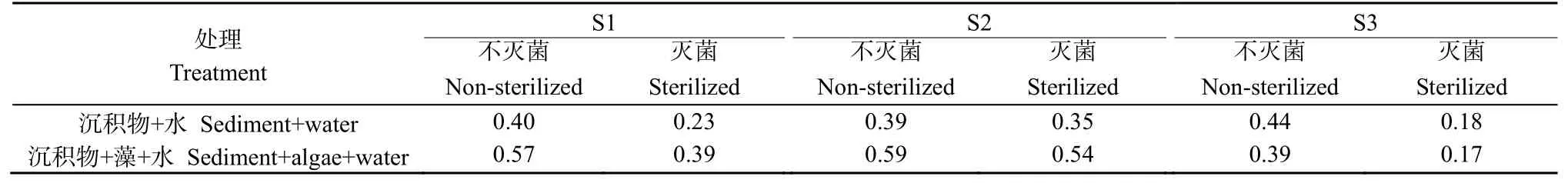
表3 试验结束时不同处理沉积物的微生物活性Table 3 The microbial activity in sediments at different treatments at the end of the experiment μg·g-1·min-1

表4 三因素方差分析检验微生物、硬毛藻和沉积物对水体磷质量浓度的影响Table 4 Three-way ANOVA for effects of microorganisms,Chaetomorpha and sediments on phosphorus mass concentration in water
综上所述,与无藻处理相比,藻类爆发条件下,微生物对沉积物营养盐释放的影响更为显著。藻分解向水体释放营养物质利于微生物生存,微生物活动可在一定程度上促进藻体分解,改变水土界面的理化性质,二者可相互作用加重水体富营养化。在天鹅湖的北部与湖中心,大型丝状硬毛藻频繁爆发,且沉积物中营养盐释放潜力较大,微生物活性较高;另一方面,水动力扰动也会促进沉积物营养盐释放。因此,在今后湖泊治理过程中,除控制外源污染外,要注意及时打捞死藻,以避免藻体死亡分解从而加重内源污染。
4 结论
(1)硬毛藻分解及微生物活动可改变天鹅湖水土界面理化性质。藻分解对水体氮磷(TN、NH4+-N、TP、SRP)质量浓度均具有极显著影响,微生物活性对氮及SRP质量浓度也具有极显著影响。三因素对水体氮磷质量浓度的影响顺序为:藻类>微生物>沉积物。水体TN、TP质量浓度均表现为未灭菌处理高于灭菌处理,有藻条件远高于无藻条件,且有藻条件下不同微生物处理的差异大于无藻条件。
(2)在荣成天鹅湖,不同湖区沉积物氮磷的释放能力存在差异。水体氮质量浓度在有藻、无藻条件下均表现为西北部>湖中心>湖南部,磷质量浓度有藻条件下与氮一致,无藻条件下则表现为湖中心>西北部>湖南部。湖中心沉积物营养盐的释放能力受微生物活动影响较大。在藻类大量暴发且微生物活性较高的西北部及湖中心,沉积物中氮磷的释放潜力较大,在藻类腐烂时期应引起足够重视。

