自动图像分析系统与快速流式细胞术在白细胞减少性疾病诊治中的价值
郭 平,陈骊婷,廖 兵,王剑飚
(1.上海交通大学医学院附属瑞金医院检验科,上海 200025;2.上海交通大学基础医学院,上海 200025)
近年来用于白细胞分类的新技术不断涌现出来,自动图像分析系统和快速流式细胞术是其中具有代表性的2种方法。自动图像分析系统通过神经网络图像识别技术完成形态特征的提取、映射和识别,具有检测时间短、分类相关性好的特点[1-2]。快速流式细胞术是采用一步法标记抗体、免去细胞洗涤、软件自动设门的外周血白细胞分类技术。本研究拟探讨上述2种方法在白细胞减少性疾病中的价值。
1 材料和方法
1.1 研究对象
选取2019年1—10月在上海交通大学医学院附属瑞金医院就诊且白细胞计数为(0.5~2.0)×109/L的患者181例,其中急性髓系白血病(acute myelocytic leukemia,AML)(包括化疗中)66例、急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)(包括化疗中)39例、骨髓增生异常综合征(myelodysplastic syndrome,MDS)25例、淋巴瘤(包括化疗中)31例、慢性乙型肝炎20例。
1.2 方法
1.2.1 仪器与试剂 FC500流式细胞仪及配套试剂,包括细胞分析用溶血剂(VersaLyse Solution)、细胞保存液(IOTest3)、流式细胞精密度质控微球(Flow-Check Pro Florospheres)和组合抗体含簇分化抗原(cluster of differentiation,CD)45、CD36、CD16、CD19、CD2和CD294均购自美国贝克曼库尔特公司。SP-10自动推染片机(以下简称SP10)及配套试剂均购自日本Sysmex公司。CellaVision DM96自动图像分析系统购自瑞典CellaVision公司。
1.2.2 检测流程 采集患者静脉全血2 mL,用乙二胺四乙酸二钾抗凝,混匀后于2 h内完成检测。随机挑选20份低值白细胞标本分别用显微镜镜检法、自动图像分析系统和快速流式细胞术进行白细胞分类计数并计时。使用SP-10进行推片、染色,每份标本制作至少2张血涂片,以满足显微镜镜检及自动图像分析系统白细胞分类计数要求。显微镜镜检法:每份标本由高年资技师人工显微镜镜检分类计数100个白细胞并记录耗时与结果。自动图像分析系统:记录100个白细胞自动图像分析系统预分类及自动图像分析系统预分类+人工审核的耗时与结果。快速流式细胞术:预先将细胞保存液与细胞分析用溶血剂以1∶40的比例配制成裂解固定液。将10 μL组合抗体与100 μL抗凝血混匀,室温避光静置15 min,随后加入1 mL裂解固定液,混匀后室温避光静置10 min,检测前使用Flow-Check检查仪器状态,分类计数10000个有核细胞,仪器自动设门计算细胞百分比,根据需要适当调整设门位置,记录操作耗时与检测结果。选取白细胞计数在2.0×109/L左右、存在一定数量原始细胞的标本,依次应用上述方法连续检测11次,去除第1次结果后计算后10次中性粒细胞、淋巴细胞、单核细胞和原始细胞分类计数的精密度。
1.3 原始细胞阳性判定标准
显微镜镜检法和自动图像分析系统预分类+人工审核原始细胞百分比≥1%时记为阳性。快速流式细胞术原始细胞百分比≥0.5%时记为阳性。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析。呈正态分布的数据以表示。呈非正态分布的数据以中位数(最小值,最大值)表示,组间比较采用Kruskal-Wallis秩和检验。采用Pearson相关分析评估各种方法间的相关性。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各种方法检测原始细胞的性能。以P<0.05为差异有统计学意义。
2 结果
2.1 白细胞分类计数耗时比较
显微镜镜检法耗时最长,自动图像分析系统预分类耗时最短,各组间差异均有统计学意义(P<0.05)。见表1。
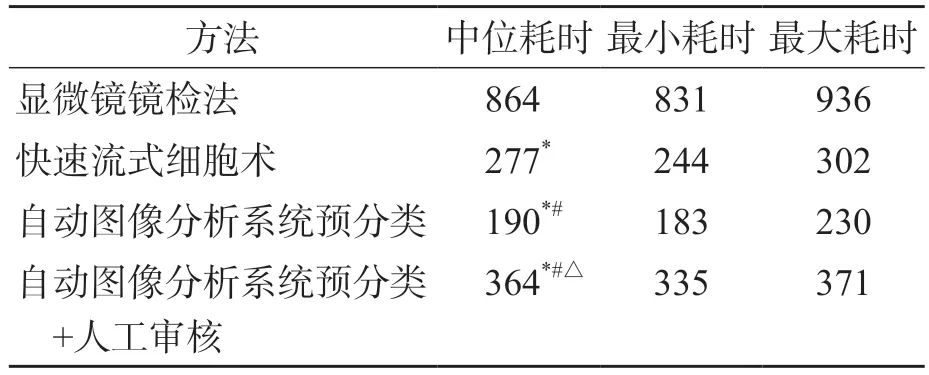
表1 4种方法白细胞分类计数耗时比较 s
2.2 白细胞分类计数精密度比较
快速流式细胞术中性粒细胞、淋巴细胞、单核细胞、原始细胞分类计数结果的离散度优于其他3种方法,显微镜镜检法分类计数结果的离散度最大。见表2。
2.3 原始细胞阳性符合率比较
对181例标本进行显微镜镜检,发现原始细胞阳性98例,阴性83例。显微镜镜检示原始细胞阳性的98例标本中,快速流式细胞术检出原始细胞阳性93例(94.9%),假阴性5例;自动图像分析系统预分类检出原始细胞阳性53例(54.1%),假阴性45例;自动图像分析系统预分类+人工审核检出原始细胞阳性78例(79.6%),假阴性20例。见表3。
表2 4种方法白细胞分类计数结果 %,
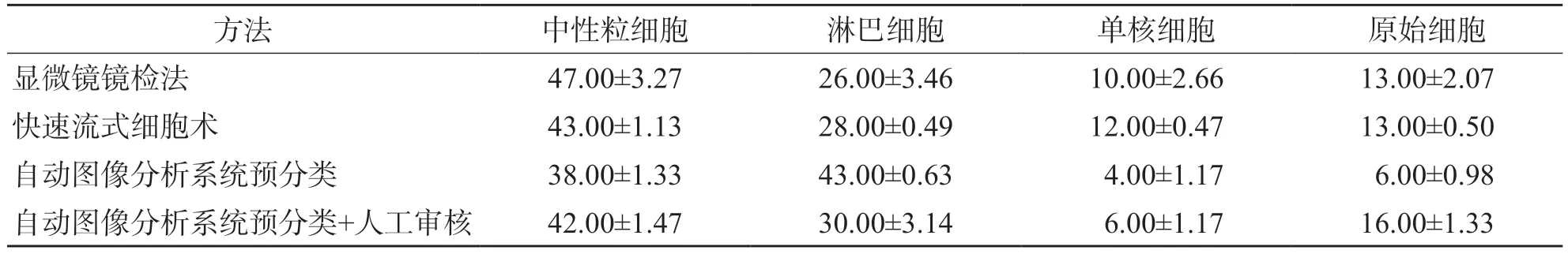
表2 4种方法白细胞分类计数结果 %,

表3 3种方法原始细胞阳性符合率比较
2.4 3种方法原始细胞检测结果与显微镜镜检法的相关性
快速流式细胞术和自动图像分析系统预分类+人工审核原始细胞分类结果与显微镜镜检法的相关性较好(r值分别为0.937、0.990,P<0.001),自动图像分析系统预分类与显微镜镜检法的相关性较差(r=0.507,P<0.001)。见表4。
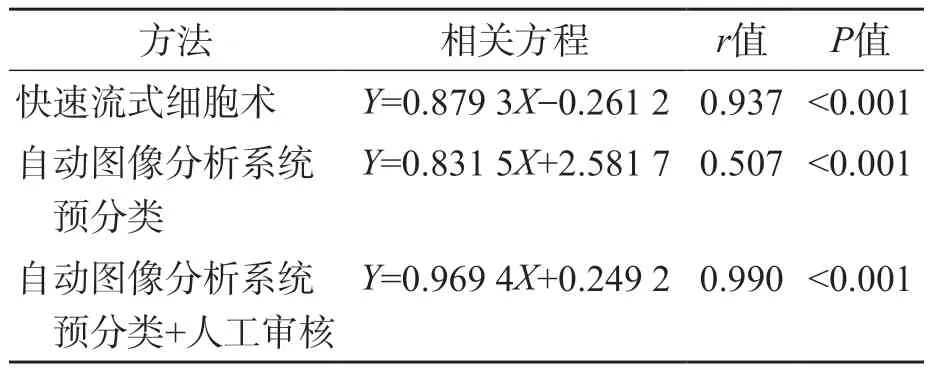
表4 3种方法原始细胞检测结果与显微镜镜检法的相关性比较
2.5 3种方法检测原始细胞的性能
ROC曲线分析结果显示,快速流式细胞术、自动图像分析系统预分类+人工审核和自动图像分析系统预分类检测原始细胞的曲线下面积分别为0.97、0.90、0.63。自动图像分析系统预分类检测原始细胞的敏感性和特异性均最低,快速流式细胞术的敏感性最高,自动图像分析系统预分类+人工审核的特异性最高(100.00%)。见表5、图1。
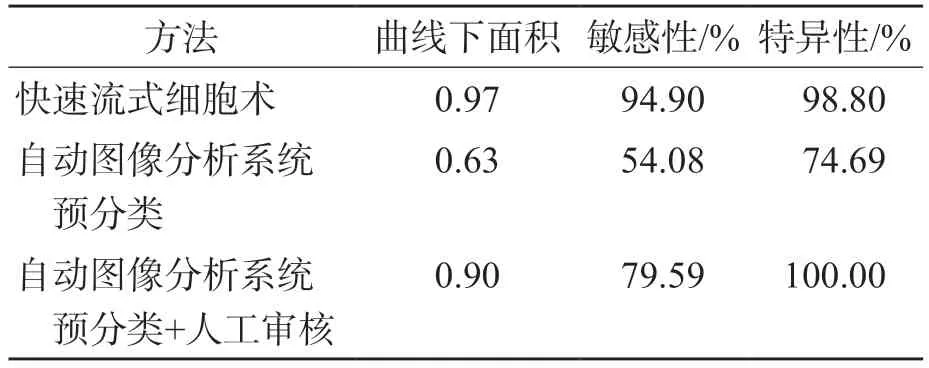
表5 3种方法检测原始细胞的性能比较
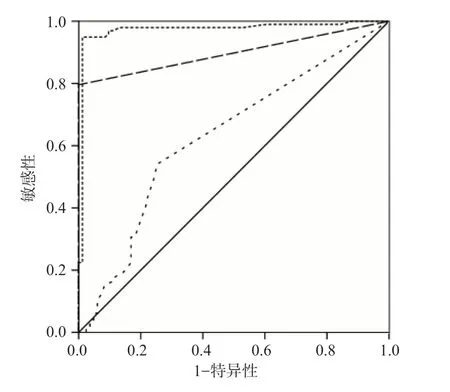
图1 原始细胞检测的ROC曲线
3 讨论
显微镜镜检是白细胞分类计数的金标准,但其准确性受制片质量、观察部位、检验人员水平等诸多因素影响[3-4],检测效率更是与白细胞计数密切相关。白血病患者使用的细胞毒性化疗药物往往会抑制骨髓生长,引起白细胞数量的下降和形态变化[5],这些因素不同程度地增加了显微镜镜检的时间和难度。因此,理想的白细胞分类技术应在具备显微镜镜检优点的基础上尽可能减少不足之处。
在临床标本不断攀升、人员工作量趋近饱和的背景下,提高检测速度是确保标本周转时间(turn-around time,TAT)的前提。本研究结果显示,白细胞数量减少时,显微镜镜检法单次白细胞分类计数耗时约15 min,而快速流式细胞术由于通量高、速度快,中位耗时约5 min,约为显微镜镜检法的32%。自动图像分析系统通过“城垛式”阅片的方式迅速定位细胞,提取特征后利用神经网络判断细胞类别,因此自动图像分析系统预分类速度更快,中位时间仅为显微镜镜检法的22%。在预分类的基础上进行人工审核需时约6 min,约为显微镜镜检法的42%,其中人员操作时间只需3 min左右,有效减轻了工作负担。
提升白细胞分类计数精密度是保证检验质量的条件。本研究结果显示,快速流式细胞术检测中性粒细胞、淋巴细胞、单核细胞、原始细胞的离散度优于自动图像分析系统预分类、自动图像分析系统预分类+人工审核和显微镜镜检法,主要原因在于快速流式细胞术检测细胞的数量更多,阅片或扫描区域更大。快速流式细胞术单次检测104个细胞,而显微镜镜检法或自动图像分析系统由于以血涂片为载体,用于分类的白细胞数量仅为100~200个;此外,显微镜镜检法或自动图像分析系统在白细胞分类计数时无法保证每人每次阅片或者仪器扫描的区域完全相同。因此,白细胞分类计数结果的离散度自然高于快速流式细胞术。
白血病治疗过程中外周血原始细胞的清除率反映患者对药物的敏感性,是指导临床用药、提示疾病预后的依据之一[6-9]。而计算清除率的前提是检测方法检出原始细胞的能力。本研究结果显示,以显微镜镜检法为参考方法,原始细胞阳性符合率由高到低依次为快速流式细胞术(94.9%)、自动图像分析系统预分类+人工审核(79.6%)和自动图像分析系统预分类(54.1%)。快速流式细胞术对原始细胞的判断基于细胞膜CD45的表达,受细胞形态变化干扰小,因此仅有5例标本假阴性和1例标本假阳性。假阴性标本来自AML化疗患者,显微镜镜检见幼稚单核细胞,形态学上这类细胞与原始细胞意义相同[10],在显微镜镜检时归入原始细胞。但幼稚单核细胞CD45表达程度高于原始细胞,自动设门时归为成熟单核细胞。假阳性标本来自多发性骨髓瘤患者,显微镜镜检可见大量浆细胞。由于组合抗体中没有针对浆细胞的抗体,而散点图中浆细胞CD45表达程度弱于其他正常细胞,设门时自动计入原始细胞,造成原始细胞比例假性升高。此类问题最好的解决策略是增加标记抗体种类或优化设门逻辑。国际血液学标准化委员会提出,使用8~10色的流式细胞术用于外周血白细胞分类,但上述方案目前仍在评估,进入临床尚需时日[11-12]。自动图像分析系统预分类有45例假阴性标本和21例假阳性标本。假阴性标本多来自ALL化疗患者,原始淋巴细胞在药物诱导下数量减少且形态变化,仪器将其归入淋巴细胞、涂抹细胞或无法识别的细胞等。COVUT等[9]的研究结果显示,自动图像分析系统在预分类时原始淋巴细胞数量往往被严重低估,在未进行化疗的标本中这些细胞多被计入成熟淋巴细胞。假阳性标本中误分类为“原始细胞”的有反应性淋巴细胞、未成熟粒细胞、发生退化的淋巴细胞等。上述情况在人工审核后有所改善,仪器的错误分类得以纠正,因此假阴性标本和假阳性标本数明显下降。
本研究结果显示,即使白细胞减少,快速流式细胞术原始细胞检测结果与显微镜镜检法(参考方法)仍有良好的相关性(r=0.937),与KAHNG等[13]的研究结果一致。但本研究得出的r值高于KAHNG等[13]的结果(r=0.8325),可能与研究对象的例数及参考方法计数的细胞数量不同有关。自动图像分析系统预分类与显微镜检法的相关性较差(r=0.507),但自动图像分析系统预分类+人工审核与显微镜镜检法的r值可达0.990,这与人工审核后原始细胞阳性符合率的变化一致。
ROC曲线分析结果显示,快速流式细胞术及自动图像分析系统预分类+人工审核检测原始细胞的曲线下面积分别为0.97和0.90,对标本中原始细胞的有无具有几乎相同的区分能力。快速流式细胞术检测原始细胞的敏感性更高,可达94.90%,这与流式细胞术相对更高数量级的细胞检测数、特异性单克隆抗体的使用及设门逻辑有关[14],但受抗体种类的制约。当细胞分化抗原表达上调或下降,组合抗体未包含识别某一类细胞的抗体时,结果会出现偏差。自动图像分析系统预分类+人工审核的特异性可达100%,但敏感性不到80%,原因为仪器漏检了对部分原始细胞比例为1%~2%。白细胞数量少,原始细胞比例过低,细胞分布不均以及检测时的随机误差可能是造成这种现象的原因[15-16]。鉴于自动图像分析系统有较快的检测速度,适当增加自动图像分析系统预分类的细胞数量可能是目前最有效的解决方式。EILERTSEN等[17]的研究结果显示,自动图像分析系统预分类的原始细胞检测敏感性高于自动图像分析系统预分类+人工审核,与本研究结果相反,推测该研究的技术人员误将原始细胞辨认为其他细胞。部分原始细胞的染色质结构在仪器显示屏上不易辨认[15]可能是分类错误的原因,提示当仪器对细胞的染色质结构显示不清晰时,应结合显微镜进行观察。
综上所述,白细胞数量减少时快速流式细胞术检测原始细胞精密度高、速度快、结果准确;自动图像分析系统预分类+人工审核的方式检测原始细胞高效、特异,同时可降低工作负担。不同方法的合理组合可提高白细胞减少性疾病原始细胞检测的敏感性、特异性及检测效率,对疾病的诊断、治疗和预后判断具有重要意义。

