ICC 患者血浆ctDNA 突变检测数字PCR 平台的建立及临床应用价值
戴 谦,黄 斐,王宇鹏,黄 傲,成剑文,潘柏申,郭 玮,周 俭,樊 嘉,杨欣荣,王蓓丽
(1.复旦大学附属中山医院检验科,上海 200032;2.复旦大学附属中山医院肝外科,上海 200032)
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)约占原发性肝脏肿瘤的10%~15%,恶性程度高,5年生存率不到10%[1-2]。虽然手术切除是目前ICC首选的治疗方式,但由于缺乏有效的早期诊断方法,有近70%的患者并没有机会接受手术治疗,只能采取放疗和化疗等姑息疗法,导致中位生存时间仅为1.8个月,而手术切除的中位生存时间为12.2个月[3]。目前,临床常用的影像学检查尚不能准确鉴别ICC与原发性硬化性胆管炎、肝内胆管结石等疾病。而血清学指标如糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、癌胚抗原(carcinoembryonic antigen,CEA)等的敏感性、特异性均难以满足临床需求[2]。因此寻找更有效的ICC早期预警、复发监测、预后评估及疗效监测方法是实现ICC患者早诊、早治、改善预后的关键[4-5]。
目前多采用肿瘤组织进行基因检测。然而,对于ICC来说,不仅肿瘤组织取材困难,且瘤内异质性高,不同位点仅有46.8%的突变基因一致率[6],一些常见突变基因如BRAF、KRAS、EGFR等在肿瘤组织中的检出率均不足30%[7-8],且不同ICC患者的高频突变基因谱也不尽相同[9]。由此可见,单一、特定的突变标志物在ICC诊疗中的作用有限,所以筛选我国ICC相关的突变基因并建立多个相关基因的诊疗谱具有重要意义。循环肿瘤DNA(circulating tumor DNA,ctDNA)以其半衰期短、无创、可反映肿瘤原发灶整体突变负荷等优势为这些问题的解决带来了希望。由于ctDNA仅占血浆循环DNA总量的1%,目前临床常用的检测技术无法对其准确定量。数字聚合酶链反应(digital polymerase chain reaction,dPCR)是通过单分子扩增实现核酸拷贝数绝对定量的第3代PCR技术,具有极高的敏感性和特异性,是目前ctDNA突变定量检测的优选方案。本团队前期研究已对ICC患者的肿瘤、癌旁组织及外周血进行了全外显子测序,并参考其他基于ICC组织的大规模测序文献[7,10-11],筛选出3个在外周血及肿瘤组织中特异存在的高频突变基因(KRASG12D、TP53 C242S、IDH1 R132C)。本研究旨在建立检测上述3种突变的dPCR平台,并初步评估该平台的基本检测性能及临床应用价值。
1 材料和方法
1.1 研究对象
选取2016年1月—2018年12月在复旦大学附属中山医院行切除手术的ICC患者22例,其中男17例、女5例,年龄52~78岁。ICC诊断标准:CA19-9升高或具有影像学特征,且由病理科明确诊断为ICC。ICC患者肿瘤组织样本来自手术切除组织,用福尔马林固定后制成石蜡包埋组织切片,苏木精-伊红(hematoxylin-eosin,HE)染色并由病理科评估,以保证有足够的肿瘤细胞用于后续检测。选取2019年7—8月在复旦大学附属中山医院行切除手术的肝细胞肝癌(hepatocellular carcinoma,HCC)患者10例作为疾病对照,其中男8例、女2例,年龄38~66岁。HCC诊断标准参考《原发性肝癌诊疗规范(2011年版)》中的诊断标准,所有患者均经病理诊断确诊为HCC。选取2018年1—12月复旦大学附属中山医院体检健康者10名作为正常对照,其中男7名、女3名,年龄42~60岁,均经过血液检查、影像学检查和临床检查排除肝、胆及其他脏器疾病。
1.2 方法
1.2.1 试剂与仪器KRASG12D、TP53 C242S、IDH1 R132C突变型及野生型质粒自行构建。限制性内切酶(XholⅠ和EcoRⅠ)购自大连 TaKaRa公司,普通DNA产物纯化试剂盒(批号03116)购自北京天根生化技术有限公司,石蜡切片样本DNA分离试剂盒(批号H21507150X)及血清/血浆游离DNA分离试剂盒(批号H21506020Y)均购自厦门艾德生物医药科技股份有限公司,TaqMan Genotyping MatserMix及ABI 7500定量PCR扩增仪均购自美国 Life Technologies公司,QX100微滴式dPCR系统和液滴稳定剂、Mini-Protean型垂直电泳仪、SYSTEM GelDoc XR IMAGELA成像仪均购自美国Bio-Rad公司。
1.2.2 质粒DNA制备 采用限制性内切酶酶切野生型和KRASG12D、TP53 C242S、IDH1 R132C突变型质粒,使其成为线性短链DNA,经普通DNA产物纯化试剂盒纯化后,-80℃保存备用。
1.2.3 样本DNA制备 取ICC患者10 μm厚的石蜡包埋组织切片5张,依照石蜡切片样本DNA分离试剂盒说明书要求抽提组织DNA,溶于100 μL洗脱液中,置-80℃保存备用。采集ICC、HCC患者手术前的静脉血10 mL,采集正常对照者静脉血10 mL,乙二胺四乙酸二钾抗凝,900×g离心10 min,吸取上清液,16000×g再次离心10 min,以彻底去除血浆中剩余的有核细胞,根据血清/血浆游离DNA分离试剂盒说明书,提取血浆游离DNA,溶于50 μL洗脱液中,置-80℃保存备用。
1.2.4 引物及探针 参考文献[11],采用Primer Express软件(美国ABI公司)分别设计KRASG12D、TP53 C242S、IDH1 R132C突变引物及探针。见表1。

表1 KRAS、TP53、IDH1突变引物及探针序列
1.2.5 建立dPCR检测平台 dPCR的原理主要是基于SYKES等[12]提出的模板无限稀释及泊松分布定量检测理论,在传统PCR扩增前对样本进行微滴化处理,将含有核酸分子的反应体系稀释为1000万份pL级微滴,使每个微滴分配有一个至数个待检核酸分子或不包含待检核酸分子,随后经PCR扩增后,对每个微滴进行逐次检测,根据野生型与突变型微滴种荧光信号的有无进行判读,最终得出待测突变的丰度。反应体系:TaqMan Genotyping MatserMix 10 μL,10 μmol/L上游和下游引物各0.9 μL,10 μmol/L野生型和突变型探针各0.5 μL,模板(ctDNA)6.0 μL,去离子水1.2 μL,终体积为20 μL。反应条件:95℃酶活化10 min;95℃变性15 s,58℃退火15 s,60℃延伸15 s,45个循环;98℃孵育10 min,最终降温至12℃。
1.3 dPCR平台检测性能评估
1.3.1 准确性评估 将KRASG12D、TP53 C242S、IDH1 R132C突变型质粒分别配制成高、中、低(KRASG12D:5%、1%、0.5%;TP53 C242S:5%、1%、0.5%;IDH1:7.8%、1.56%、0.78%)3个丰度的标准品,每种突变类型的每个丰度重复检测3次,要求定量结果与理论值的偏差≤±15 %。
1.3.2 精密度评估 自制KRASG12D、TP53 C242S、IDH1 R132C突变高、低2个丰度的混合标准品,每个丰度分装后保存于-20℃直至检测,批内重复检测8次,计算批内变异系数(coefficient of variation,CV);每批重复检测2次,连续检测5 d,计算批间CV。CV≤20%为符合要求。
1.3.3 空白限(limit of blank,LOB)评估 自配仅含3种基因的野生型质粒(2×105拷贝/μL),计算由错配产生的假阳性液滴数。dPCR为绝对定量,1滴代表1拷贝。
1.3.4 功能灵敏度评估 将KRASG12D、TP53 C242S和IDH1 R132C突变型质粒分别倍比稀释为20000、2000、200、20和2 拷贝/μL,各自与等量野生型质粒(2×105拷贝/μL)混合,得到浓度分别为10%、1%、0.1%、0.01%和0.001%的标准品质粒。每个浓度重复检测5次,满足CV<20%的标准品质粒最低分子丰度为功能灵敏度。
1.3.5 线性评估 分别重复检测10%、5%、1%和0.1%的标准品质粒3次,各浓度的检测偏差百分比<15%,且曲线的回归系数(r2)>0.99可判断为线性。
1.3.6 临床应用评估 将KRASG12D、TP53 C242S和IDH1 R132C这3种突变命名为ctDNA突变谱。采用建立的ctDNA突变谱dPCR平台检测22例ICC患者和10例HCC患者、10名正常对照者外周血ctDNA突变情况,初步评估该平台的检测效能。22例ICC患者术前外周血及肿瘤组织分别采用Oseq-ctDNA及Oseq-T靶向测序平台(华大基因公司)检测,评估这2种平台与自建dPCR平台的一致性。ICC患者行切除术后每6个月采集1次外周血并跟踪随访,平均随访时间为22.3个月,以患者死亡为随访终点。结合影像学及血清肿瘤标志物检查结果,初步评估dPCR平台在ICC患者术后疗效监测及预后评估中的作用。
1.4 统计学方法
采用SPSS 19.0软件进行统计分析。采用单侧泊松分布公式计算LOB。计数资料以率表示,组间比较采用χ2检验。相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 方法学评价
2.1.1 准确性评估KRASG12D、TP53 C242S和IDH1 R132C突变3个丰度的检测结果与理论值的偏差均<±15 %,符合要求。见表2。
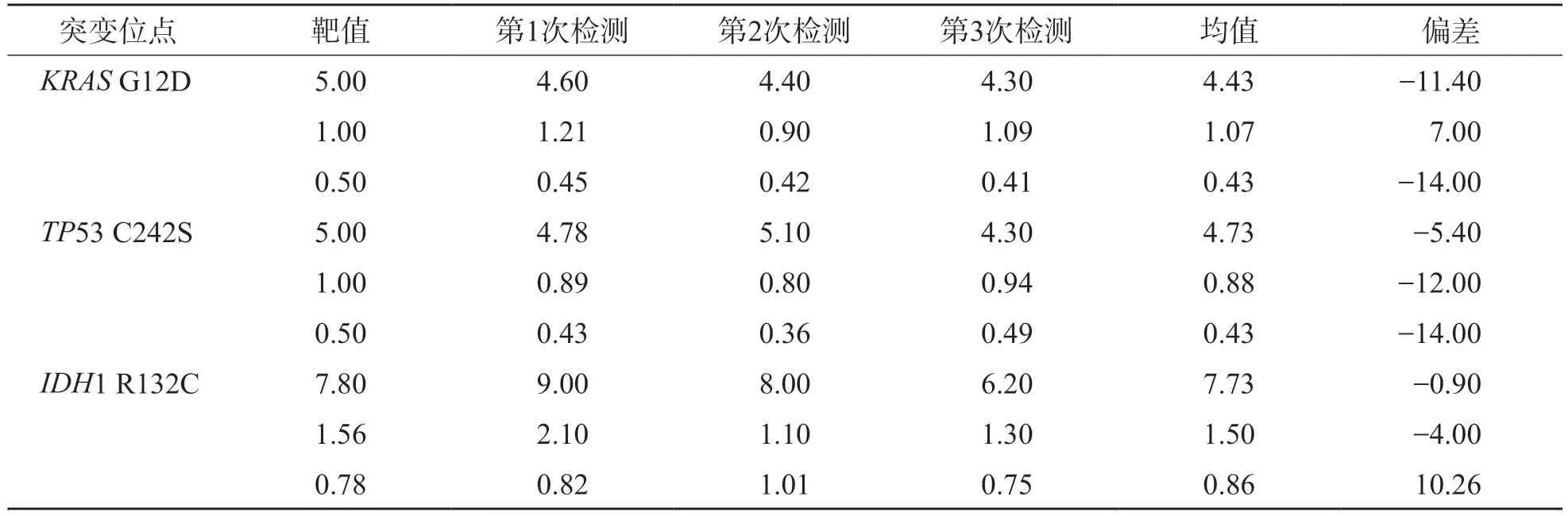
表2 dPCR平台检测3种突变的准确性 /%
2.1.2 精密度评估KRASG12D、TP53 C242S和IDH1 R132C突变高、低2个丰度的批内精密度(CV)和批间精密度(CV)均<20%,符合要求,见表3。
2.1.3 LOBKRASG12D、TP53 C242S和IDH1 R132C突变的平均假阳性液滴数分别为4、3、3滴,为减少检测临床样本的假阳性结果,将3种突变的LOB统一设定为4滴。见图1。
2.1.4 功能灵敏度 dPCR平台的功能灵敏度可达0.1%,见表4。

表3 dPCR平台检测3种突变高、低丰度的批内和批间精密度结果

图1 dPCR平台检测3种突变的LOB评估
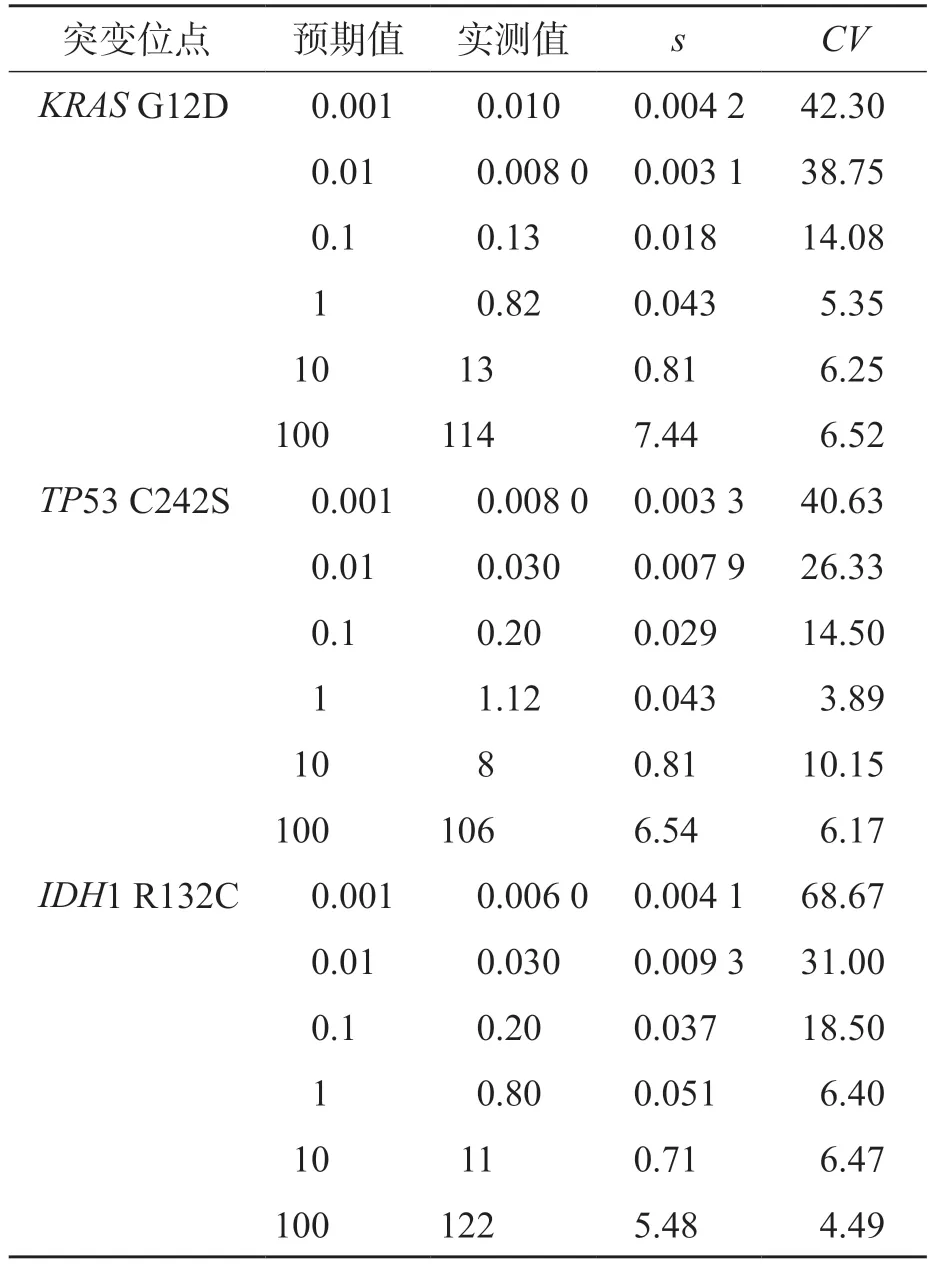
表4 dPCR平台检测3种突变的功能灵敏度 /%
2.1.5 线性评估 线性回归分析结果显示,KRASG12D、TP53 C242S和IDH1 R132C预期值与实测值的线性回归方程分别为Y=0.9720X+1.029(r2=0.9987,P<0.01)、Y=0.9757X+0.05599(r2=0.9971,P<0.01)、Y=1.033X+0.07856(r2=0.9962,P<0.01)。在0.1%~10.0%范围内线性良好。见图2。
2.2 dPCR平台的临床应用评估
2.2.1 dPCR平台检测22例ICC患者3种基因突变的结果 采用建立的dPCR平台检测22例ICC患者的3种基因突变,有7例患者为阳性,见表5;10例HCC患者及10名正常对照者均为阴性。
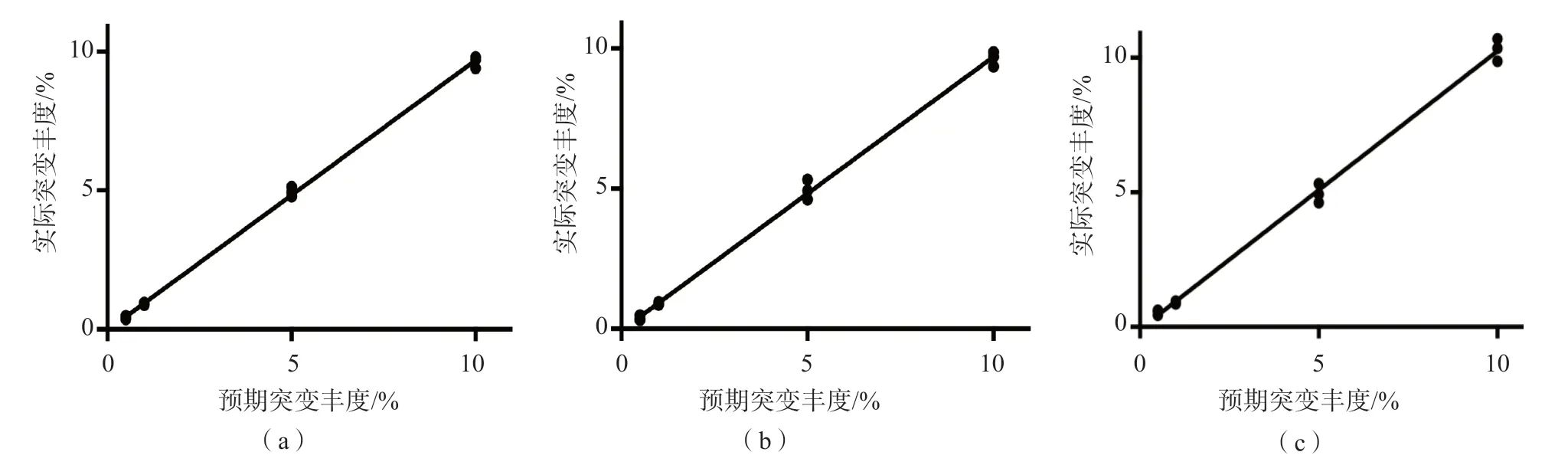
图2 dPCR检测3种突变的线性评估

表5 7例ICC患者3种基因突变检测阳性结果
2.2.2 ctDNA突变谱和CA19-9单项及联合检测诊断ICC的效能 ROC曲线分析结果显示,ctDNA突变谱诊断ICC 的曲线下面积(area under curve,AUC)为0.659,敏感性为31.8%,特异性为100%;CA19-9诊断ICC 的AUC为0.773,最佳临界值为>37 U/mL,敏感性为54.5%,特异性为100%;ctDNA突变谱与CA19-9联合检测诊断ICC的AUC为0.841,敏感性为68.2%,特异性为100%。见图3。
2.2.3 dPCR与Oseq-ctDNA及Oseq-T靶向测序的一致性 dPCR检测22例ICC患者外周血3种基因突变结果与Oseq-T测序结果的一致性为100%。dPCR平台与Oseq-ctDNA测序结果有较高的一致性(kappa=0.792,P=0.007),其中患者7采用dPCR检测到0.12%的KRASG12D突变丰度,在肿瘤组织样本中同样也检测到该突变,但Oseq-T靶向测序却未在外周血中检测出该突变。

图3 ctDNA突变谱和CA19-9单项及联合检测诊断ICC的ROC曲线
2.2.4 跟踪随访 对7例dPCR阳性患者中的3例(患者3、患者9、患者7)进行治疗后跟踪随访,每间隔6个月检测1次ctDNA突变谱。3例患者中有1例失访(患者9)。患者3在行切除术后ctDNA突变谱载量显著降低,但术后18个月时再次检测到KRASG12D突变(丰度0.33%),同时伴有CA19-9升高(45.6 IU/L),影像学检查确认肝内多发转移灶,见图4。患者7行切除术后采用GEMOX方案(吉西他滨、奥沙利铂)进行巩固治疗,治疗后ctDNA突变谱载量持续下降并最终转为阴性,见图5。

图4 患者3 ICC突变基因谱、肿瘤标志物的变化及CT检查结果

图5 患者7 ICC突变基因谱及肿瘤标志物的变化
3 讨论
ICC是仅次于HCC的第2位原发性肝脏恶性肿瘤,近年来发病率呈明显上升趋势[13-14]。我国的ICC患者例数远高于欧美,约占全世界胆管癌患者的55%[15],深入研究ICC有非常重要的意义。
由于缺乏典型的症状,ICC的早期诊断仍然较困难,CA19-9、CEA是目前较为有效的血清学指标,但在鉴别诊断胆道梗阻、肝内胆管结石时,其敏感性与特异性均不理想[16]。近年来,随着液体活检技术的兴起,ctDNA检测成为当前肿瘤研究领域的新热点,其在肿瘤早期诊断、预后评估、复发转移监测和疗效预测等方面均具有广阔的临床应用前景。
ICC是存在高度异质性的肿瘤。ZOU等[7]的研究结果显示,ICC相关的突变基因可达25个,其中8个(TP53、KRAS、IDH1、PTEN、ARIDA、EPKK1、ECE2、FYN)可能为驱动基因。结合本团队前期研究结果,其中TP53、KRAS、IDH1是最常见的突变基因,所以本研究选择了这3个基因作为检测对象。
目前,用于血浆ctDNA检测的技术存在灵敏度低、定量不准确等缺陷,而dPCR以其独特的检测原理,能在大量体细胞DNA干扰的背景下对低频突变进行准确的绝对定量(0.01%~1.00%)检测。因此,本研究建立了检测KRASG12D、TP53 C242S、IDH1 R132C突变的dPCR平台,并评估了该平台的检测性能,结果显示,该平台的功能灵敏度可达0.1%,与文献报道一致[17]。在0.1%~10.0%范围内该平台的检测结果呈线性,可对KRASG12D、TP53 C242S、IDH1 R132C突变进行准确的定量检测。
采用dPCR平台对22例ICC患者外周血进行检测,ctDNA突变谱诊断ICC的敏感性为31.8%,特异性为100%,与CA19-9联合检测时可将敏感性提升至68.2%。由于本研究的入组例数过少,因此该平台是否可作为ICC的辅助诊断工具还有待进一步研究。ctDNA突变的定量检测可作为肿瘤诊疗随访的纵向观察指标,适合对肿瘤负荷进行监测。行恶性肿瘤根治术后,患者ctDNA可降至正常水平,如不能降至正常水平,提示可能有肿瘤病灶残留[18]。有研究结果显示,在转移性乳腺癌患者中,ctDNA较糖类抗原153(carbohydrate antigen 153,CA153)、循环肿瘤细胞(circulating tumor cell,CTC)能更好地反映病情变化[19]。对2例ICC患者治疗后的动态监测结果显示,外周血ctDNA突变丰度随患者原发病灶的切除而降低,提示本研究建立的dPCR平台可用于ICC患者治疗后的随访监测。另外,在治疗过程中进行ctDNA突变的动态监测,可提前预警获得性耐药的发生。在用表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体治疗结肠癌的过程中,监测ctDNA中的KRAS突变,可比常规方法提前10个月发现KRAS突变相关耐药的发生[20]。本研究在1例ICC患者(患者3)的随访过程中观察到KRASG12D突变在肿瘤切除术后18个月升高,与影像学检查确认的复发时间一致。
目前尚无用于ICC治疗的标准靶向药物。虽然美国食品与药品监督管理局(U.S.Food and Drug Administration,FDA)尚未批准针对本研究检测的3个突变基因位点(KRASG12D、TP53 C242S、IDH1 R132C)的靶向药物。但针对TP53突变的基因疗法、靶向肿瘤疫苗和抗肿瘤药物已处于临床试验阶段,如STG-53、ALT-801、MK-1775等[21-22],这些药物在晚期实体肿瘤的治疗中表现出了一定的疗效。IDH1基因编码异柠檬酸脱氢酶,这是一类在三羧酸循环中起重要作用的酶家族,该类酶依赖辅因子催化异柠檬酸氧化脱羧生成α-酮戊二酸,是三羧酸循环中的限速步骤。IDH1基因及IDH2基因突变可导致蛋白功能受影响,突变的IDH1/IDH2编码的异柠檬酸脱氢酶催化异柠檬酸变成2-羟戊二酸,而非α-酮戊二酸。目前,针对IDH1 R132C的靶向治疗药物有替莫唑胺[23]及AG-120[24]。替莫唑胺是一类具有抗肿瘤活性,含有咪唑四嗪环的烷化剂类抗肿瘤药物,其本身无活性,属于前体药物,须在生理水平的pH值下经非酶途径转化为活性化合物异硫氰酸甲酯,异硫氰酸甲酯可通过DNA鸟嘌呤的O6和N2位点上的烷基化(甲基化)发挥对肿瘤的细胞毒作用。1999年,美国FDA批准替莫唑胺用于治疗难治性间变型星形细胞瘤。AG-120是小分子异柠檬酸脱氢酶1抑制剂,通过特异性结合IDH1突变的构象,抑制突变构象形成2-二羟戊酸,从而抑制细胞增殖和分化。目前,AG-120用于治疗携带IDH1突变的实体瘤患者的临床试验(NCT02073994)正在开展,但尚未见IDH1抑制剂替莫唑胺及AG-120用于治疗携带IDH1突变的肝胆癌患者的报道。
综上所述,本研究建立了检测外周血KRASG12D、TP53 C242S、IDH1 R132C突变的dPCR平台,并初步评估了该平台的检测性能及临床应用价值,但由于样本量较少,其在ICC诊断中的价值还有待增加样本量进一步研究。初步研究结果表明该平台可用于定量检测外周血ctDNA突变,适用于ICC患者的辅助诊断、术后疗效评估及疗效动态监测等。该平台的建立有助于推动ICC个体化治疗的进展,为临床提供更准确的患者基因突变信息。

