脑卒中上肢痉挛性瘫痪患者经颅磁刺激联合物理治疗后皮质和脊髓兴奋性的变化观察
张丽 巩小英 贺蕾 刘丹 安红艳 王纪恒
(延安大学咸阳医院神经内科,陕西 延安 712000)
上肢痉挛(ULS)是脑卒中后的一种运动障碍,由于功能丧失、关节僵硬和疼痛而严重影响日常生活和活动[1-2]。脑卒中后ULS产生的神经生理学机制目前仍知之甚少。目前通常认为痉挛是起源于脊髓的兴奋性和抑制性下行信号调节的伸展反射回路兴奋性增强的结果。重复经颅磁刺激(rTMS)等非侵入性脑刺激疗法可提高皮质兴奋性,从而使皮质对脊髓兴奋性的抑制作用减轻[3]。本研究中,我们探讨了1Hz rTMS 联合物理治疗(PT)治疗脑卒中患者是否具有调节大脑皮质和脊髓兴奋性的作用,现报告如下。
1 资料与方法
1.1一般资料 选择2014年8月至2019年8月本院神经内科治疗的脑卒中后上肢痉挛性瘫痪患者80例,年龄40~75岁,男45例,女35例。随机将患者分为观察组和对照组,各40例。纳入标准:(1)诊断缺血性或出血性卒中发生通过CT或MRI证实;(2)中风发病≥6个月和<10年;(3)手腕肌肉张力的分数在改良Ashworth痉挛量表(MAS)的1+~2;(4)无认知障碍,由微型精神状态检查确定(分数>20);(5)签署知情同意书。排除标准:(1)经体格检查及CT或MRI等辅助影像证实有多处脑部病变;(2)入组前6个月内使用抗痉挛药物;(3)怀孕;(4)使用金属植入物或心脏起搏器;(5)有癫痫发作史或脑动脉瘤。
1.2方法 观察组采用rTMS联合PT治疗,对照组仅用PT治疗。rTMS:1 Hz,1 500脉冲,其强度为静息运动阈值的90%,3次/周,共10次。PT:刺激后立即应用30 min PT方案,根据患者的功能能力调整活动,主要集中于上肢康复。PT主要有以下四个目标:(1)提高患者的灵活性(腕/手指屈肌、肱二头肌、胸大肌的伸展运动和颈部肌肉的活动);(2)增强力量(本体感受性神经肌肉促进运动);(3)改善协调与平衡;(4)改善病人在转诊期间的活动能力。所有的活动都是基于对脑卒中患者的临床实践指南的建议。采用改良的阿什沃思量表和磁刺激器(MSO)的输出强度测量患者ULS程度和皮层兴奋性。脊髓兴奋性通过基线时、治疗结束时和随访4周时正中神经的Hmax/Mmax比值来测量。
1.2.1电生理学测量方法 使用磁刺激器进行TMS,所述磁刺激器连接到70 mm的8字形线圈,该线圈固定在头皮上,与未受影响的半球的运动皮层上的中间矢状线成45°。用Ag-AgCl表面电极对第一背骨间肌进行表面肌电图(EMG)记录。所有数据以5 kHz的模数转换速率进行数字化,然后使用Neuro-MEP-Micro软件传输到实验室计算机中。运动皮质兴奋性记录在基线和每个治疗阶段。在每次评估之前,对强度进行调整,以平均引出1 mV峰值到峰值振幅的基线MEPs。线圈位置用防水笔标出,保证在整个研究过程中线圈位置相同。Hmax/Mmax比值反映了反射性激活的运动神经元的比例。通过外周电刺激(矩形脉冲,1 ms持续时间,频率0.2 Hz),由表面肌电图记录。在2 500 Hz的采样频率下收集肌电图数据,放大并带通滤波(10~1 000 Hz)。在10个治疗期(即干预后)和4周随访后,在基线时测量h反射。
1.2.2临床测量方法 在每次训练之前,记录改良的Ashworth量表(MAS)以确定受影响手中腕部屈肌的痉挛状态。该测量表为6分制,用于评估每个关节被动运动的平均阻力。
1.3统计学方法 采用SPSS 20.0软件进行数据统计分析。采用描述性统计方法对研究对象的人口学和临床特征进行描述。为了便于数据分析,将MAS评分1+、2和3分别赋值为数值2、3和4。由于MAS数据不符合正态性标准,因此采用Friedman检验计算各治疗期与第一次治疗期MAS评分的差异。组内分析采用Wilcoxon检验,组间比较采用Mann-Whitney检验。计数资料应用χ2检验,计量资料应用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1两组患者一般情况比较 两组患者年龄、性别、卒中后时间、缺血型中风类型、右侧麻痹、右利手、基线时腕关节MAS评分以及教育程度方面差异无统计学意义(P>0.05)。
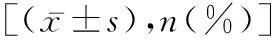
表1 两组患者一般情况比较
2.2两组患者皮质兴奋性差异 干预后,观察组皮质兴奋性增强,两组间存在差异(P<0.05),见图1。此外,第5次和第10次干预后,观察组最大输出强度(MSO)差值明显低于对照组,差异具有显著统计学意义(P<0.001);观察组MSO的第10次干预后的数值明显低于第1次干预的数值,差异有统计学意义(P<0.001)。
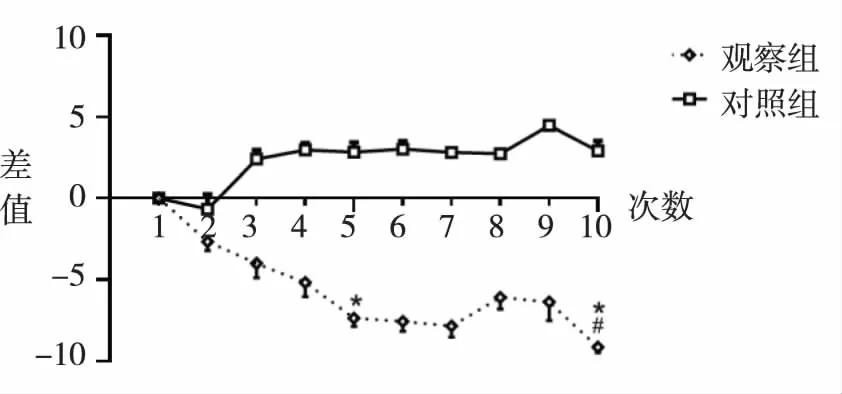
注:#表示两级之间有显著差异;*表示与第一个疗程之间MSO差值有显著差异。图1 每次治疗后与首次治疗时MSO差值图
2.3两组患者脊髓兴奋性比较 观察组治疗后Hmax/Mmax值明显降低,两组治疗后与治疗前的Hmax/Mmax的差值之间具有差异(P<0.05),4周随访时Hmax/Mmax比值有显著性差异(P<0.001)。见表2。

表2 两组患者干预后、4周随访时Hmax/Mmax与治疗前的差值比较
注:对照组与观察组相比,#P<0.05。
2.4两组患者痉挛情况比较 观察组改良Ashworth评分治疗前(3.86±1.21),治疗后(2.04±0.59);对照组改良Ashworth评分治疗前(3.88±1.26),治疗后(2.98±0.86)。观察组与对照组治疗后改良Ashworth评分明显下降,与治疗前相比,差异有统计学意义(P<0.05);治疗后观察组评分低于对照组,差异有统计学意义(P<0.05)。
3 讨论
健康人有一个平衡的半球间互动,而脑损伤后,因为受影响半球皮质内神经元回路的活动减少,且对未受影响半球的过度抑制,使这种相互作用失衡。抑制未受影响的半球兴奋性会减少半球间抑制,导致皮质脊髓束下行抑制输入增强,随后运动神经元兴奋性降低,使得痉挛症状减轻[4-6]。有研究[7-8]将抑制rTMS与运动训练结合起来,观察到皮层刺激后即刻的随意肌收缩增加了皮层兴奋性,逆转了rTMS在促进过程中的抑制作用。
本研究通过rTMS联合PT治疗脑卒中上肢痉挛性瘫痪患者,观察其对皮质和脊髓兴奋性的影响,以及对ULS程度的影响。本研究结果表明,治疗结束时,观察组皮质兴奋性增强,MSO值低于对照组和基线 (P<0.05);观察组在4周的随访中脊髓兴奋性明显低于对照组(P<0.05);观察组治疗后改良Ashworth评分明显降低(P<0.05),ULS症状减轻。rTMS联合PT可降低ULS水平和脊髓兴奋性,增加了未受影响半球的皮质兴奋性。这可能是由于rTMS通过刺激脑部区域调制刺激区域和远隔区域的神经功能的兴奋性,促进大脑皮质激活模式正常化,进而产生治疗效果。PT可提高患者的灵活性、增强力量、改善协调与平衡,两者联合应用临床效果更佳。
综上,本研究证明在未受影响的运动皮层结合PT的1 Hz rTMS治疗卒中后患者,提高了大脑皮质的兴奋性,降低了的脊髓兴奋性,改善了ULS症状,值得临床推广使用。但本研究纳入病程范围较小,瘫痪的发展时间以及初始损伤的数量可以改变PT的最终结果,需进一步观察研究。

