雷帕霉素对大鼠肾缺血再灌注后心肌损伤的作用及机制研究
邓 宇,李丽娜,王鹏帆,张营帅,曹福源,张 伟
(1.华北理工大学临床医学院,河北 唐山 063210;2.华北理工大学公共卫生学院,河北 唐山 063210;3.华北理工大学实验动物中心,河北 唐山 063210;4.华北理工大学基础医学院,河北省慢性疾病重点实验室,河北 唐山 063210)
在肾移植和肾肿瘤切除术等一些复杂的肾手术中,需要暂时阻断肾血流。术后再灌注过程会加重缺血性肾组织损伤,该过程称为肾缺血再灌注损伤(renal ischemia reperfusion,RIR)[1]。RIR除了对肾本身造成损伤外,还可以对心、肺、脑等远隔器官造成损害[2]。RIR过程中所产生的毒性代谢产物和炎性介质,易进入血液循环,从而影响作为远隔器官心脏的代谢与功能。心脏血流量大,易受循环中有害物质影响而出现结构和功能损伤,其中免疫损伤在肾缺血再灌注后的心肌损伤中起重要作用。研究表明,免疫系统干预可能对RIR后心脏有保护作用。雷帕霉素是一种免疫抑制剂(RAPA),可以通过受体FK50结合蛋白12结合靶标(mTOR)[3],以抑制其信号传导,从而减少G1期晚期免疫细胞的停滞并抑制免疫反应。RAPA对RIR后心脏的保护机制仍不清楚。尽管国内外诸多学者在雷帕霉素对肾脏缺血再灌注损伤方面做了大量的研究工作,但RAPA对RIR后心脏的保护机制仍不清楚。因此,我们对RAPA对RIR后心脏的保护作用进行了探讨,以期从免疫反应角度寻找减轻RIR后心脏损伤的方法。
1 材料和方法
1.1 实验动物
SPF级SD健康雄性大鼠40只,体重20~25 g(误差不大于10%),周龄:8~9周,购自北京维通利华实验动物中心技术有限公司[SCXK(京)2017-0001],在唐山市慢性病临床基础研究重点实验室[SYXK(冀)2015-0038]完成实验。动物实验经华北理工大学实验动物伦理委员会审核批准(2017080),并按实验动物使用的3R原则给予人道关怀。
1.2 主要试剂与仪器
全自动生化分析仪及流式细胞仪均购自美国加利福尼亚州Beckman Coulter公司;生化检测试剂盒由南京建成生物制品公司提供,实验方法参见试剂盒说明;高倍率显微镜购自日本东京奥林巴斯公司;TUNEL试剂盒购自武汉博斯特生物科技有限公司;二抗购自北京中山生物技术公司;RT-qPCR所用试剂盒购自中国大连TaKaRa生物技术有限公司。
1.3 实验方法
1.3.1 动物的处理
大鼠分为4组:(1)空白组:10只,常规饲养3 d。(2)假手术组:10只,常规饲养3 d。(3)RIR组:10只,常规饲养3 d。(4)雷帕霉素处理组:10只,每日灌胃给予雷帕霉素(4.5 mg/(kg/d)),持续3 d。
1.3.2 动物模型复制
大鼠称重后用3%戊巴比妥钠溶液(100 mg/kg)腹腔注射麻醉,然后开腹,找出左右两侧肾动、静脉后夹闭,45 min后恢复血流供应,复制大鼠肾缺血再灌注模型。操作中肾由红变白再由白变红,认为经历了缺血再灌注过程,术后逐层缝合。假手术组除不夹闭双侧肾动、静脉外,其余操作同RIR组。雷帕霉素处理组经灌胃给药饲养3 d后再经历手术,雷帕霉素处理组的剂量为每天4.5 mg/kg,其余操作处理同RIR组。
1.3.3 样品采集与检测
腹主动脉取血并留取心脏和脾组织标本。取心尖组织经HE染色,镜检,观察心肌细胞的形态学变化。
1.3.4 指标测定及试剂来源
(1)血浆生化指标测定
采集腹主动脉血3 mL,加肝素,离心,采用全自动生化分析仪进行测定,连续监测1~3 min观察吸光度的变化,计算肌酸激酶和肌酸激酶同工酶的活力值,结果以103U/L表示。
(2)肾功能
肾灌注后24 h,经腹主动脉取血分成两部分,一部分血液检测尿素氮,另一部分检测肌酐。肌氨酸氧化酶法测定肌酐,脲酶法测定尿素氮。
(3)心脏病理损伤的半定量分析
剖开胸腔,取出心脏,洗净,甲醛固定,脱水浸蜡,石蜡包埋,PAS染色,观察病理切片并进行心脏病理损伤的半定量分析。在高倍率显微镜(200×)随机地选择10个视野,观察损伤程度。运用半定量病理评估法评分,标准为:正常为0,损伤<25% 1分,损伤25%~50% 2分,损伤51%~75% 3分,损伤>75% 4分。
(4)细胞凋亡测试
心脏经固定过夜,石蜡包埋,依据荧光及显色法,在DNA断裂时3’-OH暴露被抗荧光素抗体标记,经过PBS漂洗,水冲洗,用滤纸吸干水分,加样,在DAB的催化下室温孵育5~30 min呈棕色,观察凋亡细胞状况并在显微镜下拍照保存。根据TUNEL试剂盒指示说明操作。显微镜下的红色荧光为TUNEL阳性细胞。随机选择六个非重复视野(200×),凋亡指数(AI):AI(凋亡计数/总细胞计数)×100%。
(5)流式细胞仪
将大鼠的血液,脾和心脏制成单细胞悬液,在免疫染色之前裂解红细胞,用无菌PBS和BSA缓冲液洗涤,加入一抗的重悬细胞,避光保存,PBS离心洗涤,加入二抗,洗涤,进入Cellquest调整优化细胞流速和浓度,使目标细胞通过进样室的速度为2000/s左右,进行细胞分选,用流式方法检测分析NKT细胞。NKT细胞判定标准为CD3和NK1.1双阳性。心脏总RNA用TRIzol提取。纯化后,将RNA样品用于反转录以合成cDNA。
(6)RT-qPCR检测VEGF,HIF-1α和CXCL10 mRNA水平。
PCR反应中使用的引物为:β-肌动蛋白正向,5’-AGGCATCCTGACCCTGAAGTA-3’和反向,5’-GA GGCATACAGGGACAACACACAG-3’;CXCL10正向5’-ACTGCATCCATATCGATGAC-3’和反向5’-TTC ATCCTGCAATGATCTC-3’;HIF-1α正向,5’-AAG TCTAGGGATGCAGCAC-3’,反向,5’-CAAGATCACC AGCATCTAG-3’;VEGF正向为5’-ATTGAGACCC TGGTGGACATC-3’,反向为5’-TCCTTTCCTCGA ACTGATT-3’。使用2-ΔΔCq方法将每个基因的表达水平标准化为内源性对照β-肌动蛋白。
1.4 统计学方法
采用SPSS 18.0统计软件进行分析,各组数据以平均数±标准差(±s)的形式表示,单因素方差分析q检验统计处理各组之间的差异,以P<0.05代表差异具有统计学意义。
2 结果
2.1 大鼠生存情况
在实验过程中,由于损伤缺口小,研究人员能够迅速找到肾动静脉,进行分离夹闭。夹闭时间45 min较短,因此在恢复再灌注过程中大鼠一直是存活的。动物在麻醉的状态下进行取材,先抽取腹主动脉血液,迅速摘取脾和心脏。
2.2 血浆CK、CK-MB、BUN和Scr水平
与RIR组相比,雷帕霉素处理组血浆中CK、CK-MB水平降低(P<0.01)。与假手术组相比,RIR组CK、CK-MB水平升高(P<0.01)。血浆BUN和Scr水平经过再灌注后升高,尤以RIR组与假手术组相比升高的更明显(P<0.01),见表1。
2.3 HIF-1α,VEGF和CXCL10 mRNA的表达水平
RIR组HIF-1α和VEGF mRNA的表达水平高于假手术组(P<0.05),雷帕霉素处理组HIF-1α和VEGF mRNA的表达水平低于RIR组(P<0.05)。RIR组中CXCL10 mRNA的表达水平低于假手术组(P<0.05),雷帕霉素处理组高于RIR组(P<0.05),见表2。
2.4 NKT细胞百分比
RIR组脾中NKT细胞的百分比低于假手术组(P<0.05),雷帕霉素处理组脾中NKT细胞的百分比显著低于RIR组(P<0.01)。心脏和外周血中NKT细胞的百分比RIR组高于假手术组(P<0.05),并且雷帕霉素处理组显著高于RIR组(P<0.01),见图1。
2.5 心肌组织形态学变化
空白组和假手术组大鼠的心肌细胞大小、形态均正常。RIR组:心肌纤维紊乱,间质肿胀,炎性细胞浸润。雷帕霉素处理组:心肌纤维排列尚整齐,间质肿胀和炎性细胞浸润程度较RIR组有所减轻,见图2。
3 讨论
肾缺血再灌注损伤是肾血液不足,恢复血液循环灌注后其功能损伤反而加重,组织结构无法恢复正常的一种病理生理状态。炎性细胞因子和氧自由基除对肾本身造成损伤外[4-6],还对心脏、肺、肝等远隔器官造成损伤,尤其是需氧、需血量极大的心脏。在肾缺血再灌注到心肌损害过程,免疫反应是重要反应之一。缺血再灌注损伤作为一个非免疫性因素能通过免疫机制影响心脏的损伤程度[7]。
雷帕霉素是一种新型免疫抑制剂,可通过受体FK50结合蛋白-12与靶蛋白(mTOR)结合,抑制其信号转导,从而减少晚期G1期免疫细胞的停滞,抑制免疫应答。免疫抑制剂可以通过抑制炎症反应从而减轻缺血再灌注后对组织器官的损害[8]。据报道雷帕霉素经过非直接通路方式使激活的T细胞凋亡,通过阻碍抗原呈递过,抑制DC细胞成熟,使细胞因子的分泌减少,阻止DC在心肌组织迁移集聚,可以明显改善大鼠RIR后心脏的结构和生理功能[9]。
表1 各组血浆中CK,CK-MB,BUN和Scr含量变化(±s,n=10)Table 1 Values of CK,CK-MB,BUN and Scr in different groups
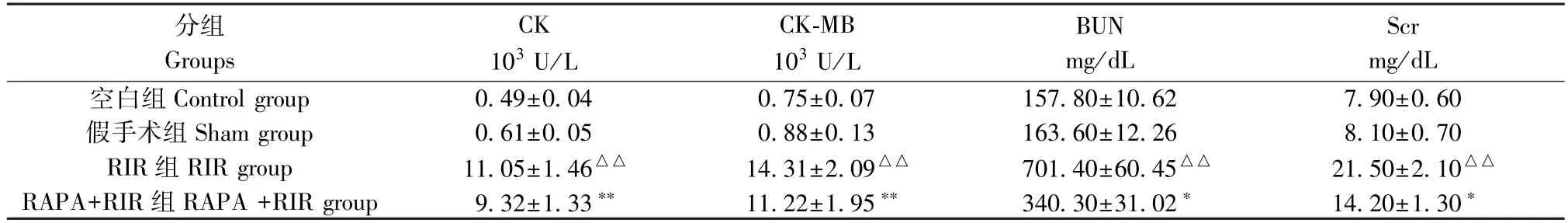
表1 各组血浆中CK,CK-MB,BUN和Scr含量变化(±s,n=10)Table 1 Values of CK,CK-MB,BUN and Scr in different groups
注:与假手术组比,△△P<0.01;与RIR组比,*P<0.05,**P<0.01。Note.Compared with the Sham group,△△P<0.01.Compared with the RIR group,*P<0.05,**P<0.01.
分组Groups CK 103 U/L CK-MB 103 U/L BUN mg/dL Scr mg/dL空白组Control group 0.49±0.04 0.75±0.07 157.80±10.62 7.90±0.60假手术组Sham group 0.61±0.05 0.88±0.13 163.60±12.26 8.10±0.70 RIR组RIR group 11.05±1.46△△ 14.31±2.09△△ 701.40±60.45△△ 21.50±2.10△△RAPA+RIR组RAPA+RIR group 9.32±1.33** 11.22±1.95** 340.30±31.02* 14.20±1.30*
表2 CXCL10、HIF-1α和VEGF mRNA在不同组中的表达水平(±s,n=10)Table 2 Expression levels of CXCL10,HIF-1αand VEGF mRNA in the different groups

表2 CXCL10、HIF-1α和VEGF mRNA在不同组中的表达水平(±s,n=10)Table 2 Expression levels of CXCL10,HIF-1αand VEGF mRNA in the different groups
注:与假手术组对比,△P<0.05;与RIR组对比,*P<0.05。Note.Compared with the Sham group,△P<0.05.Compared with the RIR group,*P<0.05.
组别Groups HIF-1α VEGF CXCL10空白组Control group 0.0115±0.005 0.0159±0.0013 0.4839±0.041 RIR组RIR group 0.0167±0.008△ 0.0201±0.0016△ 0.2753±0.028△RAPA+RIR组RAPA+RIR group 0.0139±0.007* 0.0187±0.0015* 0.3349±0.037*

注:与假手术组相比,△P<0.05;与RIR组相比,**P<0.01。图1 各组小鼠脾、心脏及外周血中NKT细胞百分比Note.Compared with the Sham group,△P<0.05.Compared with the RIR group,**P<0.01.Figure 1 Percentage of NKT cells in spleen,heart and peripheral blood of mice in each group

注:a:空白组;b:假手术组;c:RIR组;d:RAPA+RIR组。图2 四组心肌细胞形态学研究Note.a,Control group.b,Sham group.c,RIR group.d,RAPA+RIR group.Figure 2 Myocardia morphology among four groups
心脏运转过程需氧量大,容易被RIR过程中产生的有害物质所损伤。心肌受损伤时会促进CK、CK-MB等因子释放,其释放量入血越多,心肌病变程度越高。因此,血清心肌酶活性的测定可用来体现心肌细胞损伤程度[10]。氧化应激使细胞膜通透性增强,CK、CK-MB渗出增加,其在血清中的含量大幅度提高[11]。在本研究中,与假手术组比较,RIR组损伤水平显著加剧。与RIR组相比,雷帕霉素处理组损伤程度减轻。该结果与Feng等[12]人在2018年内的研究结果相符,表明雷帕霉素能够减少氧化应激对心肌的损伤、降低心肌细胞膜的通透性,从而起到对RIR致心肌损伤的保护作用。
肾缺血再灌注损伤产生的炎症因子以及低氧诱导因子可导致心肌细胞凋亡。因此推断心肌细胞凋亡可能是导致心肌损伤的原因之一。RIR时心肌细胞凋亡数量显著增高。相较RIR组,雷帕霉素处理组细胞凋亡数量显著减少。该结果显示RIR后心肌组织受损明显,而处理雷帕霉素对RIR后的心肌损伤起保护作用[13]。
趋化因子CXC亚家族,如CXCL10,其特殊作用于NK细胞表面受体。可趋化单核细胞、T淋巴细胞、和自然杀伤(NK)细胞等进入炎症部位,介导缺血后再灌注产生的远隔器官损害[14]。RIR迅速激活机体的免疫系统[15]。在趋化因子的作用下,心肌中集聚的CD4+T细胞逐渐增多。这些趋化因子可能通过正反馈促进自身的分泌,形成有效的浓度梯度,诱导CD4+T细胞的浸润,从而放大这一免疫反应过程。使得心肌组织受损程度增加。结果表明,相比于RIR组,假手术组心肌组织中的CXCL10含量显著增加,雷帕霉素处理组含量升高且差异具有统计学意义,该结果与Zhang等[3]人在2018年的研究结果一致。这说明正常机体CXCL10也有表达,RIR时,机体消耗大量趋化因子来介导CD4+T细胞的活化,导致自身含量的减少。雷帕霉素处理组其含量有所增加,表明机体的免疫反应受到了雷帕霉素的抑制,使得对心肌细胞有损害的CD4+T细胞数量的减少,所需要的趋化因子数量也减少,因此,CXCL10的数量有所上升。这说明在RIR后心肌损伤加重,而雷帕霉素可缓解大鼠心肌受损,发挥对心肌显著的保护作用。
NKT细胞包括CD3和NK1.1双阳性细胞,它是一种免疫细胞,其在TCR受到刺激后1~2 h内被激活,迅速产生多种类型的细胞因子[16-18]。研究表明,NKT细胞在缺血后再灌注导致的损伤过程中扮演重要角色。其中NKT细胞可以通过外周血从脾中募集到靶器官。为保护机体,免疫系统中的NKT细胞可以通过分泌Th2型细胞因子IL-10发挥抑制免疫细胞的作用,降低T细胞在RIR时对心肌细胞的损害作用。由实验结果可知,脾中NKT细胞百分比呈逐渐下降趋势,心脏和外周血NKT细胞百分比呈逐渐上升趋势,差异具有统计学意义,结果与Pan等[19]人在2019年的研究结果一致。这说明,机体在受到炎症反应时,可本能地刺激机体产生免疫反应进行自我保护。RIR对机体造成损害,激发了机体自身的保护机制。RIR后心肌组织损害程度加重,在给予雷帕霉素后,心肌损伤有所好转。可能机制是雷帕霉素上调CXCL表达水平,促进NKT细胞聚集增多,使得外周血和心脏组织NKT细胞的正反馈集聚增加,因此使再灌注后的心肌受损减轻[11]。
缺氧诱导因子-1(HIF-1),是一种调控靶基因、缺氧适应和炎症的转录活性核蛋白。它主要由在细胞中参与生长发育调节的两个亚基构成,HIF-1α主要参与缺氧反应应答;而HIF-1β的功能是稳定细胞内的基因转录表达。HIF-1a对氧浓度敏感,在RIR的条件下,由于机体缺血缺氧,HIF-1α的降解途径阻断(VHL蛋白能识别并与其形成复合物,阻止HIF-1α的降解作用),导致HIF-1α的mRNA含量上调。HIF-1α在中间区域与HIF-1β发生结合,产生异二聚体,正反馈调节VEGF mRNA表达,改善血管通透性[20]。本实验研究显示,VEGF和HIF-1α的表达水平在RIR组和雷帕霉素处理组高于假手术组(P<0.05),雷帕霉素处理组和RIR组相比VEGF和HIF-1αmRNA水平明显降低(P<0.05)。该结果与伊利亚尔等[21]的研究结果一致。说明在RIR后心脏受到损伤,机体启动免疫反应,激活血管新生信号通路,上调HIF-1α的表达,这一过程导致血管内皮细胞增殖,促进心肌供血供氧以对抗RIR后心肌损伤[20-22]。而雷帕霉素给药干预后,其药物可以使乳酸含量增高,促进无氧代谢活动,短时间弱化心肌需氧量,导致HIF-1αmRNA表达下调。
VEGF mRNA可诱导内皮细胞活性氧自由基生成,在氧化应激中促进细胞凋亡,引起炎症发生[23-24]。白细胞和内皮细胞在炎症因子作用下粘附聚集而发生炎症反应,从而导致微循环障碍。本实验研究显示,相比于假手术组,RIR组的心肌细胞中VEGF mRNA水平显著上调,结果具有统计学意义;与RIR组相比,雷帕霉素处理组VEGF mRNA水平下调,结果具有统计学意义,该结果与Zhang等[3]人在2018年的研究结果一致。雷帕霉素给药后,能够通过抑制mTOR通路,进而抑制HIF-1α表达,最终导致VEGF表达量下降[25]。雷帕霉素对心肌的保护作用,可能与减少VEGFmRNA的表达,从而减少活性氧自由基的生成有关。
综上所述,雷帕霉素可减轻RIR大鼠心肌损伤。作用机制可能与增加NKT细胞数量,抑制HIF-1α和VEGF的表达,上调CXCL10的表达,从而增强RIR后心脏的抗炎、抗凋亡作用有关。
——雷帕霉素

