大鼠胚胎内注射hUCMSCs在肝内存活和肝分化研究
鄢东海,向雪萍,逄永成,谭显庆,郑开恢,田 川,李自安,王 强,庞荣清*
(1.联勤保障部队第九二〇医院细胞生物治疗中心,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,昆明 650032;2.巴东县人民医院,湖北 巴东 444300;3.巴东县中医医院,湖北 巴东 444300)
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUMSCs)易于取材、细胞增殖活性强,具有免疫调节特性等优点,使其成为再生医学和组织工程领域应用十分广泛的细胞源,且在临床可治疗诸多疾病,这或许是细胞治疗[1-2]新时代的开端。但是,植入细胞在体内如何靶向迁移、定向分化等研究还不明确。绿色荧光蛋白(green fluorescent protein,GFP)基因转染标记是常用的体内示踪技术方法,用GFP标记人胎盘来源的间充质干细胞可在体外分化成肝细胞[3]。胚胎期属于个体发育的特殊时期,胚胎期注射hUMSCs能否向肝分化具有重要的意义,可为转化医学提供更充足的理论依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
所用动物为SPF级SD大鼠。2只雄性SD大鼠和5只雌性SD大鼠,体重180~220 g,70~84 d日龄,均购于昆明医科大学[SCXK(滇)K2015-0002],饲养于第九二〇医院屏障系统环境动物实验室[SYXK(军)2017-0052]。经第九二〇医院伦理委员会的批准(2017027),使用实验动物时严格按照3R原则给予人道关怀。
1.1.2 细胞
人脐带间充质干细胞(hUCMSCs)由第九二〇医院细胞生物治疗中心提供。
1.2 主要试剂与仪器
新西兰热灭活小牛血清(商品货号∶26170043)、DMEM/F-12培养基(商品货号∶C11330500BT)和0.25%胰蛋白酶溶液(商品货号∶252000-056)均购自美国Gibico公司;携带GFP基因的慢病毒购自吉满生物公司(商品编号∶GM100101-2);免疫组织化学染色用单抗Rabbitanti-human HNF4α(商品编号∶ab181604)、Rabbitanti-human HNF3β(商品编号∶ab180710)和Rabbitanti-human ALB(商品货号∶ab2073227)均购自英国Abcam公司。Heal Force CO2细胞培养箱购自上海力申科学仪器有限公司;IX 70-121倒置相差显微镜购自Olympus公司;正置荧光显微镜NIKON ECLIPSE C1、成像系统NIKON DS-U3均购自日本尼康公司。
1.3 实验方法
1.3.1 hUCMSCs的GFP转染标记
根据说明书并参照慢病毒转染的技术方法[4]标记hUCMSCs,即将鉴定合格的P3代hUCMSCs转移到175 cm的细胞培养瓶中静置培养24 h后,按转染复数(multiplicity of infection MOI)MOI=50的剂量在每瓶细胞中滴加携带GFP慢病毒液共培养72 h,在荧光倒置显微镜下观察,消化并收集标记的细胞,即GFP-hUCMSCs用于传代培养或悬浮于生理盐水中制成1×107cells/mL的单细胞悬液避光保存备用。
1.3.2 SD大鼠胚胎注射GFP-hUCMSCs
按雄雌比1∶2和1∶3比例合笼,早、中、晚观察雌鼠阴栓情况,发现阴栓计为孕龄0.5 d,并分笼精心喂养,发现阴栓第15天时行胚胎注射。注射方法为切开孕鼠盆腔腹壁,暴露孕鼠“Y”字形双子宫,无菌操作,保持胚胎湿润,透过透明子宫壁给每只胎鼠上腹部快速注射0.1 mL含106个GFP-hUCMSCs。注射相同体积生理盐水的同龄胎鼠作为阴性对照。注射完毕后,分层缝合切口,消毒后将孕鼠单独放在有无菌敷料的鼠笼待其苏醒,精心饲养观察,待胎鼠出生后随机分组实验。
1.3.3 肝组织冰冻切片GFP阳性细胞检测
新生大鼠出生45 d、75 d、120 d时,手术切取少许肝组织。制作冰冻切片,滴加DAPI染色后直接在正置荧光显微镜观察GFP阳性细胞的分布并拍照。
1.3.4 肝组织中人肝细胞特异蛋白免疫组织化学染色分析检测
新生大鼠出生45 d、75 d、120 d时,随机切取适量肝组织,迅速用质量分数4%多聚甲醛固定后制石蜡切片,经脱蜡水化、抗原修复。抗体孵育:一抗孵育(Rabbit-anti-human HNF4α、Rabbit-anti-human HNF3β和Rabbit-anti-human ALB),在湿盒内4℃孵育过夜,PBS缓冲液(0.01 mol/L)漂洗3次;二抗孵育每张滴加抗兔生物素100μL,常温孵育1 h,PBS缓冲液(0.01 mol/L)洗涤3次,每次3 min,每张滴加HRP标记链亲和素50μL,常温孵育10 min。PBS缓冲液(0.01 mol/L)清洗3次,每次3 min,每张滴加DAB显色液50μL,常温孵育10 min,然后用自来水冲洗约10 min,苏木素复染2 min,并加盐酸酒精分化2 s,自来水洗净染液。脱水、透明以及封片,最后用显微镜观察并拍照。
2 结果
2.1 GFP转染标记hUCMSCs
按转染复数MOI=50的剂量,将鉴定合格的P3代细胞与携带GFP慢病毒液共培养72 h。在荧光倒置显微镜下可清楚看到大量贴壁生长的细胞呈现较亮的绿色荧光信号(见图1A),未加入GFP慢病毒液共培养的对照组细胞观察不到绿色荧光表达(见图1B)。
2.2 各组肝中GFP阳性细胞的分布情况
胚胎期注射GFP-hUCMSCs的实验组大鼠肝组织制作冰冻切片,在荧光显微镜下可观察到绿色荧光信号的存在。其中,45 d较多,个别鼠特别多(图2A、2B),75 d减少(图2C),120 d只可见极少量荧光信号(图2D),对照组则观察不到GFP阳性细胞分布(图2E)。

注:A:与GFP慢病毒共培养的hUCMSCs;B:没有共培养的对照hUCMSCs。图1 转染GFP基因标记的hUCMSCsNote.A,hUCMSCs co-cultured with GFP lentivirus.B,Control hUCMSCs without co-culture.Figure 1 Transfection of GFP gene-tagged hUCMSCs

注:A:45 d组1只大鼠GFP阳性分布较多;B:45 d组大鼠GFP阳性分布;C:75 d大鼠GFP阳性分布;D:120 d GFP阳性分布;E:阴性对照组。图2 不同组SD大鼠肝组织冰冻切片内GFP信号观察Note.A,The GFP positive distribution of 1 rat in the 45 d group was more.B,the positive distribution of GFP in the 45 d group.C,the positive distribution of GFP in the 75 d rat.D,120 d GFP positive distribution.E,Negative control group.Figure 2 Observation of GFP signal in frozen sections of liver tissue of SD rats in different groups
2.3 各组肝中人肝细胞相关蛋白的检测情况
取各组大鼠肝组织制作石蜡切片,抗原修复,应用免疫组化法,观察人ALB、HNF4α和HNF3β蛋白表达情况显示相关蛋白表达随机分布,血管周围有相对分布较多的趋势。如图∶实验组大鼠肝组织可检测到人ALB(见图3)、HNF4α(见图4)和HNF3β(见图5)蛋白的表达,对照组大鼠肝组织未检测到这些蛋白的表达(见图3、4、5D)。出生45 d大鼠肝内ALB、HNF4α和HNF3β蛋白的表达量总体较多,出生75 d的表达量总体较少,出生120 d的表达极少、甚至检测不到ALB、HNF4α和HNF3β蛋白的表达。同预期结果,对照组大鼠肝组织未检测到这些人源蛋白的表达。如图中箭头所示,棕黄色或褐色为相关蛋白阳性表达。
3 讨论
嵌合现象在自然界广泛存在,而在早期胚胎中更为普遍。接受骨髓移植的患者体内存在供受体来源细胞相互移居长期共存的嵌合现象[5-6]。胚胎期注射有助于嵌合体的形成和植入细胞的分化,国内外科学家应用胚胎注射法成功建立了人-绵羊造血干细胞嵌合体模型[7]和人-山羊肝嵌合体模型[8]。建立大型动物嵌合体模型的操作复杂,设备要求较高,如何在生理条件下建立可靠易行的技术方法和动物模型势在必行。本研究首次探索运用大鼠胚胎发育期免疫系统不成熟的自然条件,研究建立人-鼠嵌合体肝的可行性。
UCMSC在分化潜能[9-10]、免疫原性、来源、伦理问题等方面都有独特的优势,已成为再生医学研究领域重要的种子细胞。选择hUCMSCs构建模型,有利于hUCMSCs在治疗人类疾病中的应用,从而为转化医学提供更多理论支持。携带绿色荧光蛋白(GFP)慢病毒载体液标记细胞的方法追踪细胞[3,11]在动物体内的分布简便易行,GFP标记高效、无毒副作用,时间较长,便于观察,是一种良好的干细胞标记技术。组织制作冰冻切片,在荧光显微镜下直接观察绿色荧光信号的分布从而检测植入已标记细胞的分布。本实验用携带GFP的慢病毒载体液转染标记hUCMSCs(即GFP-hUCMSCs),便于追踪人源细胞在肝内的分布。
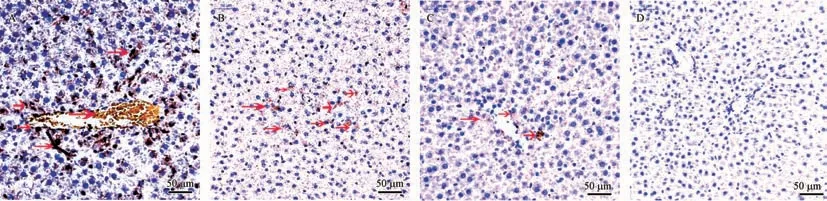
注:A:45 d大鼠肝内人ALB较多广泛表达;B:75 d大鼠肝内ALB零星较少表达;C:120 d大鼠肝内人ALB微弱表达;D:阴性对照。红色箭头显示ALB表达。图3 不同组SD大鼠肝组织中人ALB蛋白免疫组织化学染色分析Note.A,45 d of intrahepatic human ALB is more widely expressed.B,75 d of intrahepatic ALB sporadic expression is less.C,120 d of intrahepatic ALB is weak Expression.D,Negative control.Red arrows show ALB expression.Figure 3 Immunohistochemical staining analysis of human ALB protein in liver tissues of SD rats of different groups
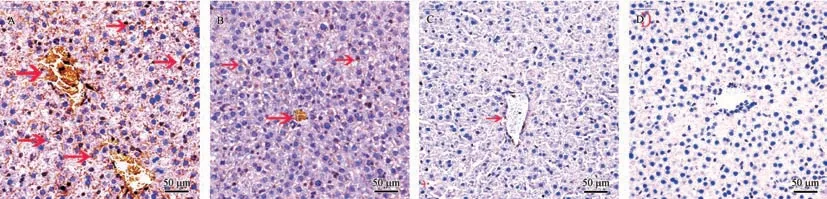
注:A:45 d大鼠肝内人HNF3β的分布较多;B:大多75 d大鼠肝内人HNF3β表达量较低;C:多数120 d大鼠肝内检测不到人HNF3β表达;D:阴性对照。红色箭头显示HNF3β表达。图5 不同组SD大鼠肝组织中人HNF3β蛋白免疫组织化学染色分析Note.A,The distribution of HNF3βin the liver of rats was more than 45 d.B,the expression of HNF3βin the liver of rats was lower in most of the 75 d.C,the liver of most 120 d human HNF3βexpression was not detected.D,Negative control.Red arrows show HNF3βexpression.Figure 5 Immunohistochemical staining analysis of human HNF3βprotein in liver tissues of SD rats of different groups
干细胞在动物模型体内存活和分化是模型成功与否的关键。冰冻切片发现实验组大鼠肝组织中45 d绿色荧光信号较多,75 d的明显减少,120 d时只可观察到极少量荧光信号的存在;对照组肝组织中未检测到绿色荧光信号。从而证明胚胎期注射的GFP-hUCMSCs可迁移到肝组织。肝富集转录因子(liver-enriched transcription factors)主要存在于肝并调控肝特异性基因的表达,在调控器官发育时发挥关键作用,促进肝代谢[12],其中HNF3β调控HNF4α等转录因子在内的许多基因的转录,而HNF4α属二聚体转录因子,是一种锌指结构蛋白,可控制多达60%的肝基因[13],是肝特异性基因表达的主要调节因子。且HNF4α过表达的肝祖细胞可作为细胞移植的最佳候选者[14]。HNF4α在成熟肝细胞中的表达量最高,对肝细胞分化的调控、肝的形成和肝细胞生物学功能的维护都起重要作用,诸如肝癌等[14]许多肝疾病与HNF4α表达量的异常有关。白蛋白(ALB)主要存在于血浆中,大多在肝内合成并分泌,常作为鉴定肝细胞功能正常与否的经典指标。采用免疫组化染色分析法,在出生45、75 d的实验组大鼠肝中可检测到人HNF3β、HNF4α和ALB蛋白的表达,出生120 d的大鼠只能检测到人源相关蛋白的微弱表达甚至完全检测不到。从而证明植入细胞在大鼠肝体内得到进一步分化的机会。
综上所述可知胚胎期注射GFP-hUCMSCs能够迁移到胎鼠肝,在胎鼠出生后的肝内存活并在至少45 d时间内得到进一步生长发育的机会,同时形成两种来源细胞相互共存的嵌合状态。但随着大鼠出生时间的延长,人源细胞数量明显减少,从侧面说明人源细胞在两种细胞生存竞争中很快处于不利地位,这可能与大鼠免疫系统的发育和植入细胞的分化有关,但其具体的调控机制有待于进一步深入研究。

