硫化氢通过抑制蛋白激酶B过度磷酸化延缓内皮细胞衰老*
宋志明,余舒杰,焦 洁,杨美玲,李平平,李方敏,钱孝贤△
(1河南大学第一附属医院心血管内科,河南开封475001;2中山大学附属第三医院心血管内科,广东广州510630)
最新发布的《中国心血管病报告2018》显示,心血管疾病仍是我国城乡居民死亡原因的首位因素,远远高于肿瘤等其它疾病。冠状动脉粥样硬化性心脏病(冠心病)在2002~2016年仍呈持续上升的趋势,仅2017年大陆地区冠心病介入治疗总数就超过了75万例,给患者家庭、社会以及国家社保带来了巨大的经济负担[1]。
血管内皮细胞功能障碍是公认的冠心病发生的始动因素,更是其发展的主要促动因素[2]。研究发现随着年龄的增长,冠心病发病率也逐渐增加,证实了与增龄相关的内皮细胞衰老促进了血管事件的发生。因此,如何逆转或减轻内皮细胞衰老成为治疗动脉粥样硬化的一个临床难点,也成为冠心病防治的一个关键点。
硫化氢(hydrogen sulfide,H2S)是继CO和NO后在人体内发现的第3个气体信号分子。新近的大量研究也已证实了它在维持心血管系统功能中发挥了重要作用[3-4]。本研究旨在观察外源性H2S对H2O2诱导的内皮细胞衰老的作用,并进一步探讨其可能的作用机制。
材料和方法
1 材料
H2O2、MTT、NaHS和DMSO购自Sigma-Aldrich;Ⅰ型胶原酶购自Invitrogen;无血清培养基(serum free medium,SFM)、M199培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco;内皮细胞生长添加剂购自BD;预染蛋白条带标志物购自Fermentas;抗Akt抗体、抗磷酸化Akt(p-Akt)抗体购自Cell Signaling Technology;抗血浆纤溶酶原激活物抑制剂1(plasminogen activator inhibitor 1,PAI-1)抗体购自 Santa Cruz;抗GAPDH内参照抗体购自Proteintech;抗小鼠及兔Ⅱ抗购自武汉博士德;衰老染色试剂盒购自碧云天生物技术有限公司;细胞裂解液和蛋白定量(BCA法)试剂盒购自南京凯基。
2 方法
2.1 细胞的分离培养 本研究采用原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)进行实验,其分离培养参见既往文献报道[4-5]。若无特殊交代,研究所用细胞均为1~3代。本研究经河南大学第一附属医院医学伦理委员会批准,符合Helsinki原则。相差倒置显微镜下,HUVECs贴壁单层生长,呈短梭状或铺路石样排列,细胞为扁平多角形,边界清楚,胞浆丰富。本实验对分离培养的第1代内皮细胞标志分子CD31进行了流式细胞法测定。结果显示,细胞CD31阳性率为99.9%。
2.2 内皮细胞衰老模型的建立 内皮细胞在6孔板内生长至70%时,加入60 μmol/L的H2O2培养1 h[6],此后换成正常培养基继续培养24 h。通过衰老相关β半乳糖苷酶(senescence associated β-galactosidase staining,SA-β-Gal)染色和衰老标志物PAI-1的检测判断模型成功与否。衰老相关β半乳糖苷酶染色参照既往方法进行[6]。PAI-1的检测方法参见Western blot部分。
2.3 Western blot实验 蛋白提取过程参照既往研究[4],每孔加 50~60 μL 细胞裂解液,放于冰上孵育15 min,将细胞裂解物转入1.5 mL离心管,13 200 r/min、4oC离心15 min;吸取上清,分装保存于-80oC冰箱备用。蛋白经BCA定量,总蛋白进行SDSPAGE,转移到NC膜上。用5%脱脂奶粉室温封闭1 h后,加入相应抗体,4oC摇床上过夜孵育;弃去Ⅰ抗,1×TBST洗3次,加入抗小鼠或兔Ⅱ抗,室温孵育1 h后,TBST洗3次,ECL显影,最后用Quantity One软件分析蛋白条带。
3 统计学处理
通过SPSS 19.0统计软件进行分析,计量资料用均数±标准差(mean±SD)表示。均数间比较采用t检验或单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 H2O2诱导的HUVECs衰老模型
内皮细胞生长至70%时,加入60 μmol/L的H2O2培养1 h,换液后继续培养24 h。结果发现与空白对照组相比H2O2组的细胞生长缓慢,形态扁平,PAI-1蛋白表达大幅度增加,SA-β-Gal染色阳性细胞增加(P<0.05),见图1。
2 NaHS对H2O2诱导的内皮细胞衰老的影响
我们前期研究发现,100 μmol/L NaHS能够明显延缓高糖诱导的内皮细胞衰老[4-5]。因此,在本课题中我们继续选用100 μmol/L NaHS进行研究。当内皮细胞生长至60%时给予NaHS预处理1 h,之后再用H2O2诱导细胞衰老。结果发现,与H2O2组相比,NaHS组PAI-1的表达明显降低,SA-β-Gal阳性细胞的比例也显著减少(P<0.05),见图2。
3 NaHS对于衰老内皮细胞Akt磷酸化的影响
细胞衰老的过程是借由信号转导通路实现的,而且不只是一种途径,其中Akt起到了重要作用。因此,我们对内皮细胞衰老诱导过程中不同时点Akt的活性进行了检测。Western blot检测结果提示,Akt的磷酸化水平在衰老诱导过程中较基础水平持续升高,其中H2O2处理3 h后的磷酸化水平最高,见图3。

Figure 1.Premature senescence was induced by H2O2(60 μmol/L)treatment.A:the results of Western blot for determining protein level of PAI-1;B:the ratio of SA-β-Gal positive cells was calculated on 400 cells per group.Senescent cells were stained with blue color(×100).Mean±SD.n=3~4.*P<0.05 vs control group.图1 H2O2诱导的早熟型衰老模型鉴定

Figure 2.The effect of NaHS(100 μmol/L)on H2O2(60 μmol/L)-induced senescence in HUVECs.A:the results of Western blot for determining the protein levels of PAI-1;B:the ratio of SA-β-Gal positive cells was calculated on 400 cells per group(×100).Mean±SD.n=3~4.*P<0.05 vs control group;#P<0.05 vs H2O2group.图2 NaHS对H2O2诱导的内皮细胞衰老的影响
我们进一步采用NaHS预处理1 h、H2O2处理3 h的细胞模型来检测内皮细胞Akt的磷酸化水平,从而探究NaHS是否通过调节Akt活性而减轻内皮细胞衰老,结果提示,NaHS能够降低H2O2诱导的Akt磷酸化水平,见图3。
4 抑制Akt磷酸化对于H2O2诱导内皮细胞衰老的影响
为明确Akt磷酸化在H2O2诱导的内皮细胞衰老中的作用,我们运用PI3K/Akt特异性抑制剂LY294002进行研究。首先,我们检测不同浓度的LY294002及H2O2处理细胞3 h后Akt磷酸化程度,发现10 μmol/L、30 μmol/L及50 μmol/L LY294002均可明显抑制Akt磷酸化,见图4A。此后的研究我们选用 30 μmol/L LY294002 浓度。与 H2O2组比较,30 μmol/L LY294002组SA-β-Gal染色阳性细胞比例显著下降,PAI-1蛋白表达明显减 少(P<0.05),见图4。
讨 论
本研究发现在H2O2诱导内皮细胞衰老中,Akt活性较基础水平持续升高;而NaHS能够通过抑制Akt的活化而部分延缓内皮细胞衰老。
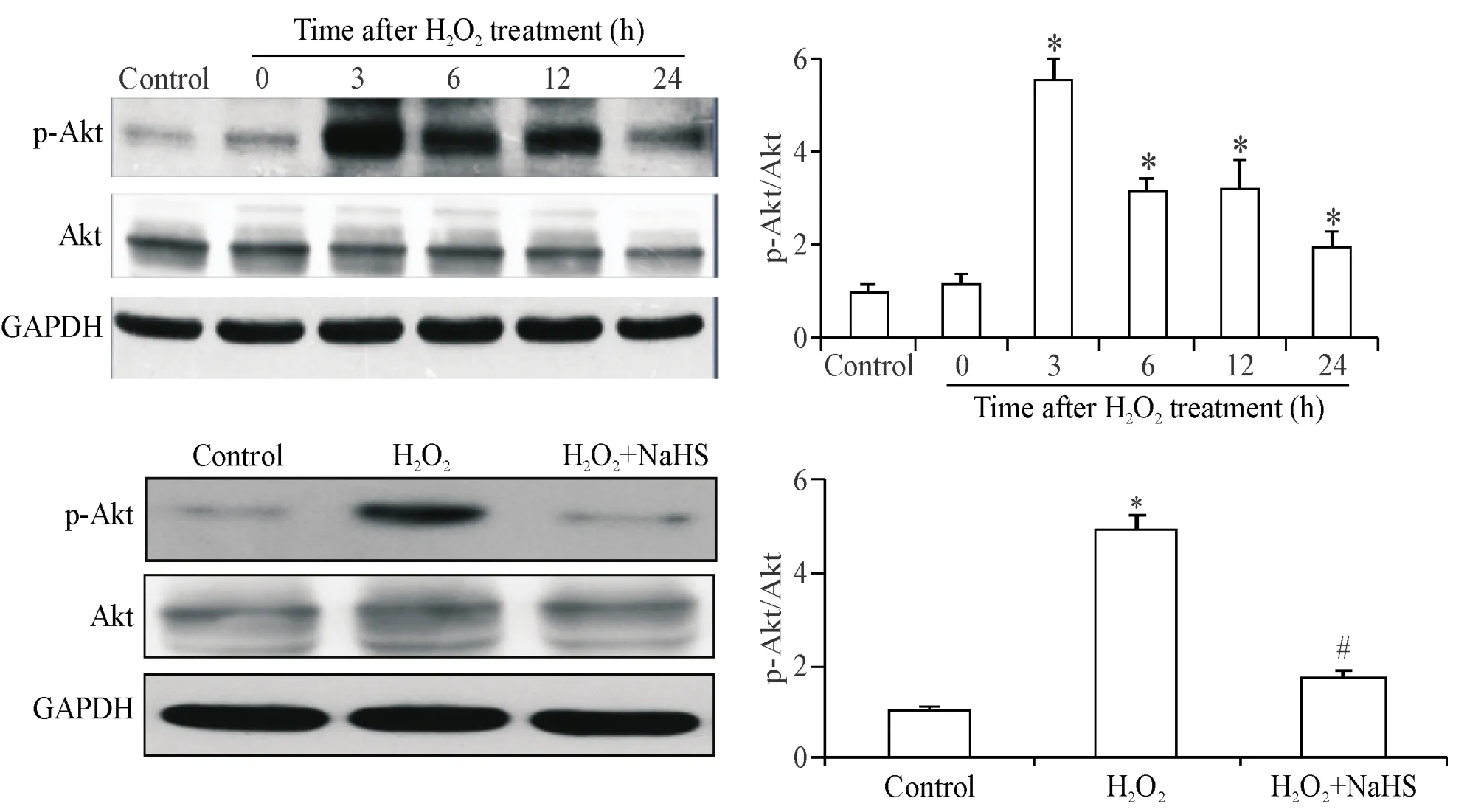
Figure 3.The phosphorylation of Akt treated with H2O2(60 μmol/L )in different time points or pretreatment of NaHS(100 μmol/L)in HUVECs.Mean±SD.n=3~4.*P<0.05 vs control group;#P<0.05 vs H2O2group.图3 内皮细胞衰老过程中Akt磷酸化水平变化及NaHS对其的影响

Figure 4.The effect of LY294002 on senescence in HUVECs.A:dose-dependent inhibition of Akt activation by LY294002;B:the ratio of SA-β-Gal positive cells was calculated on 400 cells per group((×100);C:the results of Western blot for determining the protein levels of PAI-1 and normalized analysis of the intensity.Mean±SD.n=3~4.*P<0.05 vs control group;#P<0.05 vs H2O2group.图4 LY294002对H2O2诱导的内皮细胞衰老的影响
越来越多的研究证实,内皮细胞衰老是冠状动脉粥样硬化发病的重要因素,它启动并参与了其发生和发展整个过程[7]。首先,衰老细胞通过分泌相关细胞因子和表面受体介导单核细胞进入细胞壁从而促发斑块形成;衰老的内皮细胞更倾向于凋亡,导致内膜功能受损,这样氧化性低密度脂蛋白就能进入血管壁。然后,衰老细胞分泌的细胞因子如单核细胞趋化因子和白细胞介素参与斑块的进展。最后,衰老细胞诱发斑块的不稳定或形成易损斑块,从而造成急性心血管事件的发生。
内皮细胞衰老分为复制性衰老和早熟型衰老。许多的刺激因素,如过氧化氢、高糖、高脂等均可以诱导内皮细胞早熟型衰老[4-6]。本研究中采用60 μmol/L H2O2诱导细胞衰老,模型成熟、稳定[6]。同时,运用原代人脐静脉内皮细胞作为研究对象,更贴近人体生理环境。
蛋白激酶B,又称为Akt,在细胞存活和凋亡中起重要作用。Akt增加细胞活性氧簇的产生,同时抑制细胞内活性氧簇的清除,进而促进或加速复制性及早熟型衰老。内皮细胞相关研究中,降低Akt磷酸化能够通过P53/P21途径延长细胞寿命[8]。有研究发现,12周高脂饮食可诱导小鼠血管衰老,而这与持续活化的Akt有关,而Akt基因敲除的小鼠血管衰老程度明显减轻[9]。在另外的研究中发现,内皮细胞衰老过程中Akt活性增高,但是进一步提高其活性也能够延缓衰老,考虑其能增强内皮型一氧化氮合酶活性有关[10]。与此前研究结果一致,我们的研究也发现在H2O2诱导内皮细胞衰老过程中,Akt的活性较基础水平持续升高,而应用LY294002预处理特异性抑制Akt活性能延缓细胞衰老。
H2S是人体内发现的第3种内源性气体信号分子。在我们前期的研究中已经证实,它能够延缓高糖诱导的内皮细胞衰老[4-5]。已有研究报道提示外源性H2S通过Sirt1通路部分逆转过氧化氢诱导的内皮细胞衰老[11]。本研究证实H2S可以抑制Akt的活化,延缓内皮细胞衰老。
本研究结果提示,H2S能通过抑制Akt活化,部分性抵抗H2O2诱导的HUVECs衰老。Akt活性的调节或许可成为防治年龄相关性心血管疾病的治疗靶点。

