乙酰唑胺治疗慢性高原病的疗效与安全性的Meta分析
郝玉姣,高飞燕,孙琳,张元元
大理大学临床医学院内科,云南 大理 671000
目前世界上约有1.4亿人群生活在高海拔地区(海拔>2 500 m)[1]。高海拔地区人群有1.2%~33%发生慢性高原病(chronic mountain sickness,CMS)[2]。CMS是高海拔居民容易发生的一组临床综合征,以过度增生的血红蛋白及严重的缺氧为特点。红细胞过度增生,导致血液黏稠度增加、血流缓慢,血容量增多,加重缺血缺氧、微循环障碍,影响组织器官,造成全身多器官多系统损害。容易出现头晕、头痛、呼吸困难、心悸、睡眠障碍等症状,易发生中风、心肌缺血等。流行病学调查显示CMS 的发病率在世界上不同海拔地区差异较大,随着海拔的升高发病率增加[3]。同一海拔地区其发病率与民族[1]、人群[4]、年龄[2]、性别[5]有关。乙酰唑胺(Acetazolamide,ACZ)通过抑制CO2水合反应,减少HCO3-重吸收,升高的H+和CO2刺激颈动脉化学感受器进而使呼吸加深加快,可促进气体交换,提高血氧饱和度,可降低红细胞数量,改善肺循环,有利于改善缺氧。一直以来ACZ主要用来治疗急性高原病及高原性脑水肿,是唯一被美国食物药品管理局(FDA)批准用于防治急性高原病的药物。近年来也有报道运用ACZ治疗慢性高原病,但是长期运用其疗效如何;是否会对其他脏器及身体产生影响还有争议。本研究通过Meta分析,系统评价ACZ治疗慢性高原病的疗效与安全性。为临床提供真实可靠的ACZ治疗慢性高原病的循证依据。
1 资料与方法
1.1 文献检索策略 计算机检索PubMed、EMbase、The Cochrane Library、中国知网、维普数据库和万方数据库,查找关于ACZ治疗慢性高原病的临床研究文献,中文检索词为“慢性高原病/慢性高山病/高原红细胞增多症”、“ACZ/碳酸酐酶/碳酸脱水酶/醋酸磺胺”,英文检索词为“Polycythemia/Erythrocytosis/HAPC/Altitude Sickness/Altitude Hypoxia”、“Monge’sdisease/Chronic mountain sicknes”、“Acetazolamide/Acetazolam/Acetazolamide Sodium/Acetazolamid,Monosodium Salt/AkZol/Apo-Acetazolamide/Diacarb/Diamox/Diuramide/Edemox/Glauconox/Glaupax/Huma-Zolamide/Acetadiazol”、“trials/clinical trials”,检索时限从数据库建库起至2019年12月。
1.2 纳入和排除标准 纳入标准:(1)研究对象为居住在海拔2 500 m以上的人群,男性血红蛋白(Hb)≥21 g/dL、女性Hb≥19 g/dL 为标准[6],研究对象资料完整。(2)干预措施为各研究实验组采用ACZ治疗,干预开始时间、干预剂量、干预时间与疗程、随访时间无限制。(3)对照组采用安慰剂对照或其他药物对照治疗,干预剂量、干预时间与疗程、随访时间无限制。(4)结局指标:①临床指标—CMS 评分(CMS score),见表1;②血液指标—红细胞压积(Hematocrit,HCT)、氧分压(oxygen partial pressure,PO2)、二氧化碳分压(partial pressure of carbon dioxide,PCO2);③不良反应。(5)研究类型为随机对照研究(randomized controlled trial,RCTs)。排除标准:(1)有以下疾病患者,①慢性阻塞性肺病、肺心病、支气管炎、支气管扩张、肺间质纤维化、肺癌;②慢性呼吸功能紊乱、睡眠呼吸暂停综合征和其他系统慢性病变而引起的继发性红细胞增多症;③真性红细胞增多症。(2)文献数据不全或缺失、重复发表的文献。(3)综述、病例报道、评论、信件等文献。(4)动物、体外实验等研究。

表1 CMS评分
1.3 文献筛选 由两位研究者独立进行筛选,首先将检索到的文献导入EndNote 中进行文献查重,去除重复文献,然后阅读题目及摘要排除明显不相关的文献,剩下相关文献下载全文,详细阅读后根据纳入及排除标准进行排除不相关文献。筛选过程中产生分歧,则讨论后由第三方决定。
1.4 文献质量评价 采用Cochrane偏倚风险评价工具[7]对纳入随机对照研究进行文献质量评价,评价的内容包括随机分配方法、分配方案隐藏、盲法、结果数据的完整性、选择性报告研究结果、其他偏倚来源等。
1.5 数据提取 由两名研究员独立提取数据、转换数据,若产生分歧,经讨论后由第三方决定。(1)干预前后相关数据提取(表2);(2)文献作者、发表时间、研究类型、样本量、失访人数;(3)人群:年龄、CMS评分、生活海拔高度;(4)干预措施:实验组用药剂量、用药类型、用药时间,对照组用药剂量、用药类型、用药时间;(5)结局指标:HCT、PO2、PCO2、CMS 评分及用药副作用。用Excel表将提取数据进行归类及整理。
1.6 统计学方法 采用RevMan 5.3 软件对研究数据进行统计学分析,对资料进行计算加权均数差(weighted mean difference,WMD)及95%可信区间(confidence interval,CI),P<0.05为差异有统计学意义,并绘制森林图。用I2判断异质性大小,若I2<50%,各研究结果间无明显统计学异质性,采用固定效应模型;若I2>50%,则采用随机效应模型。
2 结果
2.1 文献检索及纳入情况 初步检索共获得相关文献301 篇,采用EndNote 软件查重后剩余188 篇;经过阅读题目、摘要后排除相关文献后剩余27 篇;经过阅读全文,按照纳入、排除标准,最终纳入Meta分析的文献4篇[8-11](4篇英文文献)检索如图1所示。
2.2 纳入研究的一般情况 纳入研究的4 篇文献均为随机对照研究,共纳入147 例CMS 患者,其中实验组82例,对照组65例,相关药物的治疗时间为3~12 周,实验组为ACZ 250 mg,对照组为安慰剂或ACZ 500 mg。纳入的一般情况如表2 所示。
2.3 文献质量评价结果 纳入4 篇文献均为中高质量,评价结果如图2所示。
2.4 Meta分析结果
2.4.1 ACZ 250 mg 组与安慰剂组治疗慢性高原病患者对PO2的影响 ACZ 250 mg 与安慰剂对照各组间异质性小(I2=9%,I2<50%),提高PO2疗效明显,与安慰剂组比较差异有统计学意义(P<0.01),见图3。
2.4.2 ACZ 250 mg 组与安慰剂组治疗慢性高原病患者对PCO2的影响 ACZ 250 mg 与安慰剂对照各组间异质性小(I2=0%,I2<50%),降低PCO2疗效显著,与安慰剂组比较差异具有统计学意义(P<0.01),见图4。
2.4.3 ACZ250 mg 组与安慰剂组治疗慢性高原病患者对HCT的影响 ACZ 250 mg与安慰剂对照各组间异质性小(I2=0%,I2<50%),降低HCT疗效显著,与安慰剂组比较差异有统计学意义(P<0.01),见图5。
2.4.4 ACZ 250 mg 组与安慰剂组治疗慢性高原病患者对CMS评分的影响 ACZ 250 mg与安慰剂对比,在降低CMS 评分方面比较差异无统计学意义(P>0.05)。但各组间异质性大(I2=86%,I2>50%),如图6。逐个去除单个研究后行敏感性分析示,Shailendra Sharma 2017为异质性最大的研究,去除后总体异质性下降(I2=45%,I2<50%),结果保持不变(P=0.17,P>0.05),见图7、8、9。

图1 文献检索流程图

表2 纳入研究的一般情况

图2 纳入研究文献质量评价结果

图3 ACZ 250 mg对比安慰剂提高PO2疗效的Meta分析

图4 ACZ 250 mg对比安慰剂降低PCO2疗效的Meta分析

图5 ACZ 250 mg对比安慰剂降低HCT疗效的Meta分析

图6 ACZ 250 mg对比安慰剂降低CMS评分疗效的Meta分析
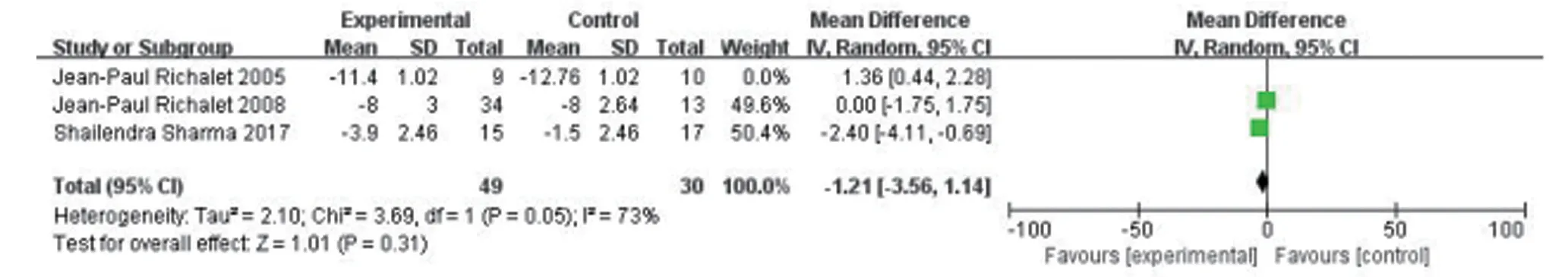
图7 ACZ 250 mg对比安慰剂去除Jean-Paul Richalet 2005研究后敏感性分析

图8 ACZ 250 mg对比安慰剂去除Jean-Paul Richalet 2008研究后敏感性分析

图9 ACZ 250 mg对比安慰剂去除Shailendra Sharma 2017研究后敏感性分析
2.4.5 ACZ 250 mg组与ACZ 500 mg组治疗慢性高原病患者对PO2的影响 ACZ 250 mg与ACZ 500 mg对比,在提高PO2方面差异无统计学意义(P=0.73,P>0.05),但各组间异质性大(I2=83%,I2>50%),见图10。逐个去除单个研究后行敏感性分析示,Jean-Paul Richalet 2005为异质性最大的研究,去除后,差异具有统计学意义[95%CI:-1.50(-2.45~-0.55),P=0.002],见图11、图12。
2.4.6 ACZ 250 mg组对比ACZ 500 mg治疗慢性高原病患者对于PCO2的影响 ACZ 250 mg 与ACZ 500 mg 对比,降低PCO2差异无统计学意义(P=0.09,P>0.05),各组间无明显异质性(I2=5%,I2<50%),见图13。
2.5 安全性 纳入的文献中,其中3篇[8,10-11]文献中提及治疗的不良反应,包括多尿、感觉异常、气态饮料味觉异常、头痛、烧心、血钾降低等,见表3。

图10 ACZ 250 mg对比ACZ 500 mg提高PO2疗效的Meta分析

图11 ACZ 250 mg对比ACZ 500 mg去除Jean-Paul Richalet 2005研究后敏感性分析

图12 ACZ 250 mg对比ACZ 500 mg去除Maria Rivera Ch 2008研究后敏感性分析

图13 ACZ 250 mg对比ACZ 500 mg降低PCO2疗效的Meta分析

表3 ACZ 250 mg、ACZ 500 mg及安慰剂治疗CMS的不良反应
3 讨论
慢性高原病是指长期处于高海拔地区,低氧导致红细胞代偿性过度增生,引起以高黏滞综合征为主的疾病,常继发肺源性心脏病、充血性心力衰竭等,是高原地区的常见病、多发病,严重危害着高原地区居民的身体健康。多种危险因素诱发该病的发生,可能与民族、年龄、性别及海拔高度有关。慢性高原病的发病机制较为复杂,主要包括人群的慢性缺氧暴露[12]和遗传易感性[13-15]。临床上主要表现为各器官供氧减少引起运动耐量下降,包括头痛、头晕、气短、胸闷、腹胀、腹痛、乏力、关节痛、厌食、消瘦、记忆力减退、失眠、手足麻木或胀痛感等[16]。患者容易引发凝血功能紊乱[17],出现鼻出血、牙龈出血、皮肤黏膜出血点或瘀斑等[18]。长此以往会引起血压增高、心脏功能减退、肺动脉高压等临床症状。
ACZ是一种碳酸酐酶抑制剂,服用后抑制肾小管上皮细胞中的碳酸酐酶,使HCO3-的重吸收减少,H+升高,引起体内代谢性酸中毒,以致兴奋呼吸中枢,增加肺通气量,从而增加氧分压、氧饱和度,降低二氧化碳分压[19]。近来研究表明,ACZ 可以降低红细胞容积、血清中促红细胞生成素(Erythropoietin,EPO)、血清转铁蛋白,并且可以提高氧分压及血清铁蛋白浓度,增加通气量和改善睡眠呼吸暂停,增加动脉血氧饱和度[10],对慢性高原病有一定疗效。本研究纳入文献研究了ACZ 250 mg与安慰剂对照治疗慢性高原病的疗效,对于改善患者通气,降低HCT、PCO2,提高PO2疗效肯定。
本研究纳入文献比较了ACZ 250 mg 与ACZ 500 mg 治疗慢性高原病的疗效,两者均可提升PO2,降低PCO2,疗效显著。但ACZ 250 mg与ACZ 500 mg对比,在降低PCO2及增加PO2方面差异均无统计学意义(P>0.05),但是研究存在异质性,进行敏感性分析,去除异质性大的文献Jean-Paul Richalet 2005 研究后,两者对比在增加PO2上差异有统计学意义(P<0.05),说明ACZ 500 mg 对比ACZ 250 mg 提高PO2更有疗效,但是纳入研究中进行剂量对比的样本量少,需要更多随机研究进一步验证不同剂量ACZ 治疗CMS 的效果。纳入研究中,不良反应最多见的为多尿、感觉异常、烧心、头痛等。最常见不良反应为多尿。考虑ACZ本身就是一种弱的利尿剂,慢性高原病患者本身血容量增多,心脏负荷大,也会出现多尿来减少血容量,减轻心脏负荷。患者服用期间未因多尿出现电解自紊乱及其他器官损坏反应。其次部分患者有感觉异常、烧心、头痛等反应。考虑由于此疾病长期缺氧,血液黏度大,亦会出现感觉异常、头痛等症状,且服用安慰剂的对照组也有出现上述反应,考虑此不良反应可能与原发病有关,需进一步观察。总的来说,慢性高原病患者在长达3周~3个月服用ACZ期间,与对照组相比,没有出现明显不良反应,没有证据证实其对其他组织器官有损害,服用相对安全。
本研究纳入的文献,虽然文献质量较高,但是文献数量略少,今后仍需要更多高质量、多样本、多中心的随机研究进一步验证ACZ治疗CMS的的效果及安全性。本次研究检索文献时语种限制为中文和英文,可能存在检索时漏检其他语种发表的相符研究,造成语言及发表偏倚。目前世界上1.4亿的高海拔人群主要集中在青藏高原、埃塞俄比亚高原和南美安第斯山脉等区域[1],本研究人群均在秘鲁地区,为避免研究群体过于单一,今后需要更多各个高海拔地区群体的研究为临床决策提供更有利的证据。
综上所述,ACZ 250 mg 治疗慢性高原病疗效明显,可明显提高PO2,降低PCO2、HCT。ACZ 250 mg与ACZ 500 mg对比治疗慢性高原病降低PCO2无明显差异,在提高PO2方面ACZ 500 mg相比更有疗效。ACZ治疗慢性高原病的安全性可靠。

