急性升温胁迫与恢复对葛氏鲈塘鳢抗氧化酶活性的影响
王博雅,郭 策,黄璞祎,柴龙会
( 东北林业大学 野生动物与自然保护地学院,黑龙江 哈尔滨 150040 )
葛氏鲈塘鳢(Perccottusglenii)为鲈形目、沙塘鳢科、鲈塘鳢属鱼类,在我国主要分布于黑龙江、辽河、图们江等地区,具有广温性、耐缺氧等特点。近年来,由于过度捕捞、水质污染及生态环境变化等原因,葛氏鲈塘鳢的自然资源量下降。目前,关于葛氏鲈塘鳢的研究刚刚起步,仅局限于养殖、人工繁殖、抗药性等方面[1-3],而关于温度对葛氏鲈塘鳢抗氧化能力影响的研究未见报道。
在全球变暖的背景下,极端天气的变化直接影响鱼类的生存和生长[4]。水温的变化会导致鱼体的多种生理应激反应,使鱼类代谢加速和能量需求增加,同时伴随着活性氧自由基的过量产生[5-6]。活性氧自由基可以氧化DNA、蛋白质和脂质,破坏分子的交联作用,使酶活性降低,最终破坏细胞的完整性[7]。超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶是生物体内主要的抗氧化酶, 在清除自由基和机体免受损伤方面发挥重要作用, 能维持细胞和机体正常的生理活动[8],因此抗氧化酶活性可作为衡量鱼类对外界环境适宜程度的重要生理指标[9]。丙二醛是脂类物质氧化应激的最终产物, 可以反映机体内活性氧自由基含量和氧化应激程度[7]。笔者研究了急性升温胁迫对葛氏鲈塘鳢存活、超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等抗氧化酶活性及丙二醛浓度的影响,旨在探讨急性升温胁迫的适应机制,为葛氏鲈塘鳢开发利用提供基础数据。
1 材料与方法
1.1 材料
2015年9月,葛氏鲈塘鳢用地笼采自哈尔滨道外区民主湿地。鱼体全长(10.15±1.33) cm,体质量(13.41±6.31) g。试验开始前,在实验室暂养14 d。试验容器为80 cm×60 cm×40 cm的玻璃水族箱,配置控温、过滤和充气设配。暂养水温(17±1) ℃,溶解氧水平≥6 mg/L,日换水1/3。每日8:00和16:00各投喂冰冻摇蚊幼虫1次,自然光照周期培养。
1.2 方法
选取规格相近、体表无伤、体质健壮的试验鱼270尾,随机分为3组:对照组、急性升温组和渐变升温组,每组设置3个平行,每个平行30尾,每组90尾。根据葛氏鲈塘鳢自然栖息环境中夏季的水温变化范围,将对照组温度设定为17 ℃,急性升温组和渐变升温组的温度上限设定为31 ℃,温度变幅为±1 ℃。通过加热棒及温控仪控制,急性升温组将试验鱼由17 ℃水族箱直接转入31 ℃水族箱中,渐变升温组的升温速率为1 ℃/d,到达31 ℃时保持水温恒定。试验开始前24 h,停止投喂。
试验开始后,对照组开始时取样1次;急性升温组升温后1、6、12、24 h和恢复(17 ℃)后4 h和24 h共计取样6次;渐变升温组在达到31 ℃持续24 h后取样1次。每组在各时间点取5尾,每个平行随机取样1~2尾。将试验鱼快速在冰盘上处死、解剖,取出肝脏、脑和肌肉置冰箱-80 ℃保存,待测。组织称量质量后,加入生理盐水(1∶9),低温匀浆、离心后得到粗酶液。剩余试验期间各组死亡个体及时取出并记录死亡时间,以鳃盖不运动、镊子触碰尾柄无反应视为死亡。
超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性和丙二醛浓度均采用南京建成生物研究所提供的试剂盒测定。超氧化物歧化酶采用黄嘌呤氧化酶法测定,超氧化物歧化酶活力单位定义:在反应体系中超氧化物歧化酶抑制率达50%时所对应的酶量为1个超氧化物歧化酶活力单位(U);过氧化氢酶活力采用比色法测定,过氧化氢酶活力单位定义:每毫克组织每秒分解 1 μmol 双氧水的量为1个酶活力单位(U);谷胱甘肽过氧化物酶活力检测采用分光光度计比色法,谷胱甘肽过氧化物酶酶活定义:每毫克组织在37 ℃反应5 min,扣除非酶促反应,使反应体系中谷胱甘肽过氧化物酶浓度降低1 μmol/L为1个酶活力单位(U);丙二醛浓度(mmol/mL)采用比色法测定。
1.3 数据处理
数据以平均值±标准差表示,采用Excel和SPSS 17.0软件进行统计分析,应用单因素方差分析(α=0.05)。不同处理组间采用Duncan方法进行多重比较,分析同一组织抗氧化酶活性和丙二醛浓度在对照、急性升温(1、6、12、24 h)、恢复(4、24 h)和渐变中的显著差异。不同处理组间死亡率采用独立样本t检验方法比较。
2 结 果
2.1 不同温度处理组的葛氏鲈塘鳢在不同时间的死亡情况
葛氏鲈塘鳢死亡个体初始表现为口张大,鳃张大,呼吸明显受阻,出现休克状态,随后死亡。急性升温组在1 h时死亡率较高,随着胁迫时间的延长,葛氏鲈塘鳢的死亡率逐渐降低,在胁迫12 h时,平行2死亡1尾,胁迫24 h时,3个平行均无死亡,组平均死亡率为(53.33±0.03)%。渐变升温组3个平行均在24 h时有死亡情况,整个渐变升温过程中平均死亡率为(5.56±0.02)%,显著低于急性升温组(P<0.05)。对照组和急性升温组恢复过程均无死亡(表1)。

表1 升温后不同时间各组葛氏鲈塘鳢的死亡情况
注:R表示恢复阶段的试验组.
Note: R represents the test group in recovery stage.
2.2 急性升温和渐变升温下葛氏鲈塘鳢肝脏的抗氧化酶活性和丙二醛浓度的变化
急性升温至31 ℃ 1 h时,肝脏超氧化物歧化酶活性显著低于17 ℃对照组(P<0.05),1 h后呈升高趋势,显著高于渐变升温组(P<0.05);6 h后过氧化氢酶活性显著高于对照组,直至24 h后显著高于渐变升温组;31 ℃急性升温胁迫1 h时丙二醛浓度显著高于对照组和渐变升温组(P<0.05),达到5.18 mmol/mL,在6、12 h时逐渐下降,24 h时升高(表2)。
恢复4~24 h时,急性升温组超氧化物歧化酶活性显著低于对照组和渐变升温组(P<0.05),过氧化氢酶活性与对照组相比显著升高(P<0.05);恢复24 h时丙二醛浓度显著高于对照组(P<0.05)。

表2 升温后葛氏鲈塘鳢肝脏的抗氧化酶活性和丙二醛浓度的变化
注:表中同列数据右上角标相同字母的平均值间差异不显著(P>0.05),标不同字母的表示差异显著(P< 0.05);下同.
Note: the means with the same letter within the same column are not significant difference (P>0.05), and the means with different letters in the same column are significant difference (P<0.05); et sequentia.
2.3 急性升温和渐变升温下葛氏鲈塘鳢脑的抗氧化酶活性和丙二醛浓度的变化
急性升温下1 h时脑中的超氧化物歧化酶和过氧化氢酶活性显著低于17 ℃对照组(P<0.05),1~12 h呈升高趋势,但超氧化物歧化酶活性显著高于渐变升温组(P<0.05);过氧化氢酶活性显著低于渐变升温组(P<0.05);急性升温下1 h时,脑中的谷胱甘肽过氧化物酶活性显著高于对照组(P<0.05),后持续下降,但显著高于渐变升温组(P<0.05);丙二醛浓度持续升高,在12 h时升至最高达到9.52 mmol/mL后降低,但显著高于渐变升温组(P<0.05)(表3)。
恢复条件下,超氧化物歧化酶活性显著低于对照组(P<0.05),过氧化氢酶活性显著高于对照组(P<0.05),谷胱甘肽过氧化物酶活性在4 h时显著高于对照组(P<0.05),后急剧降低,显著低于对照组(P<0.05);丙二醛浓度在4 h时高于对照组,并呈升高趋势。
2.4 急性升温和渐变升温下葛氏鲈塘鳢肌肉的抗氧化酶活性和丙二醛浓度的变化
31 ℃急性升温胁迫条件下,肌肉中的超氧化物歧化酶活性上下波动,在12 h时活性最高,达到7.76U/mL,显著高于渐变升温组(P<0.05);丙二醛浓度则在1.00~1.53 mmol/mL内波动(表4)。
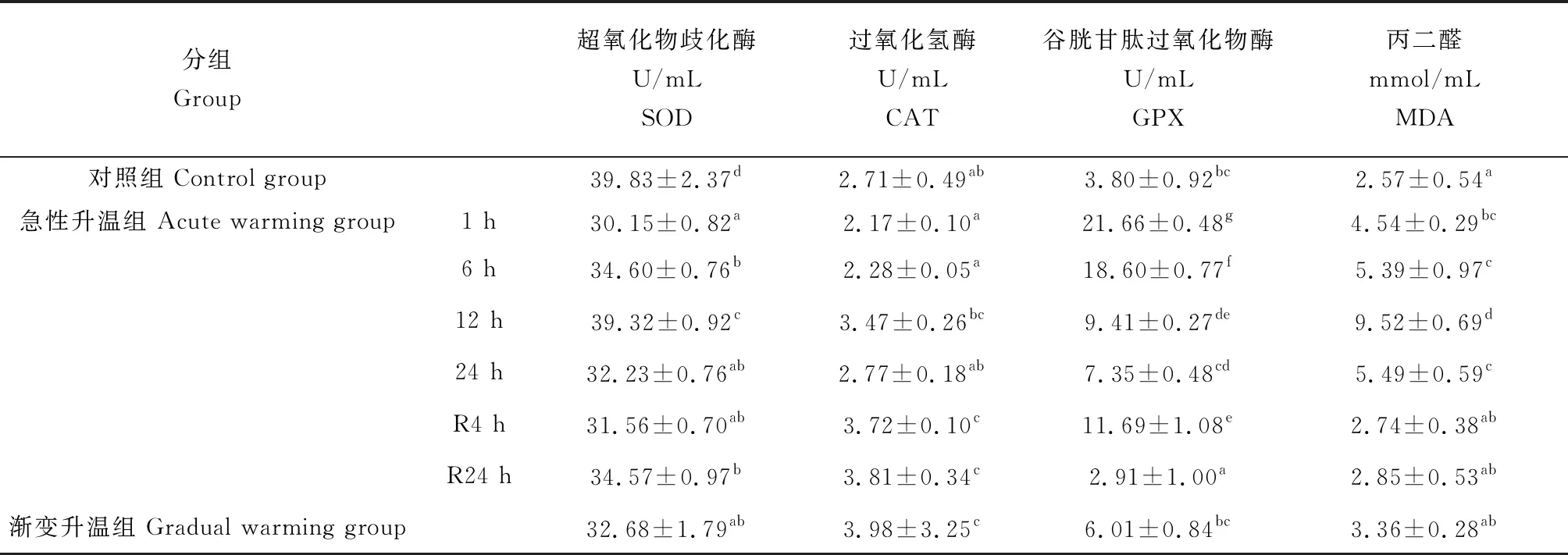
表3 升温后葛氏鲈塘鳢脑的抗氧化酶活性和丙二醛浓度的变化
恢复4 h内,超氧化物歧化酶活性显著低于对照组(P<0.05),后逐渐升高,但未达到对照组活性水平;丙二醛浓度呈下降趋势,最终与对照组浓度几乎相同。

表4 升温后葛氏鲈塘鳢肌肉的抗氧化酶活性和丙二醛浓度的变化
3 讨 论
3.1 急性升温和渐变升温对葛氏鲈塘鳢死亡率的影响
鱼类属于变温水生动物,水温急剧升高和降低均会影响水生生物的存活和代谢[10],若温度骤升,耐寒鱼类因不能适应高温环境而死亡[5]。本试验结果显示,葛氏鲈塘鳢对急性升温应激反应明显,在1 h内死亡率较高;在渐变升温的条件下,葛氏鲈塘鳢的死亡率很低,且是在变温后过24 h开始死亡,这表明葛氏鲈塘鳢更能适应渐变的升温模式。该方式可使鱼体有充足时间调节以适应水温变化[11]。葛氏鲈塘鳢为耐寒鱼,对高温的耐受能力较弱,所以在渐变升温模式下,温度达到鱼的耐受极限也会导致其死亡。
3.2 急性升温和渐变升温对葛氏鲈塘鳢肝脏抗氧化酶活性和丙二醛浓度的影响
超氧化物歧化酶能将生物自身代谢或外界胁迫下产生的一系列有毒物质转化为过氧化氢,再由过氧化氢酶将其还原成氧分子和水[12],维持细胞和机体的正常活动[9]。Yang等[13-14]发现,在环境温度接近物种耐热最佳温度时,丙二醛浓度最低,当鱼体暴露在临界温度上限时,丙二醛浓度显著增加。
急性升温胁迫1~24 h内,葛氏鲈塘鳢肝脏中的超氧化物歧化酶和过氧化氢酶活性增加可能是低氧所致。高温会降低水中的溶解氧水平,在缺氧的条件下,抗氧化酶活性和氧化应激会增加。研究发现,在缺氧条件下底栖麦瑞加拉鲮(Cirrinusmrigala)[15]肝脏中的超氧化物歧化酶活性增加。对卵形鲳鲹(Trachinotusovatus)[16]的研究也发现,急性升温1 h内,过氧化氢酶活性增加,这表明长时间的急性高温胁迫给鱼类带来了缺氧的环境;在缺氧条件下,葛氏鲈塘鳢能通过增加抗氧化酶活性来增加机体防御能力和抵抗力,减少氧化损伤。而在渐变过程中,超氧化物歧化酶和过氧化氢酶活性低于急性升温组,也表明了渐变条件下氧化损伤更少,不需要大量的抗氧化酶来消除氧化损伤。
徐冬冬等[8]对褐牙鲆(Paralichthysolivaceus)的研究发现,温度恢复时超氧化物歧化酶和过氧化氢酶活性均能恢复到对照组水平;但本试验中,当温度胁迫停止一段时间后,仅有过氧化氢酶的活性恢复到对照组水平,超氧化物歧化酶活性并未恢复到对照组水平。这可能是体内的氧化还原压力降低,使其肝脏内的过氧化氢酶活性恢复,而超氧化物歧化酶活性可能由于高温变性,不能恢复到原有活力[17]。
本研究中,在急性升温1 h内,葛氏鲈塘鳢肝脏中的丙二醛浓度较其他组织剧烈升高,显著高于渐变升温组。这表明肝脏是脂质过氧化反应产生或氧化物分解的主要场所,急性升温组比渐变升温组积累的有害物质更多。而急性升温后1~12 h又迅速下降是因为抗氧化酶活性的增强消除了有害物质。
3.3 急性升温和渐变升温对葛氏鲈塘鳢脑抗氧化酶活性和丙二醛浓度的影响
谷胱甘肽过氧化物酶能将脂质过氧化物还原成醇,减少脂类被氧化的机会及丙二醛对细胞的损伤[18]。谷胱甘肽过氧化物酶以谷胱甘肽为底物通过化学方法降低过氧化氢和其他有毒化合物来减轻氧化应激,与过氧化氢酶的功能类似,还可以清除脂质过氧化物[5]。本试验中,在急性升温1 h内,葛氏鲈塘鳢脑组织中的过氧化氢酶活性降低,谷胱甘肽过氧化物酶活性显著升高(P<0.05),可能是由于过氧化氢酶的活力不足以清除过多的活性氧自由基及过氧化氢,因此机体调动谷胱甘肽过氧化物酶参与抗氧化的调节。过氧化氢酶活性在1 h后升高,谷胱甘肽过氧化物酶的活性开始下降,显著低于对照组(P<0.05),这与宋志明等[5]对点篮子鱼(Siganusguttatus)的研究结果相同,可能是由于在急性升温过程中,过氧化氢酶足以清除体内过量的过氧化氢,抑制了谷胱甘肽过氧化物酶的活性,在渐变条件下,过氧化氢酶和超氧化物歧化酶活性高于急性升温组,而谷胱甘肽过氧化物酶活性低于急性升温组,也表明渐变条件下氧化损伤较低,过氧化氢酶和超氧化物歧化酶足以清除过氧化氢而抑制谷胱甘肽过氧化物酶的活性。
脑中超氧化物歧化酶活性在急性升温1~12 h时显著升高(P<0.05),这表明高温胁迫下脑组织超氧化物歧化酶活性的增加可能是清除超氧自由基的重要机制之一[19]。超氧化物歧化酶和过氧化氢酶活性增加,减少了活性氧的损伤,保持了相对的稳态[20]。急性升温12 h后脑中超氧化物歧化酶和过氧化氢酶活性显著降低(P<0.05),推测这主要是由于在长时间高温条件下鱼体内自由基增加较多,抗氧化酶活力不足以抑制细胞内的氧化损伤,进而导致抗氧化酶活力下降。恢复过程中,脑中的抗氧化酶除了过氧化氢酶外,最终也未达到对照组水平,而丙二醛浓度高于对照组。这表明长时间高温导致鱼体代谢紊乱,脑组织受到了损伤。
急性升温12 h时,葛氏鲈塘鳢脑中的丙二醛浓度达到峰值,且显著高于渐变升温组,表明长时间急性高温胁迫下,鱼体脑代谢加快,脂质过氧化程度比渐变条件下强,鱼体通过调节体内抗氧化酶活性,使体内脂质过氧化氢含量降低。
3.4 急性升温和渐变升温对葛氏鲈塘鳢肌肉抗氧化酶活性和丙二醛浓度的影响
葛氏鲈塘鳢肌肉中的超氧化物歧化酶活性在急性升温12 h时显著升高(P<0.05),这与对金头鲷(Sparusaurata)[21]暖化后的氧化应激代谢的研究结果相似,表明肌肉也具有较强的抗氧化能力。本试验中肌肉的超氧化物歧化酶活性在急性升温24 h时降低,说明长时间热应激使机体抗氧化能力减弱,削弱了机体的稳态[20]。恢复过程中,超氧化物歧化酶活性和丙二醛浓度均近乎恢复到对照组水平,说明肌肉组织相比于肝脏和脑更能适应急性升温,可能是由于肌肉大面积暴露在环境中,氧化应激反应更加迅速。渐变条件下,超氧化物歧化酶活性和丙二醛浓度均低于急性升温组,说明渐变升温与急性升温相比对鱼体的氧化损伤较小。

