异育银鲫内参基因的筛选
费越越,南星羽,余 路,罗 扬,高钟元,许 丹,3
( 1.上海海洋大学,国家水生动物病原库,上海 201306; 2.上海海洋大学,农业农村部水生种质资源重点实验室,上海 201306; 3.上海海洋大学,国家渔业科学教育示范中心,上海 201306 )
实时荧光定量PCR(qRT-PCR)是一种实时监控PCR扩增产物并进行解析的定量方法,因其灵敏度高、操作简单等优点,目前已在基因表达检测中广泛应用[1]。在常用的相对定量PCR试验中,为准确获得目的基因的相对表达量,通常引入合适的内参基因来校正RNA质量和反应条件等存在的误差。理想的内参基因应该在不同组织、不同发育阶段和不同处理条件下均保持相对恒定的表达水平[2]。试验中常选择管家基因作为内参基因,如甘油醛-3-磷酸脱氢酶(GAPDH)、β-肌动蛋白(β-actin)、18S核糖体RNA(18S rRNA)和延伸因子(EF-1α)。然而,有研究报道称,绝对稳定的基因并不存在,管家基因也只是在特定条件下表现出相对稳定的表达[3],如鳜鱼(Sinipercachuasti)胚胎发育阶段β-actin、18S rRNA和GAPDH基因的稳定性研究表明,18S rRNA在不同发育阶段表达水平有显著差异[4]。达氏鲟(Acipenserdabryanus)14种不同组织中EF-1α、β-actin和GAPDH基因的表达量研究表明,GAPDH基因表达有显著差异[5]。因此,即便是管家基因也要在特定条件下进行特定分析。为了提高qRT-PCR数据结果准确性,通常需要根据试验处理条件选择合适的内参基因。
异育银鲫(Carassiusauratusgibelio)是以兴国红鲤(Cyprinuscarpiovar.singuonensis)为父本,天然雌核发育的方正银鲫(C.auratusgibelio)为母本,经人工授精和异精雌核发育而获得的子代,因其生长迅速、适应力强、肉质鲜美且易于养殖,颇受人们喜爱[6]。据统计,目前,我国养殖的异育银鲫产量超过3.0×107t,在水产养殖中占有非常重要的地位[7-8]。但是近几年来,大规模的集约化养殖导致其病害问题日益严重[9]。其中由鲤疱疹病毒Ⅱ型(CyprinidherpesvirusⅡ,CyHV-2)引发的造血器官坏死症导致异育银鲫大规模死亡,这给养殖户造成巨大的经济损失[10]。目前,针对鲤疱疹病毒Ⅱ型引发异育银鲫大规模死亡的致病机理还不是十分清楚。Lu等[11]为研究鲤疱疹病毒Ⅱ型的致病机理选取感染后的肾脏组织进行转录组测序分析,利用qRT-PCR技术验证并分析基因的表达情况;Xia等[12]为探究干扰素对造血器官坏死症的防治作用,利用qRT-PCR技术研究干扰素相关基因的表达情况。然而利用qRT-PCR技术进行异育银鲫内参基因系统筛选的研究国内外尚未见报道。在生物体中各组织均有其独特的生理机能,研究基因在不同组织中的不同表达量,可为研究基因的功能提供参考[13]。据报道,异育银鲫的肾脏和脾脏是鲤疱疹病毒Ⅱ型病毒富集最主要的组织,筛选出感染肾脏和脾脏在不同时间点均较稳定的内参基因可以为研究病毒致病机理获得最准确的基因表达结果[14]。鱼类细胞系的构建为鱼类疾病的研究等提供强有力的基础材料[15]。细胞水平qRT-PCR内参基因的研究将为确保基因表达分析的准确性提供依据,从而为细胞水平探究致病机理奠定基础。
笔者选用GAPDH、EF-1α、18S rRNA和β-actin 4个管家基因,利用内参基因评估软件geNorm[16]、Norm Finder[17]、Best Keeper[18]、Delta Ct[19]以及RefFinder[20]对这4个内参基因分别在健康异育银鲫的不同组织、鲤疱疹病毒Ⅱ型感染肾脏、脾脏以及尾鳍细胞在不同时间点进行内参基因表达稳定性分析,并从异育银鲫肾脏组织cDNA转录组文库中筛选出差异表达的基因PIN1[21]在肾脏组织不同感染时间点,对4个候选内参基因的稳定性进行验证。最终自4个候选内参基因中筛选出在健康异育银鲫的不同组织、鲤疱疹病毒Ⅱ型感染肾脏、脾脏以及尾鳍细胞不同时间点均适用的内参基因。
1 材料与方法
1.1 试验材料
健康异育银鲫 [体长(10.1±0.2) cm,质量(90.2±0.12) g] 购于江苏四大家鱼原种场,在上海海洋大学动物房(23±0.5) ℃暂养,暂养期间每日投喂颗粒饲料1次(投喂量为鱼体质量的3%)。经过7 d的暂养,随机分为5组进行腹腔注射鲤疱疹病毒Ⅱ型病毒悬液(每组注射量为7×103.9±0.22pfu/mL)[22],对照组注射1 mL磷酸缓冲盐溶液。注射后,分别在0、6、12、24 h和120 h时间点取6尾鱼,解剖取脑、脾脏、肾脏、肌肉、鳃、肠、肝脏和心脏组织块,迅速放置于液氮中速冻后暂存于-80 ℃冰箱中。
本试验的尾鳍细胞[22]和鲤疱疹病毒Ⅱ型由国家水生动物病原库实验室保存[23]。尾鳍细胞用规格为T75培养瓶培养18瓶,传代48 h(细胞融合度至80%~90%),弃除原来培养基(10%FBS,M199培养基),加入2 mL鲤疱疹病毒Ⅱ型病悬液(7×103.9±0.22pfu/mL)[22],对照组加入2 mL磷酸缓冲盐溶液孵育2 h之后,注入8 mL新鲜培养基(2%FBS,M199培养基),放置27 ℃培养箱。分别在0、1、2、3、4 d和5 d各时间点收集3瓶细胞,放置冰箱-80 ℃保存。
1.2 总RNA的提取和cDNA 的合成
健康异育银鲫的不同组织、鲤疱疹病毒Ⅱ型感染异育银鲫的肾脏、脾脏以及细胞不同时间点的总RNA均使用试剂盒TRIzol©Reagent (Thermo Scientific, 美国)提取。用1%琼脂糖凝胶电泳检测RNA完整性。使用NanoDrop©2000c核酸分析仪(Thermo Scientific, 美国)检测RNA的含量及纯度,稀释后保持其质量浓度为500~1000 ng/μL。分别从不同处理条件下的样品中取2 μg RNA,使用Recombinant DNase Ⅰ(RNase-free) (TaKaRa)操作进行去DNA处理,使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa)反转录成cDNA,存储于-20 ℃备用。
1.3 引物来源
自异育银鲫肾脏组织转录组数据库中获得GAPDH基因的部分序列,用Primer 5.0设计引物用于qRT-PCR(表1)。另外β-actin[24]、18S rRNA[25]、EF-1α[26]、PIN1[21]基因的引物序列来源于已发表的文章。

表1 4种候选内参基因的引物信息
1.4 qRT-PCR试验
qRT-PCR使用 TB GreenTMPremix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒(TaKaRa)按说明书操作。反应在BIO RAD CFX96TMReal-Time System定量PCR仪完成,25 μL PCR扩增反应体系: TB GreenTMPremix Ex TaqTMⅡ (2×) 12.5 μL,cDNA (<100 ng) 2.0 μL,ddH2O 8.5 μL,PCR Forward/Reverse Primer(10 μmol/L) 1 μL,每个样品重复测定3次。实时荧光定量PCR反应条件为95 ℃预变性30 s;95 ℃变性5 s,60 ℃复性30 s,共40个循环。
1.5 数据分析
试验选用geNorm、Norm Finder、Best Keeper和Delta Ct对qRT-PCR产生的原始Ct值进行数据分析。运用Ref Finder对4种软件的分析结果进行综合排名,最终给出一个稳定性排名。
1.6 内参基因的验证
取感染鲤疱疹病毒Ⅱ型病毒的异育银鲫在0、6 h和72 h时的肾脏组织提取RNA(每个时间点3个生物学重复),为使研究更能区分内参基因的稳定性,选取已验证在病毒感染不同时间点的肾脏组织表达差异较大的PIN1[21]基因为目的基因,分别以EF-1α、β-actin、18S rRNA和GAPDH为内参基因,按照1.3中qRT-PCR试验步骤进行操作,引物见表1。内参基因验证的相对表达量用平均值±标准误来表示,使用SPSS 19.0进行单因素方差分析,P<0.01表示具有极显著性差异。
2 结 果
2.1 引物的特异性评估
cDNA初始模板质量浓度控制在200 ng/μL,以10倍梯度稀释的对数函数与循环阈值(Ct值)作标准曲线。计算扩增效率,r2变化为0.993~0.997。所有基因的溶解曲线均为明显单一峰(图1),且样品PCR重复性较好,表明引物特异性较好,不存在引物二聚体。

图1 4对引物的熔解曲线
2.2 健康的异育银鲫不同组织候选内参基因的稳定性评估
检测健康异育银鲫8种组织(脑、脾脏、肾脏、肌肉、鳃、肠、肝脏和心脏)中4个候选内参基因的表达量,所得Ct值分布见图2。不同组织中4个候选内参基因的Ct值为7.45~26.27,其中GAPDH表达水平受组织影响差异较大,最大值和最小值相差10.17个循环。18S rRNA的Ct值变化较小,最大值和最小值相差2.18个循环。18S rRNA的表达Ct值过小,这可能是因为18S rRNA是一种核糖体RNA,约占RNA总量的80%,呈现高丰度表达[27-28]。EF-1α和β-actin在这8种组织中稳定性较好,均稳定在17~18个循环。

图2 健康异育银鲫的不同组织候选内参基因Ct值分布
健康异育银鲫的不同组织内参基因稳定性排序结果显示,Delta Ct不需要限定起始的总RNA的含量,可直接对同一处理条件下不同基因进行Ct值两两比较,获得更精确的结果。Delta Ct对异育银鲫的不同组织4个候选内参基因的评估结果显示,各基因稳定性排序为EF-1α>β-actin>18S rRNA>GAPDH。
BestKeepe主要通过内参基因和目标基因表达量的配对相关系数、标准偏差和变异系数确定内参基因。其分析结果显示,各基因稳定性排序为β-actin>EF-1α>GAPDH>18S rRNA。
Normfinder通过一个群体计算不同候选基因得到稳定值,这个数值越小基因则越稳定。Normfinder的分析结果与Delta Ct和BestKeeper的分析结果几乎相同,与Delta Ct的分析结果完全一致,各基因稳定性排序为EF-1α>β-actin>18S rRNA>GAPDH。
geNorm与Normfinder算法类似,不同的是geNorm对候选内参基因进行两两比对计算得到各基因geNorm稳定值(亦称M值),并通过geNorm稳定值对基因稳定性进行排序,geNorm稳定值越小,表达越稳定。其分析结果表明,EF-1α 和β-actin在异育银鲫的不同组织中的表达同样较稳定。由图3可见,EF-1α和β-actin的geNorm稳定值均为0.304。
Ref Finder是一种综合分析的软件可以根据每个软件的排名分配适当的权重并计算其权重的几何平均值为最终的总排名。其分析结果显示,各基因稳定性排序为EF-1α>β-actin>18S rRNA>GAPDH。
综合4种软件(Ref Finder)分析结果,结合geNorm稳定值以及4个内参基因的表达量Ct值,确定EF-1α和β-actin为健康异育银鲫的不同组织稳定的内参基因。

表2 健康异育银鲫的不同组织内参基因稳定性排序

图3 健康异育银鲫的不同组织geNorm稳定值
2.3 鲤疱疹病毒Ⅱ型感染异育银鲫肾脏组织在不同时间点候选内参基因的稳定性评估
检测鲤疱疹病毒Ⅱ型感染异育银鲫肾脏组织在不同时间点(0、6、12、24、48 h和120 h)4个候选内参基因的表达Ct值分布见图4。4个候选内参基因的Ct值为8.79~24.58,其中GAPDH表达水平受感染时间影响差异较大,最大值和最小值相差3.21个循环。18S rRNA的Ct值变化较小,最大值和最小值相差1.53个循环。18S rRNA在不同感染时间点的表达量都过高,GAPDH在不同感染时间点的表达量都较β-actin和EF-1α的表达量低。相对而言,β-actin和EF-1α在4个候选内参基因中表达量较稳定。
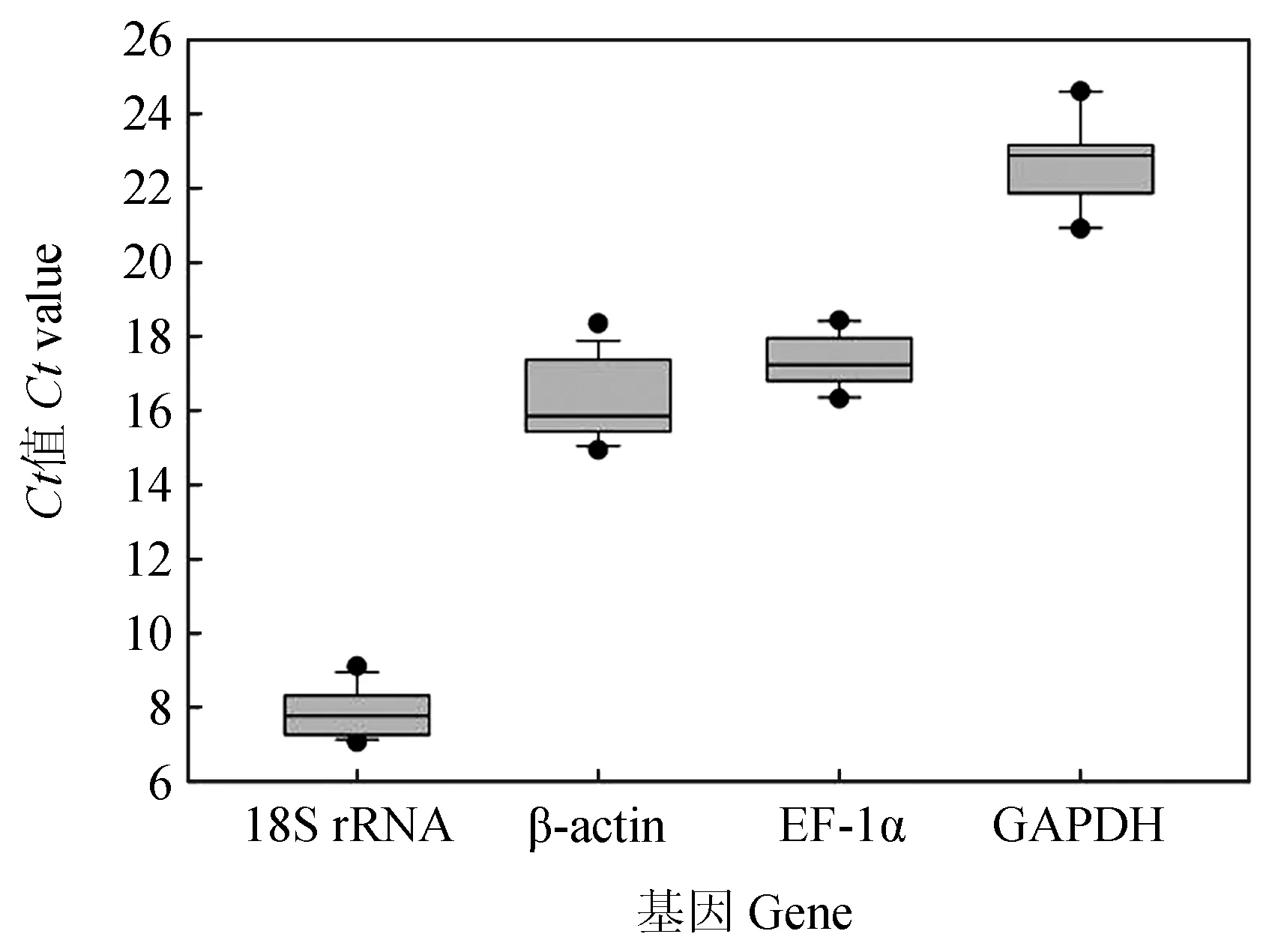
图4 CyHV-2感染异育银鲫肾脏组织不同时间点候选内参基因Ct值分布
Delta Ct的分析结果与Normfinder的分析结果一致,为β-actin>18S rRNA>GAPDH>EF-1α。BestKeeper的分析结果与前者略有不同,为EF-1α>18S rRNA>β-actin>GAPDH。geNorm的分析结果表明,在鲤疱疹病毒Ⅱ型感染异育银鲫肾脏组织不同时间点18S rRNA和β-actin的表达稳定性一致(表3)。18S rRNA和β-actin的geNorm稳定值均为0.535(图5)。由于18S rRNA的Ct值过小,容易在试验中造成误差[29],所以综合4种软件分析结果,结合geNorm稳定值以及4个内参基因的表达Ct值,最终确定β-actin最稳定。
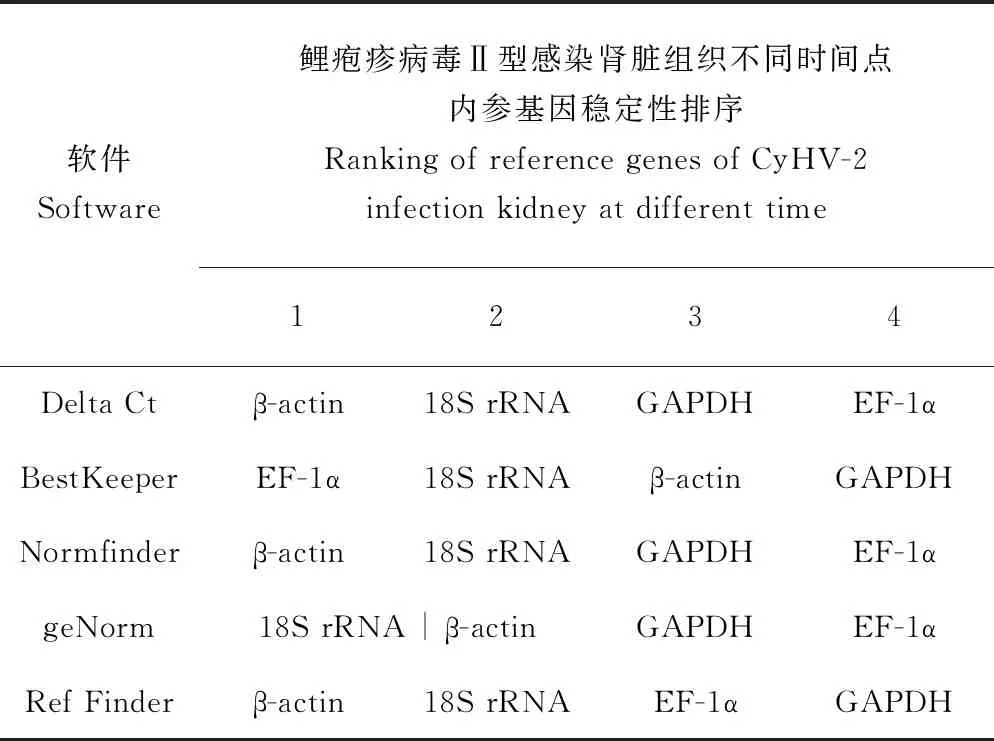
表3 鲤疱疹病毒Ⅱ型感染肾脏组织不同时间点内参基因稳定性排序
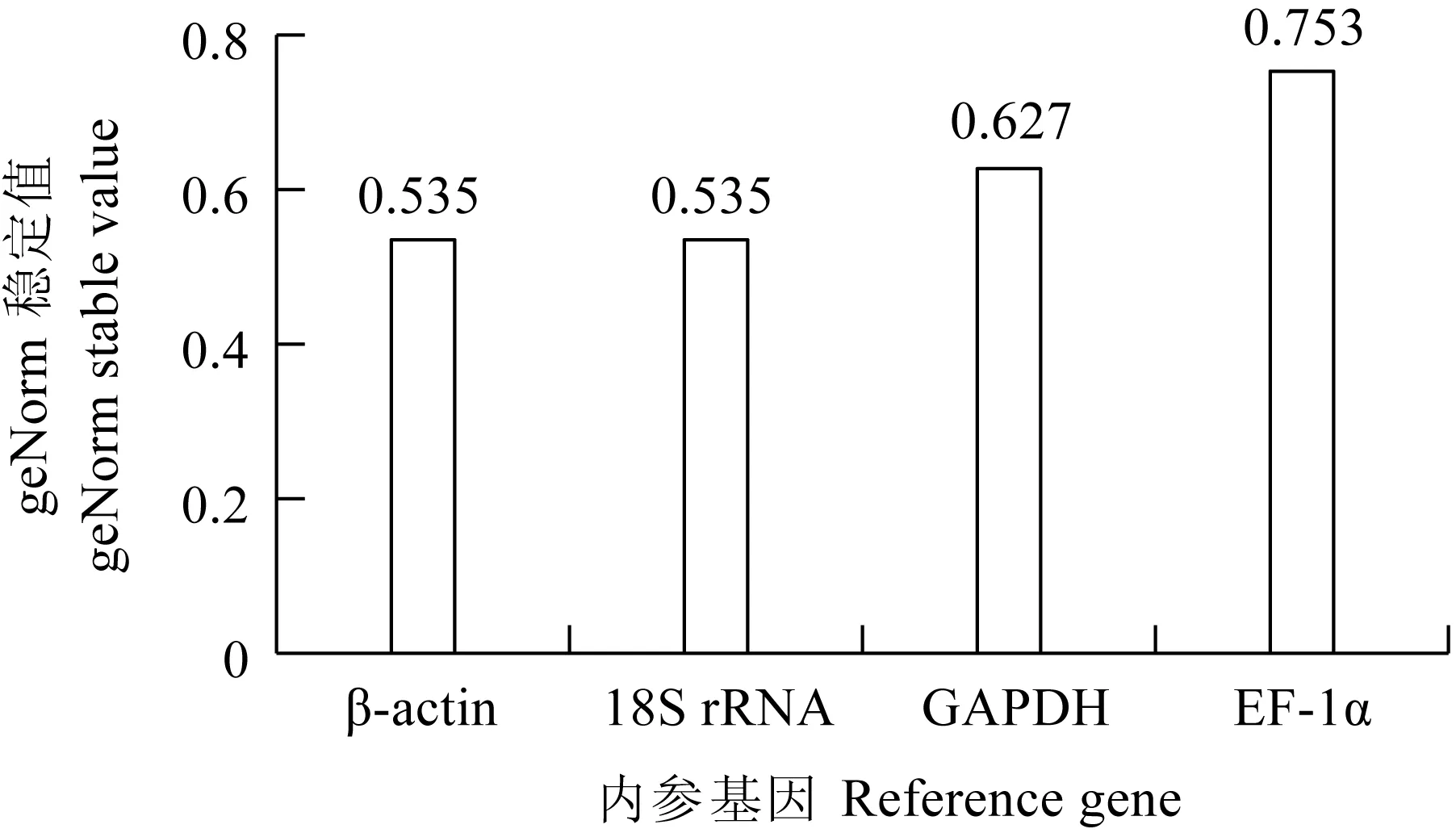
图5 CyHV-2感染异育银鲫肾脏组织不同时间点geNorm稳定值
2.4 鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织在不同时间点候选内参基因的稳定性评估
检测鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织在不同时间点(0、6、12、24、48 h和120 h)候选内参基因的表达量Ct值分布见图6。4个候选内参基因的Ct值为9.63~31.34,其中18S rRNA表达水平受感染时间影响差异较大,最大值和最小值相差21.71个循环。GAPDH的Ct值变化较小,最大值和最小值相差6.04个循环,但GAPDH的表达量都较EF-1α和β-actin的表达低。而EF-1α和β-actin的表达量均稳定在15~23。

图6 CyHV-2感染异育银鲫脾脏组织不同时间点候选内参基因Ct值分布
Delta Ct的分析结果与geNorm的分析结果几乎一致,在鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织不同时间点EF-1α和β-actin稳定性较好。其中geNorm的稳定值结果显示,EF-1α和β-actin的稳定性相差不大(图7)。与Delta Ct 和geNorm的分析结果不同,BestKeeper与Normfinder的分析结果表明,在鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织中EF-1α和GAPDH的表达相对较稳定(表4)。综合4种软件分析结果,结合geNorm稳定值以及4个候选内参基因的表达Ct值,最终确定,在鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织不同时间点EF-1α相对比较稳定。

图7 CyHV-2感染异育银鲫脾脏组织不同时间点geNorm稳定值
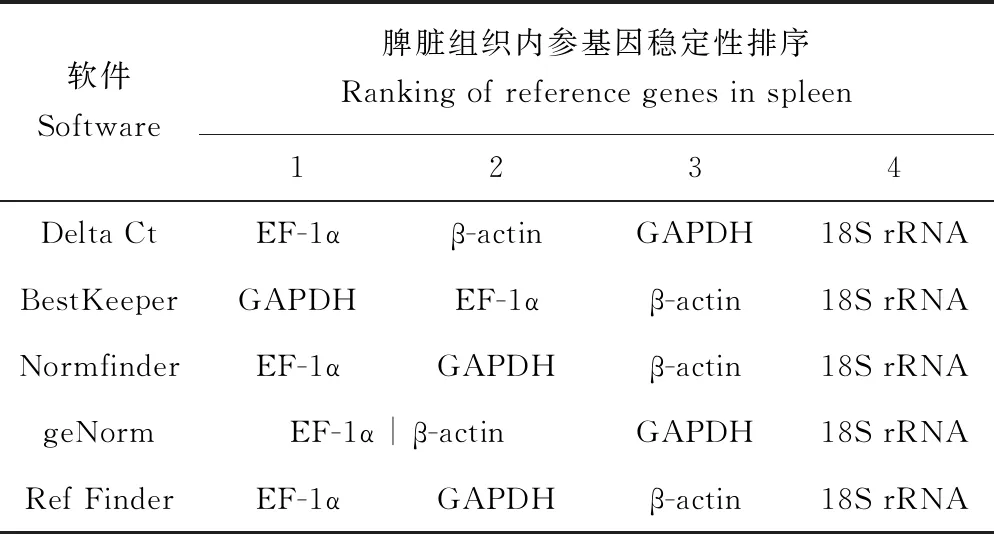
表4 鲤疱疹病毒Ⅱ型感染异育银鲫脾脏组织不同时间点内参基因稳定性排序
2.5 鲤疱疹病毒Ⅱ型感染异育银鲫尾鳍细胞在不同时间点候选内参基因的稳定性评估
检测鲤疱疹病毒Ⅱ型感染尾鳍细胞不同时间点(0、1、2、3、4 d和5 d),4个候选内参基因的表达量Ct值分布见图8。4个候选内参基因的Ct值为7.39~36.54,其中GAPDH表达水平受感染时间影响差异较大,最大值和最小值相差4.67个循环。18S rRNA的Ct值变化较小,最大值和最小值相差2.98个循环。β-actin和EF-1α在细胞感染不同时间点的表达量Ct值均相对稳定(图9,表5)。
2.6 内参基因的验证
研究表明,在鲤疱疹病毒Ⅱ型感染异育银鲫肾脏组织过程中,随着感染时间延长,病毒拷贝数逐渐升高,PIN1基因的mRNA表达量显著下降[21]。为验证测序结果的准确性,本次定量验证中添加6 h的试验组。经过SPSS 19.0分析,试验结果和肾脏组织转录组cDNA的测序结果(TPM值)见图10。PIN1基因以GAPDH为内参基因时,在鲤疱疹病毒Ⅱ型感染肾脏组织0 h和72 h时的表达趋势与测序结果不符;PIN1基因以18S rRNA为内参基因,目的基因表达在0 h和72 h没有显著差异。相反,以β-actin和EF-1α为内参基因时,PIN1基因在鲤疱疹病毒Ⅱ型感染肾脏组织0 h和72 h时的表达趋势与测序结果一致,且差异极显著(P<0.01)。随着感染时间的增加,PIN1基因以β-actin基因为内参分别在鲤疱疹病毒Ⅱ型感染肾脏组织0、6 h和72 h时相对表达量差异极显著(P<0.01)。而PIN1基因以EF-1α基因为内参在鲤疱疹病毒Ⅱ型感染肾脏组织0 h和72 h时相对表达量差异极显著(P<0.01)(图11),但在PIN1基因以EF-1α为内参在鲤疱疹病毒Ⅱ型感染肾脏组织6 h和72 h时相对表达量无极显著差异(P>0.01)。因此,在鲤疱疹病毒Ⅱ型感染异育银鲫的肾脏组织中β-actin为其最佳的内参基因。

图8 CyHV-2感染GiCF细胞不同时间点候选内参基因Ct值分布
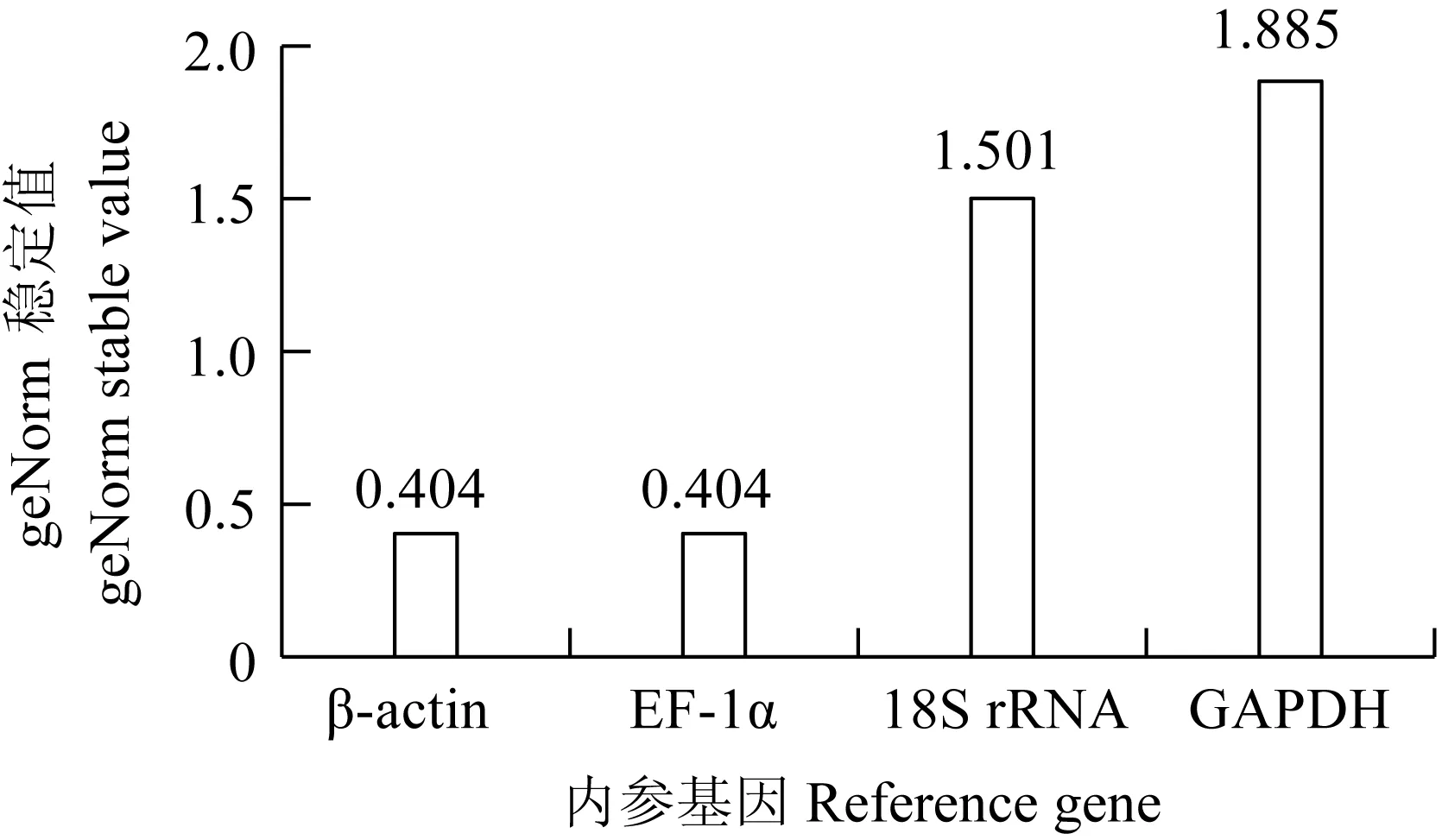
图9 CyHV-2感染GiCF细胞不同时间点geNorm 稳定值
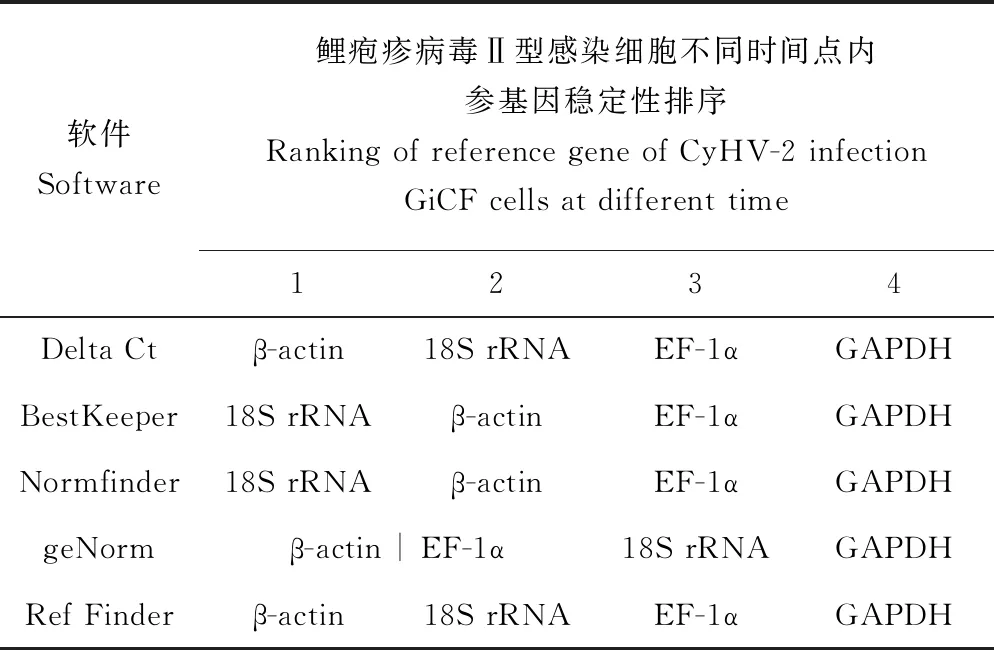
表5 鲤疱疹病毒Ⅱ型感染细胞不同时间点内参基因的稳定排名情况

图10 PIN1基因分别以4个候选内参基因为内参在肾脏中的表达量
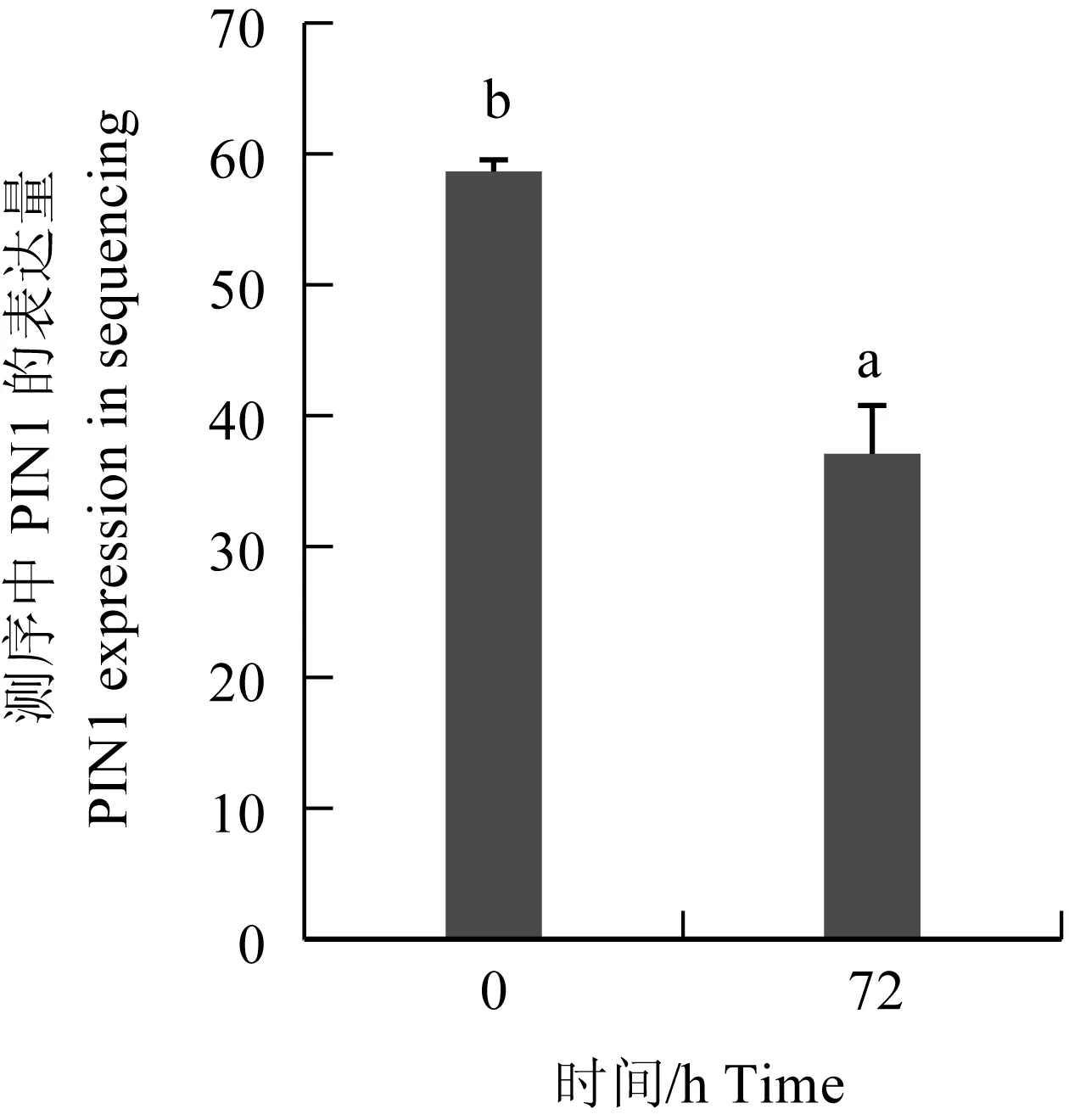
图11 PIN1在转录组数据库测序中的表达量
3 讨 论
3.1 内参基因在不同组织中稳定性分析
为了使基因在qRT-PCR试验中的相对表达结果更可靠,筛选最佳的内参(管家)基因是必不可少的。研究水产动物常用的管家基因很多,18S rRNA、GAPDH、EF-1α和β-actin是4个较为常用的内参基因。其中,甘油醛-3-磷酸脱氢酶(GAPDH)是一种参与糖酵解和糖异生等循环过程的关键酶[30];延伸因子(EF-1α)是参与蛋白质翻译的重要因子[31];18S核糖体RNA(18S rRNA)是一类编码核糖体小亚基RNA[32];β-肌动蛋白(β-actin)是构成细胞骨架的主要成分之一。然而不同物种、不同组织、不同发育时期以及不同处理条件,管家基因的稳定性并不是一成不变的,如在褐牙鲆胚胎不同发育时期18S rRNA是其最合适的内参基因[33];鳜鱼的不同组织中GAPDH为其内参基因[34]。因此只有筛选出合适的内参基因才能保证qRT-PCR试验结果的准确性。
本试验选取健康异育银鲫的8种不同组织为研究对象,选择EF-1α、GAPDH、18S rRNA和β-actin 4个候选管家基因,结合4种内参基因分析软件,geNorm稳定值以及4个内参基因的表达量Ct值,最终分析结果表明,β-actin和EF-1α基因为健康异育银鲫的不同组织中最稳定的基因。董捷[26]研究草鱼(Ctenopharyngodonidella)不同组织基因表达丰度时,发现18S rRNA和β-actin是最稳定的内参基因;Olsvik等[35-36]比较了大西洋鲑(Salmosalar)不同组织中β-actin、RPS20和EF-1α的表达稳定性,发现EF-1α基因的表达最稳定;茅华华等[37]发现斑鳢(Channamaculata)在成鱼不同组织中β-actin基因最稳定。健康异育银鲫的不同组织内参基因β-actin和EF-1α的稳定性与上述研究都有相似之处。这可能因为不同的物种中管家基因的转录水平不同,但是其在特定组织的稳定性可能存在一致性。在脊椎动物鱼类和无脊椎动物贝类中,虽然不同的物种中β-actin和EF-1α基因表达量不同,如草鱼[26]、鲈鲤(Percocyprispingi)[38]、鳜鱼[4]、建鲤 (Cyprinuscarpiovar.jian)[39]、皱纹盘鲍(Haliotisdiscushannai)[40]、合浦珠母贝(Pinctadafucata)[41]和三角帆蚌 (Hypriopsiscumingii)[42],但是其仍然具有良好的稳定性,这与本试验中的结果一致,表明β-actin和EF-1α基因同样可以作为鱼类与海洋无脊椎动物的内参基因。
3.2 内参基因在病毒刺激下稳定性分析
生物体通常都有自我保护的意识,在病毒刺激下会产生相应的免疫应答反应,筛选出稳定的内参基因,为研究病毒刺激下免疫基因的表达提供理论基础。
Jorgensen等[43]用传染性鲑鱼贫血病毒(Infectioussalmonanemiavirus, ISAV)感染大西洋鲑和肾细胞发现感染不同时间点组织水平18S rRNA和EF-1α最稳定,而细胞水平仅有18S rRNA最稳定。与上述试验结果类似的是本试验用鲤疱疹病毒Ⅱ型感染异育银鲫的脾脏组织不同时间点,EF-1α为其稳定的内参基因。不同的是本试验选用鲤疱疹病毒Ⅱ型感染异育银鲫的肾脏和尾鳍细胞不同时间点发现β-actin为其最稳定的基因。这与Julin等[44]用传染性胰腺坏死病毒(Infectiouspancrieaticnecrosisvirus, IPNV)感染大西洋鲑不同时间点,发现EF-1α和β-actin的稳定性最高的结论相似。有研究表明,异育银鲫的肾脏是鲤疱疹病毒Ⅱ型的主要复制点,脾脏是淋巴细胞移居和接受抗原刺激后产生免疫应答的主要场所[9]。所以在鲤疱疹病毒Ⅱ型感染异育银鲫的肾脏、脾脏不同时间点内参基因的稳定性不同,这可能与病毒刺激条件下,基因在组织间的选择性表达有关。此外本试验由于18S rRNA的表达过于丰富,可能会比目的基因的表达还要高,容易在试验过程中和数据分析时造成误差,且有研究表明,18S rRNA的转录容易受到生物因素和药物因素影响[29]。EF-1α是真核生物的延伸因子,其在组织中稳定性已经被大量的学者研究证明,如大鲵(Andriasdavidianus)在细菌的感染下组织的内参基因的稳定性评价显示,EF-1α是稳定的内参基因[45]。本试验的结果分析也表明,EF-1α可作为病毒刺激下稳定的内参基因。β-actin是一种微丝的结构蛋白,在抵御某些病毒和病原微生物的入侵时,β-actin的分泌稳定,可以用作为内参基因对其他基因的标准化处理[46]。因此,在病毒刺激下,β-actin较适合作为异育银鲫肾脏组织和细胞水平qRT-PCR的内参基因。
PIN1是一种高度保守的特异的多肽脯氨酰基顺反异构酶具有促进细胞增殖的功能[47]。数据库测序结果显示,PIN1基因表达量呈下调趋势,本试验的qRT-PCR结果也显示,以β-actin为内参时PIN1基因表达量符合测序结果。Lu等[22]在异育银鲫肾脏组织的cDNA文库测序过程中发现,PIN1基因表达量在感染鱼体过程中呈现组织水平的下调趋势与本试验结果相符合,这可能在病毒的刺激下PIN1基因的转录水平受到抑制从而导致细胞增殖的功能受阻。
4 结 论
本试验通过qRT-PCR技术,筛选出异育银鲫组织水平和细胞水平中均较稳定的内参基因。试验结果表明,在健康异育银鲫的不同组织中β-actin和EF-1α均可作为其内参基因。在鲤疱疹病毒Ⅱ型感染肾脏以及细胞系不同时间点,β-actin为其内参基因;脾脏组织中,EF-1α为其内参基因。通过在异育银鲫肾脏组织不同感染时间点,PIN1基因的表达分析也进一步验证了其内参基因的适用性,本研究将为探究异育银鲫基因的qRT-PCR提供理论依据,为深入查明异育银鲫体内及体外宿主的基因表达与病毒相互作用奠定基础。

