甘草次酸生物合成菌株的筛选与发酵条件优化
赵文俊 吴嘉南 何国庆 陈启和
(浙江大学食品科学与营养系 杭州310058)
甘草(Glycyrrhiza),是豆科植物的根和根状茎,临床应用历史长、范围广[1]。甘草次酸(Glycyrrhetinic acid,GA,结构见图1),是甘草中天然活性物质甘草酸(Glycyrrhizic acid,GL,结构见图1)水解脱去两分子葡萄糖醛酸的三萜类皂苷产物,具有抗氧化、抗炎、抗肿瘤、降血脂[2-3]等多种作用,广泛应用于医药、食品、化妆品行业。在甘草次酸的两种光学异构体中,18α-甘草次酸的生物活性强于18β-甘草次酸[4]。
目前,主要通过酸、碱、酶将甘草酸水解,实现工业化生产,然而产物中97%以上是18β-甘草次酸,α-异构体的含量很少,约占3%[4]。周艳艳[5]从甘草饮片粉和甘草酸粗品的培养液中筛选可将甘草酸转化成甘草次酸的菌株YGL-B-12,以甘草酸为底物,通过正交试验优化发酵工艺,将18β-甘草次酸的转化率从21.29%提高到40.83%。木合布力等[4]将18β-甘草次酸与盐酸的无水甲醇溶液一起加热,经碱性水解、酸化制备得到18α-甘草次酸,转化率达到45%。上述工艺繁琐、耗时长、效率低、能耗大且污染环境。
本研究以甘草为发酵底物,针对实验室保存的黑曲霉(Aspergillus niger)CGMCC No.6152 等11 种菌株,以甘草、麦麸和浓缩苹果汁配制天然培养基,筛选出甘草次酸转化率最高的菌株,再通过响应面优化与分析方法(RSM)对影响甘草酸转化的甘草加量、浓缩苹果汁加量、麸皮加量和发酵时间进行优化,获得微生物发酵法制备18α-甘草次酸的优化发酵条件,对发展18α-甘草次酸的工业化生产具有重要意义。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株 试验用黑曲霉CGMCC No.6152 等为浙江大学食品生物科学技术研究所保存的菌株。
1.1.2 培养基
1)斜面培养基 在43 g PDA 培养基中加入1 L 去离子水,加热充分溶解,分装于试管中,121℃灭菌20 min,冷却得斜面培养基。
2)发酵培养基 将甘草切片用固体粉碎机充分粉碎,60 目过筛,得到甘草粉末。甘草粉末、浓缩苹果汁、麸皮、去离子水加量参照表1和表2。pH 自然,30 mL/250 mL 锥形瓶分装,121 ℃灭菌20 min。

图1 甘草酸(a)与18α-甘草次酸(b)的结构Fig.1 Structure of glycyrrhizic acid(a)and 18α-glycyrrhetinic acid(b)
1.1.3 试剂 PDA,杭州微生物试剂有限公司;甘草,四川新荷花中药饮片股份有限公司;浓缩苹果汁,天水长城果汁集团;麸皮,四川万凤粮油有限公司;18α-甘草次酸(纯度98%)和甘草素(纯度98%),北京百灵威科技有限公司;36%HCl 溶液、乙酸乙酯、醋酸均为分析纯药品;甲醇、乙腈均为色谱纯药品。
1.1.4 仪器与设备 PB-10 pH 计,赛多利斯科学仪器(北京)有限公司;JP-040S 超声波清洗机,深圳市结盟清洗设备有限公司;BSA124S 电子天平,赛多利斯科学仪器(北京)有限公司;LDZM-80KCS 立式压力蒸汽灭菌器,上海申安医疗器械厂;5C18-MS-Ⅱ色谱柱,Cosmosil。
1.2 方法
1.2.1 发酵菌株的筛选
1.2.1.1 菌株的活化、复壮与发酵 取-80 ℃低温保存的菌种解冻,用接种铲刮取菌丝或孢子接种于PDA 斜面上,28 ℃培养直至菌株长满斜面。刮取活化菌种的菌丝或孢子接种入发酵培养基中,28 ℃,180 r/min 培养6 d。
1.2.1.2 产物含量的测定
样品溶液制备:在发酵液中加入去离子水定容30 mL,用10%盐酸调节pH 值至3,离心分离,旋转蒸发直至挥干乙酸乙酯(45 ℃,0.05 MPa),加入适量甲醇复溶,用0.22 μm 滤膜过滤,装入液相进样瓶[6]。
标准品溶液制备:准确称取18α-甘草次酸标准品2.3 mg 于10 mL 容量瓶中,用色谱纯甲醇定容至刻度线,得到质量浓度为0.23 mg/mL 的储备液。精密吸取上储备液1 mL,用色谱纯甲醇梯度稀释,得到0.1150,0575,0.0288,0.0144,0.00719,0.00360 mg/mL 的溶液。使用0.22 μm 滤膜过滤样品溶液后装入液相色谱进样瓶中。
色谱条件:C18 色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水-冰醋酸(体积比89∶10∶1),体积流量1.0 mL/min,检测波长248 nm,柱温30℃,进样量20 μL[6-8]。
1.2.1.3 18α-甘草次酸产率的计算 参照下面公式计算18α-甘草次酸产率P(g/g)。

式中,r——发酵产物中甘草次酸含量,g;m——培养基中甘草的加量,g;100——系数。
1.2.2 响应面优化发酵条件
1.2.2.1 优化设计 试验设计依据中心组合设计(Central composite design,CCD)原理[9-11],结合初筛、复筛结果设计响应面优化试验的因素与水平,共21 组试验,结果见表2。
选取复筛菌株,按照初筛的方法再次活化。以甘草加量、浓缩苹果汁加量、麸皮加量及发酵时间作为试验因素,使用Expert Design 软件设计响应面优化条件。参照表2配制21 种发酵培养基,每种3 个平行。在净化工作台中,刮取活化好的菌种的菌丝或孢子接种入发酵培养基中,28 ℃,180 r/min 培养,培养时间参照表2。
产物含量测定方法与初筛相同。使用Expert Design 软件进行响应面优化,得到18α-甘草次酸产率最高的发酵条件及预计产率。
1.2.2.2 验证 以得到的18α-甘草次酸产率最高的发酵条件再次发酵,检验实际产率并与预计产率作对比。

表1 发酵培养基配方Table1 Formulation of fermentation medium
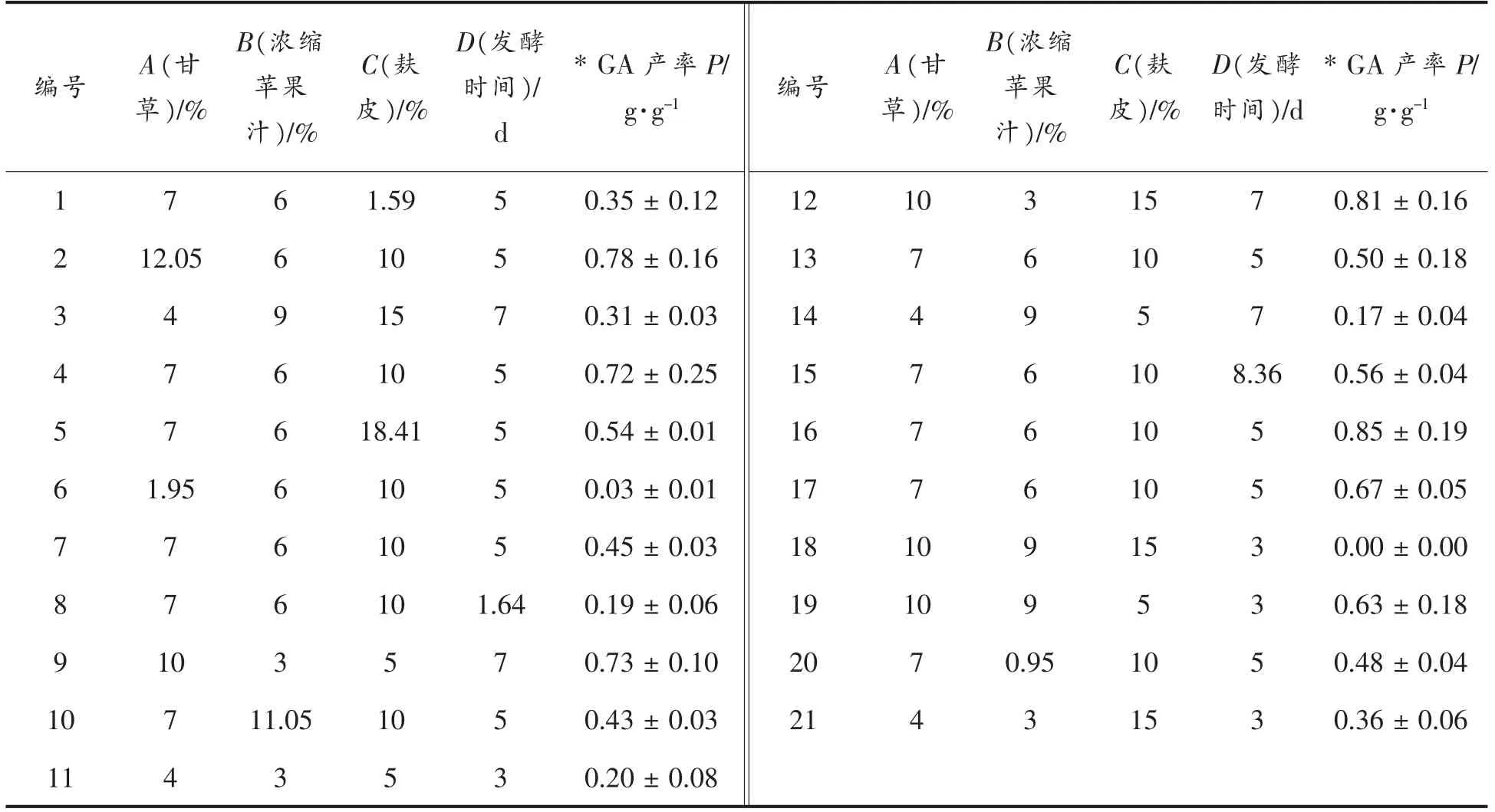
表2 生物转化培养基的响应面优化设计结果Table2 Optimization of fermentation medium configuration
2 结果分析与讨论
2.1 18α-甘草次酸标准曲线
在1.2.1.2 节色谱条件下,18α-甘草次酸的保留时间约为7 min,取峰面积A 对质量浓度ρ(mg/mL)回归得A=3.481×107ρ+3.468×104,R2=0.999。线性关系良好。

图2 18α-甘草次酸标准样品色谱图Fig.2 18α-Glycyrrhetinic acid standard chromatogram

图3 检测样品色谱图Fig.3 Sample chromatogram
2.2 转化筛选与评价
从图4可知,18α-甘草次酸的产率(简称产率)受发酵菌株和发酵培养基影响。在所有发酵菌株中,黑曲霉(阿)、黑曲霉(半)、红曲霉及米曲霉产率较高,其中黑曲霉(阿)在发酵培养基B 中产率为3.02 g/g,在发酵培养基A 中产率为1.36 g/g,高于其它菌株;黑曲霉(半)在发酵培养基A、B 中产率接近,分别为0.64、0.62 g/g;红曲霉在发酵培养基A 中产率为0.28 g/g,高于该菌株在发酵培养基B 中的产率0.09 g/g;米曲霉在发酵培养基A 产率为0.55 g/g,远高于该菌株在发酵培养基B 中的产率0.03 g/g。下一步对黑曲霉(阿)、黑曲霉(半)、米曲霉3 种发酵菌株进行复筛。
谷物的麸皮含有丰富的纤维素和烷基间苯二酚、木脂素、酚酸、植物甾醇、生育酚、生育三烯酚、叶酸等生物活性化合物[12-13],能为微生物的生长繁殖提供丰富的营养物质[14]。蒲立柠等[15]、王小平-[16]等设计添加有麸皮、浓缩苹果汁的天然发酵培养基,用于新型食品的开发,具有借鉴意义。在发酵培养基中添加麸皮能提高黑曲霉(阿)的18α-甘草次酸产率,降低米曲霉的产率,可能是因为麸皮在黑曲霉(阿)产生阿魏酸酯酶[17]的作用下产出具有抗氧化作用的阿魏酸[18],防止生成的甘草次酸被氧化[19],进而提高了甘草次酸的产率;而麸皮为米曲霉提供碳源、氮源及其它营养物质,降低了米曲霉对甘草酸等物质的利用。
2.3 转化菌株的复筛验证
从图5结果可知,3 种发酵菌株的18α-甘草次酸产率均高于对照组,黑曲霉(阿)与米曲霉的产率高于黑曲霉(半)。黑曲霉(阿)在发酵培养基A 中的产率为(0.27±0.072)g/g,低于B 中的产率(1.063±0.248)g/g,且两者均低于初筛产率。黑曲霉(半)在发酵培养基A、B 中的产率接近。米曲霉在发酵培养基A 中的产率为(1.306±0.205)g/g,高于B 中的产率(0.521±0.108)g/g,且两者均高于初筛结果。
复筛阶段的发酵时间为4 d,而初筛阶段为6 d,复筛发酵中黑曲霉(阿)的18α-甘草次酸产率低于初筛的原因可能是部分甘草酸尚未转化。米曲霉复筛的18α-甘草次酸的产率高于初筛,原因可能是随着发酵时间的增加,甘草酸先转化成18α-甘草次酸,之后18α-甘草次酸被转化为酮基化、羟基化或酰基化衍生物[20]。综合初筛、复筛试验结果,选取黑曲霉(阿)在发酵培养基B 的组分基础上进行优化。

图4 不同菌株在不同培养基条件下的18α-甘草次酸产率比较Fig.4 Comparison of 18α-Glycyrrhetinic acid yield of different strains at different media conditions

图5 不同菌株在不同培养基条件下的18α-甘草次酸产率比较Fig.5 Comparison of 18α-Glycyrrhetinic acid yield of different strains at different media conditions
2.4 转化条件的响应面优化
应用响应面法对试验数据进行回归拟合,得出响应值R 对编码自变量A、B、C、D 的二次回归多项方程如下:
R=0.62+0.22A-0.015B+0.0039C+0.11D-0.066A2-0.048B2-0.051C2-0.077D2+0.0092AB-0.11AC+0.11AD-0.089BC+0.084BD+0.083CD
由表3可知,方程中一次项与二次项对产率影响显著,呈非线性关系。回归方程相关系数R2(R-Squared)=0.8880,说明拟合方程与实际相符,误差较小;模型失拟项Prob>F 值为0.5292,大于0.05,模型具有实际意义。由各因素对试验指标的影响程度F 值可以看出,甘草加量对18α-甘草次酸产率影响最大,发酵时间次之,浓缩苹果汁加量再次之,麸皮加量的影响最小。这说明甘草加量促进黑曲霉(阿)产生更多的糖苷酶水解甘草酸生成甘草次酸,甘草加量对甘草次酸产率有较大影响。菌群的扩增以及相应酶的生成需要一定的时间,发酵时间对甘草次酸的产率也有较大影响。浓缩苹果汁、麸皮在培养基中提供碳源、氮源及其它营养物质,能促进黑曲霉(阿)的生长,影响甘草次酸产率。

表3 18α-甘草次酸响应面二次模型方差分析Table3 ANOVA of thequadratic model for 18α-glycyrrhetinic acid yield
各因素与试验结果的分析如图6所示。甘草加量和浓缩苹果汁加量的响应面、甘草加量和麸皮加量的响应面、甘草加量和发酵时间的响应面曲面坡度陡峭且等高线密集,说明甘草加量和浓缩苹果汁加量、麸皮加量、发酵时间的交互作用对18α-甘草次酸产率的增长影响极显著;浓缩苹果汁加量和麸皮加量的响应面曲面坡度较陡峭且等高线较密集,说明浓缩苹果汁加量和麸皮加量的交互作用对18α-甘草次酸产率的增长影响显著[21]。
通过对回归模型进行数学分析,可得到黑曲霉(阿)产18α-甘草次酸的最佳发酵条件:甘草加量9.83%,浓缩苹果汁加量8.05%,麸皮加量9.76%,发酵时间6.79 d,预计18α-甘草次酸产率为0.9256 g/g。以此条件发酵,18α-甘草次酸的实际产率为0.7619 g/g,比预计产率低0.16 g/g,减少17.6%,验证结果与预计相近。
3 结论
18α-甘草次酸是由胞内β-D-葡萄糖醛酸苷酶内切甘草酸β-1,3 糖苷键水解脱掉两分子葡萄糖醛酸得到的产物[22]。18α-甘草次酸的产率受甘草酸的浓度、细胞膜通透性、β-D-葡萄糖醛酸苷酶的数量和活性等因素的影响。
本文从黑曲霉(阿)等11 种食用级菌株出发,以甘草、麦麸、浓缩苹果汁配成发酵培养基进行发酵,再借助高效液相色谱,采用郝淞瑶[23]测定甘草次酸的HPLC 条件检测产物中的18α-甘草次酸并计算产率。在发酵菌株的初筛与复筛中,笔者发现选择黑曲霉(阿)作为发酵菌株,优化其在发酵培养基B 的发酵条件,以甘草加量、麸皮加量、浓缩苹果汁加量及发酵时间作为试验因素,设计响应面优化试验,得到18α-甘草次酸产率最高的发酵条件,即:甘草加量9.83%,浓缩苹果汁加量8.05%,麸皮加量9.76%,发酵时间6.79 d,预计18α-甘草次酸产率为0.9256 g/g。验证实验的结果与预计相符。后续研究可围绕以下方向展开:对pH、温度等它发酵条件进行优化,研究与18α-甘草次酸转化相关的酶的生物化学特性,对甘草次酸进行动物细胞评价。

图6 甘草加量、浓缩苹果汁加量、麸皮加量、发酵时间的响应面图Fig.6 Response surface map of licorice,concentrate apple juice,bran and fermentation time

