靶向控释特性的火龙果多糖外壳微胶囊油脂粉末制备及特性研究
宋广磊 于 达 方玉佩
(浙江工商大学食品与生物工程学院,杭州 310018)
脂肪酸是人体的基础营养素之一,特别是一些有重要生理功能的脂肪酸(ALA、CLA、DHA、EPA等)多含有不饱和双键,添加到食品中极易发生光氧化、酶促氧化造成营养物质丧失营养价值破坏,并产生醛、酮、酮酸及羟酸等有害氧化物,进而造成人体早衰、肿瘤形成、动脉硬化等潜在食品危害[1]。亚麻籽油富含的α-亚麻酸(α-Linolenic acid,ALA)具有抗血栓、降血脂、抗肿瘤以及促进婴儿大脑发育增强记忆力和改善视力情况等生理功能,但是亚麻籽油极易氧化、酸败并产生难闻气味,严重影响了亚麻籽油的营养价值和在食品中的应用[2]。
关于应用微胶囊化技术手段提高脂肪酸、营养因子的储存特性等已有一些研究,但目前关于微胶囊体系的微结构制备几乎都是基于微胶囊形成的外壳组装[3-5],如层层自组装微胶囊[6]、纳米微胶囊[7]等,很少有考虑到用内部相(油脂相)的微结构制备来控制微胶囊体系,并且有的微胶囊制备过程中使用具有毒副作用的高分子如聚苯乙烯/单氟磷酸钠、TDI与1,6-己二胺等材料,大大限制了在食品中的应用[8]。为了解决这一问题,本研究将内部相微结构技术与微胶囊化技术相结合,将β-谷甾醇和γ-谷维素在植物油中混合以自组装成纳米级的管状晶体,管状晶体的聚集和交互作用能够构成空间网络结构,以固化脂肪酸。通过添加β-谷甾醇和γ-谷维素有望改善传统油脂粉末的缺点,阴离子多糖利用静电作用而添加到微胶囊外壳上能够有效延缓内容芯材的氧化,并抑制微胶囊在模拟消化条件下的消化率[9]。研究制备形成具有缓释特性的多糖微胶囊外壳,使微胶囊具备良好的保护性、缓释性和安全性,为食品中的功能因子和不稳定成分的靶向输送提供参考。
1 材料与方法
1.1 材料与试剂
谷维素、植物甾醇、α-淀粉酶、胃蛋白酶、胰酶、糖化酶胆盐、尿素、硫氰化钾、氯化钠、氯化钾、亚麻籽油、乳清蛋白粉。
1.2 仪器与设备
JB-3型定时恒温磁力搅拌器;YC-015喷雾干燥器;XP-201偏光显微镜;Delta-320 pH计;FJ-200高速分散均质机;JY-92超声波细胞破碎仪;GZX-9240数显鼓风干燥箱; S-4700扫描电子显微镜;LS-230激光衍射粒度分析仪;胶体点位测定系统。
1.3 实验方法
1.3.1 火龙果果皮多糖的制备
参考Dalonso等[10]方法制备火龙果果皮粗多糖。取火龙果果皮粗多糖(100 mg)溶于2 ml超纯水中,上样于DEAE-Cellulose 52柱(1.6 cm×60 cm)中,流速为0.6 mL/min,分别用超纯水、0.1 mol/L NaCl、0.2 mol/L NaCl、0.3 mol/L NaCl溶液依次洗脱,自动部分收集器每10 min收集1管,共收集100管,苯酚-硫酸法跟踪检测[11],得到洗脱曲线,合并主峰组分,超纯水透析24 h除去小分子盐,经冷冻干燥后得到火龙果果皮多糖的DEAE-Cellulose 52分离物。所得组分分别用Sephadex G-200凝胶柱(2.6×40 cm)分离。超纯水洗脱,流速0.6 mL/min,收集方法同上。获得组分分别命名为PPP-1、PPP-2、PPP-3和PPP-4(图1)。
1.3.2 火龙果果皮多糖微胶囊油脂粉末的制备
1.3.2.1 油相甾醇的结晶条件建立
将谷甾醇∶谷维素按照10∶0、8∶2、6∶4、4∶6、2∶8、0∶10的比例与亚麻籽油(1∶9)混合,在恒温水浴锅中加热至85 ℃,保温持续30 min后完全溶解谷甾醇和谷维素,制得油相,冷却至室温后将部分油脂转移到载玻片上,在偏光显微镜下观察其结晶现象,其余油脂置于离心管中观察其在室温条件下的状态[12]。
1.3.2.2 初级乳状液制备
初级乳液的制备曲桂芹等[13]的方法。将1%的乳清分离蛋白(WPI)溶于纯水中,室温下磁力搅拌1 h将其混合均匀制备成水相。将制备好的油相(其中谷甾醇 ∶谷维素为4∶6)与水相按质量比1∶9的比例于85 ℃水浴下混合均匀(体系总质量400 g),同时加入0.5%的吐温80作为乳化剂。利用高速混匀机于12 000 r/min下混合2 min混合3次。随后将混匀后的乳状液置于超声细胞破碎仪中,在500 W功率下处理5 min使其进一步混合均匀。最后在室温下加入谷氨酰胺转氨酶(25 U/g)作为固化剂,固化时间为2 h,最终得到初级乳状液PE-1。对照组制备方法为油相中不加入谷甾醇和谷维素,保持其他条件不变,得到空白初级乳状液PE-0。
1.3.2.3 二级乳状液制备
参考李进伟等[14]的方法,向制备好的初级乳状液(pH=7)中加入已经事先混合均匀的多糖溶液(PPP-3),使制备的二级乳状液中最终油相质量分数为5%,WPI质量分数为 0.45%,多糖质量分数为0.2%。在室温下将乳状液置于磁力搅拌器中搅拌30 min,然后用1 mol/L HCl调节乳状液的pH值至3.0,使多糖溶液与初级乳液通过静电吸附作用结合,从而获得二级乳状液SE-1。
1.3.2.4 油脂粉末的制备
将制备好的各乳状液用喷雾干燥器进行喷雾干燥,进样速度:5 mL/s,气流压力:0.25 MPa,进风温度:210 ℃,出风温度80 ℃,最终获得微胶囊化亚麻油粉末油脂。喷雾干燥完成后各样品分别命名PE-0、PE-1和SE-1。
1.3.3 微胶囊物化指标分析
微胶囊形态特性分析参考文献方法应用扫描电子显微镜观察微胶囊粉末油脂的表面形态结构[15]。微胶囊粉末油脂含水量和溶解度的分析参考Wu等[16]的方法。微胶囊粉末油脂包埋率的测定分析参考Santos等[17]的方法。微胶囊粉末油脂流动性和粉末分层系数分析采用Rossier-Miranda等[18]的方法。
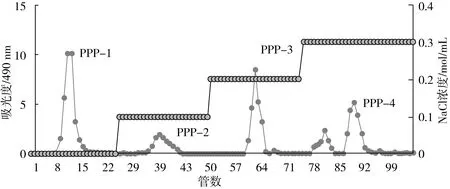
图1 火龙果皮粗多糖在DEAE-Cellulose 52柱的洗脱曲线
1.3.4 微胶囊粉末油脂平均粒径和Zeta电位分析
应用Malvern MasterSizer 2000进行悬浮液中颗粒的粒径分布测定,并结合使用双波长检测系统来提高仪器测定过程中尺寸的性能以及其灵敏度。测量前将适量微胶囊油脂粉末样品分散于水中,用超声波清洗仪处理5 min使样品均匀分散,在25 ℃条件下测量复溶后微胶囊油脂粉末形成的乳液中悬浮颗粒的粒径和电位[19]。
1.3.5 储藏过程中酸价和氧化值(POV)的变化分析
酸值是对油脂中游离脂肪酸含量进行评价的重要指标,游离脂肪酸是油脂败坏的重要底物,总的来说酸值越低油脂的质量越高。对于富含不饱和脂肪酸的亚麻籽油来说,储藏时保持样品的稳定性是衡量微胶囊化技术成果的重要指标。在油脂败坏的前期,POV值的高低可以直接反映油脂氧化情况的高低。参考GB/T 5009.37—2003的分析方法对60 ℃储藏21 d的酸值和氧化值(POV)进行了分析测定。
1.3.6 体外消化特性的分析
为了测定油脂粉末在体内的消化情况,针对所选材料和需求建立了体外消化模型。结合人体消化的过程将该体外模型分成了3个主要阶段:模拟口腔液(SSF)阶段、模拟胃液(SGF)阶段和模拟小肠液(SIF)阶段。模拟口腔阶段的消化参考万红霞等[20]的方法。模拟胃阶段的消化参考Beysseriat等[21]的方法。模拟小肠阶段的消化参考曲桂芹等[13]的方法。
消化过程中粒径的变化分析采用Yang等[22]的方法。在整个模拟消化的过程中跟踪检测最初的粒径以及经过模拟口腔和胃、模拟肠30、60、90 min以及最终消化完成后得到的粒径,并分析其分布变化。
2 结果与分析
2.1 谷甾醇和谷维素在油脂中的结晶现象
谷甾醇和谷维素在油脂中的结晶偏光显微镜观察结果如图2所示。谷甾醇浓度越高油脂冷却后形成的结晶越大,随着谷甾醇浓度的降低,冷却后油脂形成的结晶越小且流动性逐渐升高,当谷甾醇含量为0时油脂几乎没有任何结晶行为,当谷甾醇 ∶谷维素为4∶6时油脂呈现为良好的半固体状态。
2.2 微胶囊粉末形态观察
扫描电子显微镜结果如图3所示。PE-0呈现出不规则黏连严重的颗粒状,而PE-1和SE-1则呈现出较为规则球状,这表明喷雾干燥前在乳化过程中加入适宜比例的谷甾醇和谷维素可明显使喷雾干燥后的油脂颗粒变小,并且形态上呈现出更均匀规则的状态。在乳化过程中加入多糖溶液可明显使油脂微胶囊表面的微孔结构减小,这些孔洞的形成可能与喷雾干燥水分的流失有关[23],也有可能是因为多糖的加入增加了交联反应使外壳的空洞结构变小[18]。
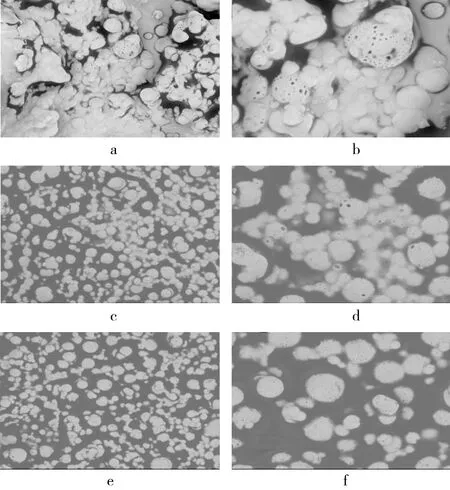
注:a、b分别为PE-0放大2 000、5 000倍;c、d分别为PE-1放大2 000、5 000倍;e、f分别为SE-1放大2 000、5 000倍。图3 不同样品的扫描电子显微镜图
2.3 微胶囊油脂粉末的理化指标
复溶后的微胶囊油脂粉末理化指标如表1所示,PE-0的含水量和分层系数要高于其他两种油脂粉末,这可能是因为谷甾醇和谷维素的加入增加了体系的稳定性。并且PE-0的流动性要明显高于PE-1和SE-0,这可能是因为PE-0的颗粒没有其他两种那样呈现均匀规则的状态有关。其他各项指标基本无明显差异。
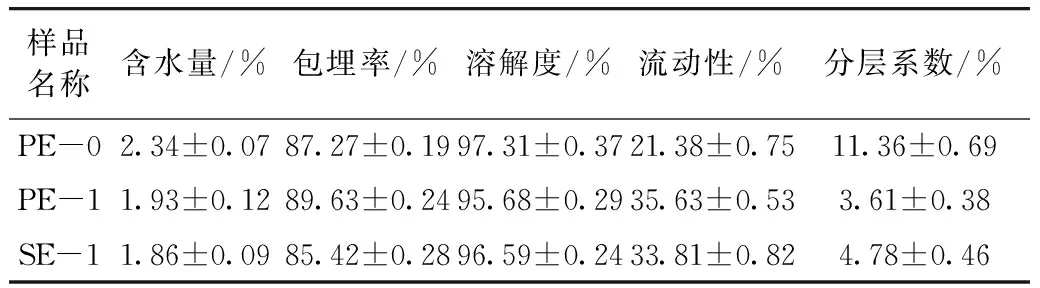
表1 复溶后微胶囊油脂粉末理化指标
2.4 微胶囊油脂粉末粒径和Zeta电位的结果分析
对于乳液而言,Zeta电位越高乳液就越稳定[24]。对比PE-0和PE-1可知,甾醇和谷维素的加入可以改变微胶囊粉末的平均粒径而不能改变其电位,结合扫描电子显微镜结果,推测这是因为谷甾醇和谷维素能作用于微胶囊内部,改变微胶囊黏连不均一的状态,从而使平均粒径减小。由SE-1粒径和电位的变化推测可知酸性多糖的加入成功的完成了二次包埋,即在原有基础上成功在蛋白外壳上包裹了多糖改变了其带电性使外壳变厚,使其稳定性增强。表2表明在亚麻籽油微胶囊化过程中加入适宜比例的谷甾醇、谷维素和多糖能够明显提高其稳定性。

表2 复溶后微胶囊油脂粉末的平均粒径和电位
2.5 储藏过程酸价和POV值的变化
油脂会因为微生物、酶、光照或加热而发生水解生成游离的脂肪酸,游离脂肪酸会严重影响油脂的质量,酸价越低样品越不易败坏。由图4a可知,起始阶段3种样品会因加工酸价而略微高于亚麻籽油自身的酸价,未包埋的亚麻籽油酸价在60 ℃储藏时会由0.04 mgKOH/g快速增加到2.32 mgKOH/g,而包埋的亚麻籽油微胶囊酸价会明显降低,SE-1的酸性多糖和蛋白外壳能有效阻隔亚麻籽油与外界环境的接触,保护亚麻籽油使其酸价变化减弱,即酸性多糖和蛋白外壳能有效延缓亚麻籽油的氧化败坏。
油脂氧化时过氧化物的生成速度大于游离脂肪酸的生成速度,过氧化物是油脂氧化酸败过程的中间产物[25]。油脂的过氧化值是用来测定油脂中氢过氧化物含量的指标,过氧化值越高则储存过程中所生成的氢过氧化物含量越高,即过氧化值的升高意味着不饱和脂肪酸产品的酸败。根据国标规定含少量多不饱和脂肪酸含量的油脂,过氧化值不能超20 meq/kg,而对于含有较多不饱和脂肪酸的如菜籽油,过氧化值的允许上限为12 meq/kg[26]。由图4b可知,在60 ℃储藏条件下,3种样品的过氧化值都随着储藏时间而升高,但是都要低于亚麻籽油的POV值变化,说明3种样品都能延缓亚麻籽油的氧化速度。在21 d储藏结束时PE-0的POV值达到了27.31 meq/kg,已经超过了国标要求,而其他2种油脂微胶囊粉末的POV值均低于国标规定。
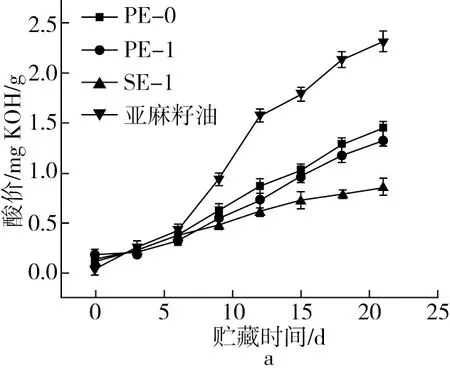
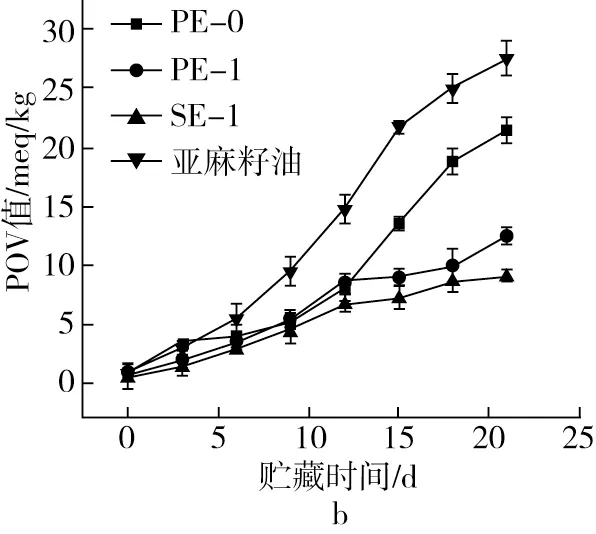
图4 60 ℃储藏条件下样品酸价和POV值变化趋势
2.6 微胶囊油脂粉末的体外模拟消化
PE-0、PE-1、SE-1在胃中消化的结果如图5所示,由消化的最终显微镜观察结果可知,PE-0经胃消化发生了大片凝聚现象,PE-1虽无凝聚现象发生,但与SE-1相比形成的油滴更大,这可能是因为胃酸的消化使PE-0外壳结构最先被破坏,并发生凝集,而多糖的加入可明显延缓外壳的消化破坏,使最终出现的油滴减少并变小。

注:a、b、c分别为PE-0、PE-1、SE-1;1~3分别表示消化20、40、60 min。图5 不同样品在模拟胃中的消化情况
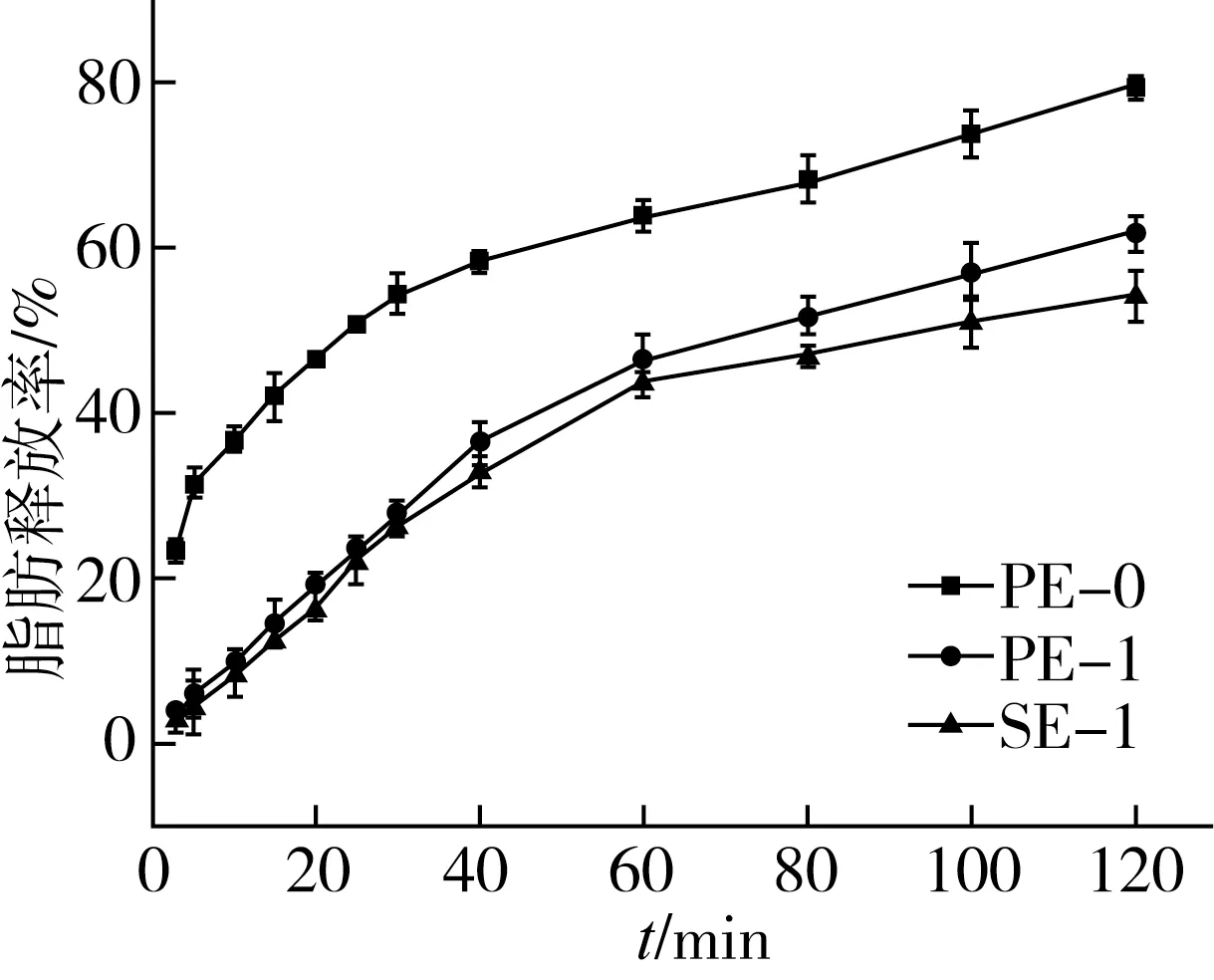
图6 模拟肠道阶段脂肪酸释放率
由图6可知不同样品在模拟肠道阶段消化速率和消化程度有明显差异。PE-0的ALA释放率最终为(81.2±0.8)%,明显高于PE-1和SE-1,而PE-1高于SE-1,表明SE-1的消化率要明显低于其他两者。这是因为多糖会在油滴表面形成界膜,会抑制脂肪酶和油脂的接触。其次,油脂的消化过程是一种界面反应,多糖的加入会使粒径增加(表2)相应的比表面积减少[27],从而使脂肪酶与油脂接触面积减少。此外,带负电的多糖也可能抑制带负电的脂肪酶与油脂接触[28],降低消化速率。对比3种样品在开始阶段(5 min)的释放率可推测由于胃消化作用而有一部分油脂被释放出来,PE-0经胃消化脂肪释放率最高,而多糖、甾醇和谷维素的加入可明显延缓脂肪的释放,这与体外模拟消化的结果相符,表明了加入了多糖、甾醇和谷维素的SE-1微胶囊油脂粉末具有耐胃消化和缓释的作用。
模拟消化过程中粒径的变化情况可以直接反映样品的消化状态,3个样品分别经口、胃以及在肠道中经30、60、90、120 min消化过程中粒径随着消化时间的延长,各样品的粒径都呈现出不同程度的增长,与PE-0、PE-1相比,SE-1的最终消化粒径要明显小于其他两者并且SE-1在整个消化过程中粒径的均一性要明显高于其他两者,证明SE-1具有一定的缓释作用。
3 结论
本研究建立了甾醇、谷维素在常温下改变亚麻籽油流动性的条件(甾醇 ∶谷维素=4∶6),使其由液体转变为半固体状态。WPI和PPP-3为外壳,吐温80做乳化剂,谷氨酰胺转氨酶做固化剂制得3种不同的微胶囊油脂粉末PE-0、PE-1、SE-1。通过复溶后平均粒径和Zeta电位、高温保藏酸价、POV值分析及体外模拟消化实验,结果表明,酸性多糖PPP-3外壳包载有亚麻籽油的微胶囊粉末具有很好的理化性能并能显著延缓亚麻籽油在储藏期间的氧化败坏,未包埋的亚麻籽油酸价在60 ℃储藏时会快速的由0.04 mg/mL增长到2.32 mg/mL,而包埋的亚麻籽油微胶囊酸价会明显降低。在模拟肠道阶段消化速率和消化程度有明显差异。SE-1由于带负电的多糖排斥带负电的脂肪酶与油脂接触,SE-1的ALA释放率(49.6±0.6)%要明显低于PE-0的ALA释放率(81.2±0.8)%,表明制备的SE-1具有良好的靶向控释特性。
研究结果和思路对防止脂肪酸的氧化,降低脂肪酸氧化造成的食品安全风险,开发脂肪酸油脂粉末等功能性食品添加剂及包载具有特殊功能的不稳定食品功能因子,实现可控缓释具有很好的参考价值和借鉴意义。
——基于正交试验优化的皂化反应法△

