PHF7 在人精子中相互作用蛋白分析
曹梦阳 林浩成* 姜 辉*
1. 北京大学第三医院泌尿外科(北京 100191)2. 北京大学第三医院生殖医学中心(北京 100191)3. 北京大学第三医院男科(北京 100191)4. 北京大学第三医院人类精子库(北京 100191)
约15%的育龄夫妇受到不孕不育的困扰, 其中男性因素导致的不育约占50%[1]。 男性不育症是由多种疾病和因素造成的结果, 但超过一半的男性不育患者无法找到明确的病因,临床上称为特发性男性不育,目前认为其发病与遗传和环境等因素有关。 因此,从分子遗传学的角度精确的阐释生精功能障碍的发病机制,是未来治疗特发性男性不育症的基础。 植物同源结构域指蛋白7(PHD finger protein 7,PHF7)属于RING 型泛素连接酶家族,在人和小鼠的睾丸组织中特异性表达[2]。PHF7 在2002 年被首次报道,Junhua Xiao 等研究了一例PHF7 基因缺陷的生精阻滞患者,认为其具有转录调控及调节精子发生的作用[3]。 2012 年,Shuyuan Yang 等发现,PHF7 可以调控果蝇性别分化过程, 这种调控作用可能与其识别组蛋白甲基化修饰H3K4me2 有关[4,5]。在本研究中,我们在体外表达GST-PHF7 融合蛋白,筛选其在人精子中的相互作用蛋白, 并通过生物信息学方法对其进行富集,从蛋白质层面探明PHF7 及其互作蛋白在精子发生中的调节通路,为进一步研究PHF7 及其互作蛋白的调控网络和分子机制打下基础, 并为基因突变引起的男性不育的诊断和治疗提供理论依据。
材料与方法
一、GST-PHF7 表达载体的构建
全基因合成少量质粒作为模板, 设计引物Plasmid-PHF7-F ( 序 列5'—3':GATCTGGTTCCGCGTGGATCCATGAAGACTGTAAAAGAAAAGAAG) 及Plasmid-PHF7-R ( 序 列 5'—3':GTCACGATGCGGCCGCTCGAGTTACTTGGATTTTTTGCAGC) 并 使 用PrimeSTAR 高保真酶(Takara,R045A)扩增目的基因,反应条件:96℃20s,60℃30s,72℃1min, 共30 个循环。 PCR 产物经1%琼脂糖凝胶电泳后,切取含目的基因片段的条带,使用DNA 回收试剂盒(生工,B518131)回收DNA 目的片段,得到目的基因PCR 产物。
取5μg 的pGEX-4T-1 载体, 用BamHI 和XhoI 在37℃双酶切30min,电泳回收载体片段。 按照如下方案配置目段片段与载体连接的反应体系:pGEX-4T-1 载体片段100ng,PHF7 PCR 产物100ng,5x CE II Buffer 4μL,ExpressII (诺唯赞,C112-2)2μL,ddH2O 补充到20μL。 37 ℃连接30min 后, 取10μL 连接产物至100 μL Stbl3 感受态细胞中冰浴30 min,42 ℃水浴60s,然后快速将其转移至冰浴中2~3 min。 加入300μL LB 培养基,37℃振荡培养1 h,将菌液均匀涂布于含Amp 抗生素(100 μg/mL)的LB 平板上,室温下放置,至液体吸收。倒置平板,转移入37 ℃生化培养箱过夜培养。挑选菌落进行PCR 鉴定阳性转化,菌落PCR 鉴定得到的阳性克隆,送测序公司进行测序验证。 经测序验证正确的阳性克隆进行质粒小提(生工,B518191)。
二、GST-PHF7 融合蛋白的表达与纯化
挑取表达GST 标签重组蛋白的单克隆, 接种到3mL 含Amp 抗生素的LB 培养液中,培养过夜。 按照1:100 的比例取培养过夜的菌液,接种到预热至37℃并含Amp 抗生素的LB 培养液中,37℃常规培养60min至菌液的OD600 达到0.6 左右。 将菌液在冰上静置,加入IPTG 至终浓度为0.5mM 28℃进行诱导。 收集菌液至离心管中,4℃1500g 离心3min, 弃上清, 收集沉淀。 以PBS 50 倍体积进行浓缩。1000pa 压力进行压力破碎,共重复7 次。 1500g 离心20min,取上清进行后续纯化。
将制备好的含有GST 融合蛋白的澄清细胞裂解液加入到层析柱中,流速控制为10~15cm/h。 裂解液全部流出层析柱后就立刻加入1×PBS 清洗柱子, 所需量大约为柱体积的20 倍。 用10~15 倍柱体积的现配10mM谷胱甘肽洗脱液 (0.154g 还原性谷胱甘肽溶于50 mL 50 mM Tris-HCl,pH 8.0) 洗脱融合蛋白。 分别吸取20μLGST 融合蛋白原液、流出液、洗涤液和洗脱液,通过SDS-PAGE 电泳分析各样品, 确定是否存在标签蛋白。洗脱液通过分子筛(30Kda 超滤管)去除游离的谷胱甘肽并浓缩。
三、精子总蛋白提取
收集2018 年10 月到11 月在北京大学第三医院男科精液检查室的精液废弃标本,根据WHO《人类精液检查与处理实验室手册》第五版[6],筛选出精子浓度和活力均正常的精液标本。 取15mL 离心管,依次加入2mL 90% percoll,45% percoll 和液化精液, 保持各液体之间的界面清晰,300 g 离心20 min。 去上清后用PBS清洗细胞沉淀2 次,向其中加入蛋白裂解液(已加蛋白酶抑制剂),冰上裂解15min,500g 4℃离心15min,取上清到新的EP 管中即为精子总蛋白。
四、GST pull-down 实验
取GST 空载菌和GST-PHF7 菌, 加入PBS 溶液,涡旋震荡混匀,4℃1500g 离心5min,去上清,重复洗涤沉淀两次。 加入裂解液,吹打混匀后冰上裂解,5%功率超声5min。 4℃1500g 离心15min,上清转移到新的EP管中,做好标记,从每管中取50uL 作为input。取适量树脂到EP 管中, 加入1mL 细胞裂解液, 室温漂洗2min,500g 4℃离心5min,去掉液体,在漂洗两次后,加入上清,在EP 管上做好标记,命名为GST 组+精子蛋白、GST-PHF7 组+裂解液、GST-PHF7 组+ 精子蛋白,放入4℃混匀仪上孵育2h。 从4℃混匀仪上拿出树脂,4℃500g 离心5min,去上清,向树脂中加入1mL 裂解液, 放混匀仪上, 室温漂洗5min 后,4 ℃500g 离心5min,去上清重复漂洗两次。 将提取的精子细胞蛋白加入到相应的树脂组别中,放4℃混匀仪上孵育过夜。 孵育完毕后4℃500g 离心3min,弃上清。 将树脂用裂解液洗3 次, 用新鲜配置的20mM 还原性谷胱甘肽洗脱15min。 4℃1500g 离心5min,上清即为pull-down 产物。将3 组pull-down 产物进行质谱检测。
五、质谱检测与生信分析
将样品进行质谱检测,获取与PHF7 特异结合的蛋白序列和分子量等信息, 该部分委托广州骏辉生物科技有限公司完成。 使用Gene Ontology 数据库(https://www.ebi.ac.uk/QuickGO/)进 行GO 富 集 分 析[7]; 使 用KEGG pathway 数 据 库(https://www.kegg.jp/kegg/pathway.html)信号通路富集分析[8];使用在线软件Omics-Bean(http//www.omicsbean.cn)作图。
实验结果
一、GST pull-down 实验与质谱分析
GST 组+ 精 子 蛋 白、GST-PHF7 组+ 裂 解 液、GST-PHF7 组+ 精子蛋白三组pull-down 产物SDSPAGE 结果如图1 所示,可见GST-PHF7 组+精子蛋白组与另外两组条带有明显差异。 结果表明,本次实验用诱饵蛋白成功钓取了精子细胞中的结合蛋白。 将pull-down 产物进行质谱检测, 质谱得到的GST-PHF7的结合蛋白除去GST 对照组鉴定的蛋白后, 共鉴定到75 个直接或间接相互作用的蛋白。 对这些蛋白进行注释,注释出组蛋白及其变体、转录因子、氧代谢相关蛋白等。

图1 GST pull-down 实验考染胶图
二、PHF7 相互作用蛋白的GO 富集分析
对质谱得到的蛋白依次从生物学过程(Biological Process,BP),细胞组分(Cellular Component,CC)和分子功能(Molecule Function,MF)层面进行GO 功能富集分析,共注释出BP 条目2273 个,其中有统计学意义的条目(P<0.05)1377 个;注释出CC 条目375 个,其中有统计学意义的条目(P<0.05)236 个; 注释出MF 条目401 个,其中有统计学意义的条目(P<0.05)240 个。 各自取可信程度最高(根据P 值排列)的10 个条目,结果如图2 所示。
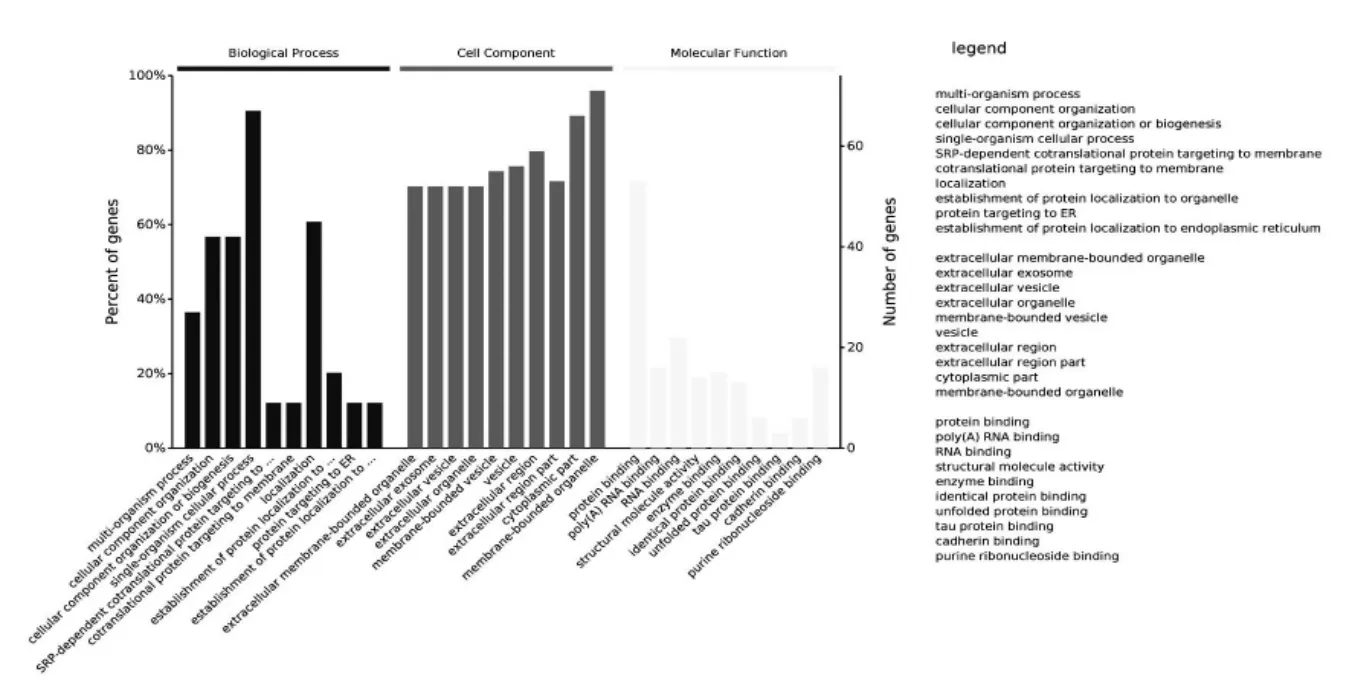
图2 PHF7 互作蛋白在生物学过程、细胞组分和分子功能层面的富集分析
PHF7 互作蛋白涉及到蛋白运输(intracellular protein transport),细胞内定位(cellular localization),药物代谢(Drug metabolic process)和分解代谢(Catabolic process)等多个生物学过程,根据P 值筛选出可信度最高的10 个条目绘制气泡图如图3 所示。 PHF7 互作蛋白所涉及的分子功能在level 4 水平上,富集蛋白最多的是细胞器复合体代谢(Organonitrogen compound metabolic process)和运输(transport)的分布如图4 所示。 每个蛋白可能同时分属不同的生物学过程, 若将每个蛋白依据P 值大小归到可信程度最高的条目下, 涉及蛋白最多的条目是药物代谢(Drug metabolic process),其分布如图5 所示。
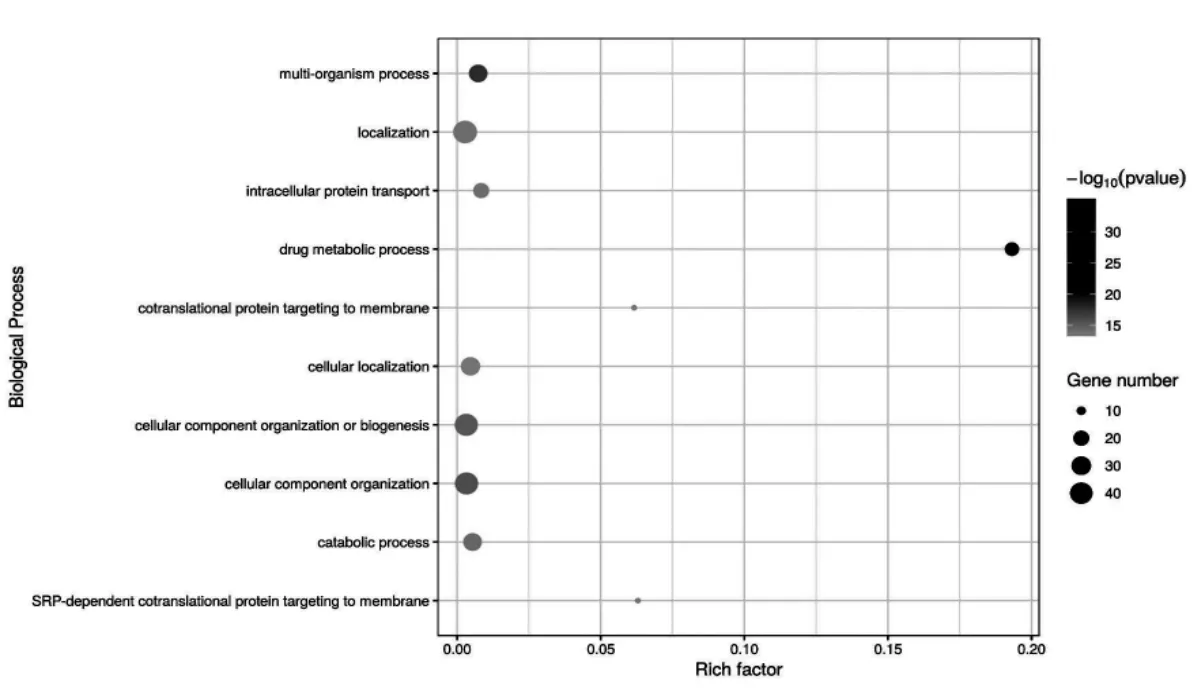
图3 PHF7 互作蛋白涉及的可信度最高的10 个生物学过程
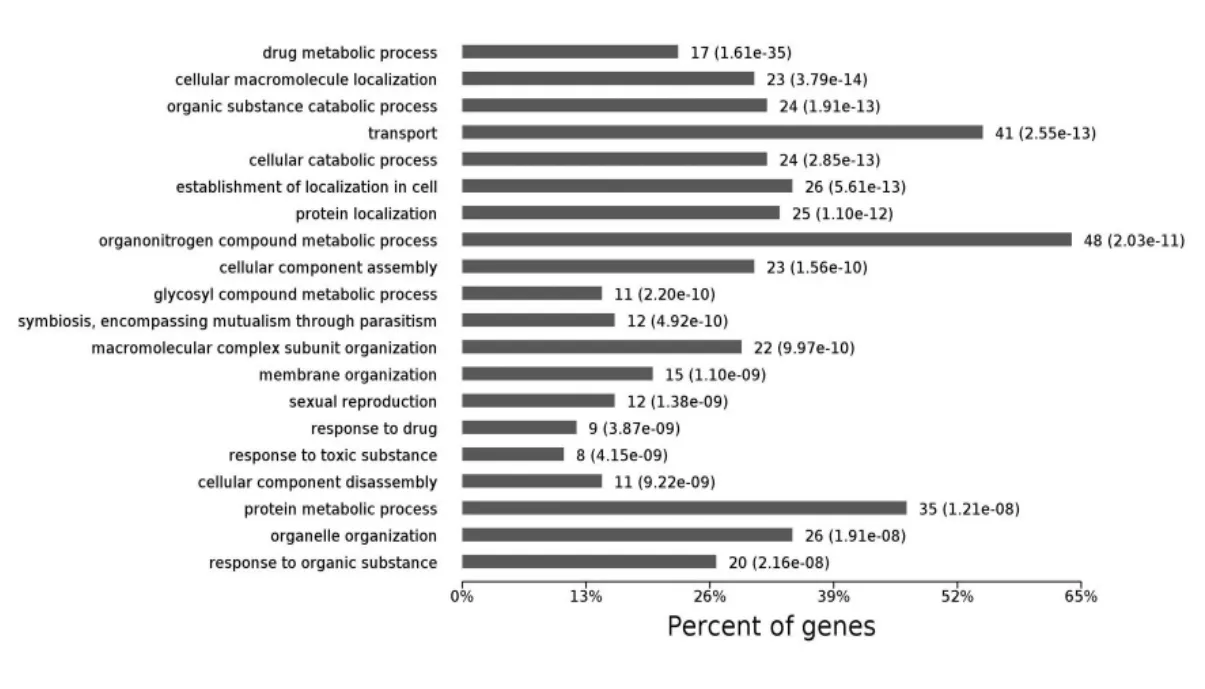
图4 PHF7 互作蛋白涉及的生物学过程在level4 水平上的分布
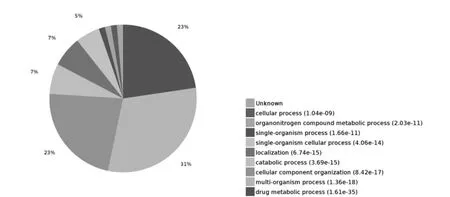
图5 PHF7 互作蛋白涉及的生物学过程分布饼图
PHF7 互作蛋白主要定位在各种胞内细胞器(intracellularvesicle),细胞质(cytoplasm),囊泡(vesicle),外泌体(extracellular exosome)等,涉及胞内蛋白运输和分泌的多个环节, 这些细胞成分在level4 水平上的分布如图6 所示。每个蛋白可能同时分属不同的细胞成分条目,若将每个蛋白依据P 值大小归到可信程度最高的条目下,64%的蛋白定位于胞外膜界细胞器(Extracellular membrane-bounded organelle),其次是胞质(cytoplasm),其分布如图7 所示。
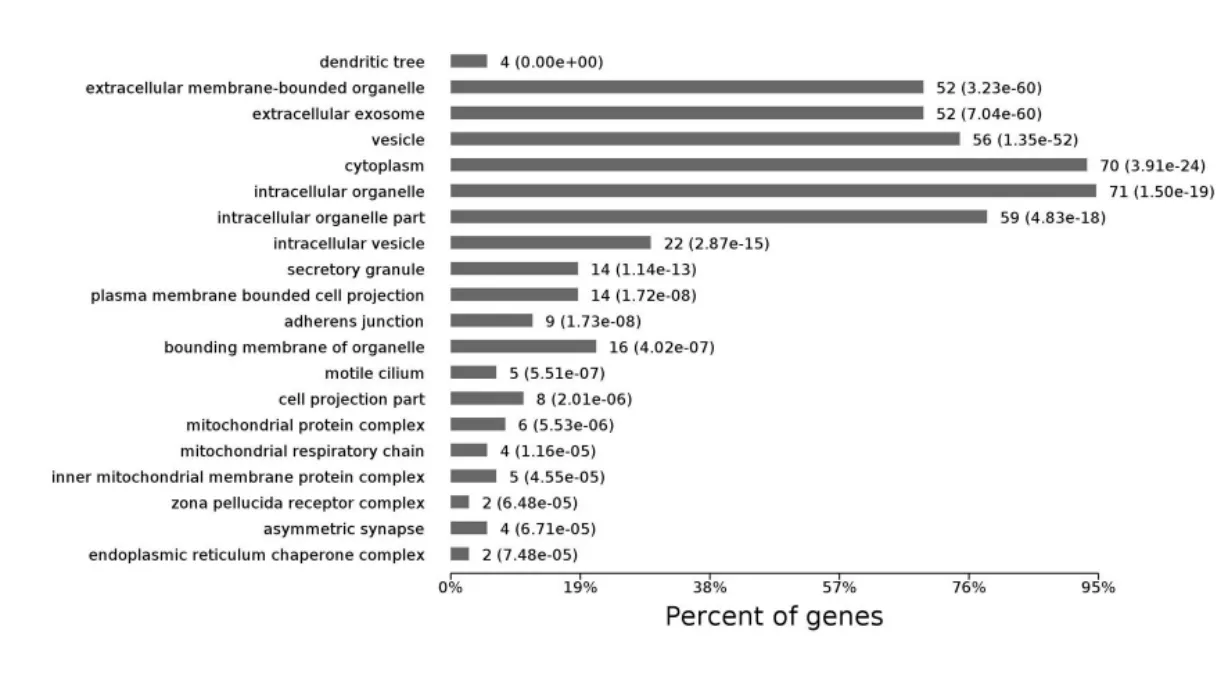
图6 PHF7 互作蛋白所涉及的细胞成分在level4 水平上的分布
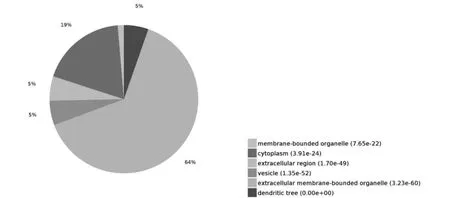
图7 PHF7 互作蛋白所涉及的细胞成分分布饼图
PHF7 互作蛋白涉及到蛋白结合(protein binding),RNA 结合(RNAbinding)和酶结合(enzymebinding)等分子功能, 根据P 值筛选出可信度最高的10 个条目绘制气泡图如图8 所示。 PHF7 互作蛋白所涉及的分子功能在level 4 水平上的分布如图9 所示,识别与结合核酸是其主要分子功能。每个蛋白可能同时分属不同的分子功能条目,若将每个蛋白依据P 值大小归到可信程度最高的条目下,71%的蛋白分子功能被归类于蛋白结合,其分布如图10 所示。
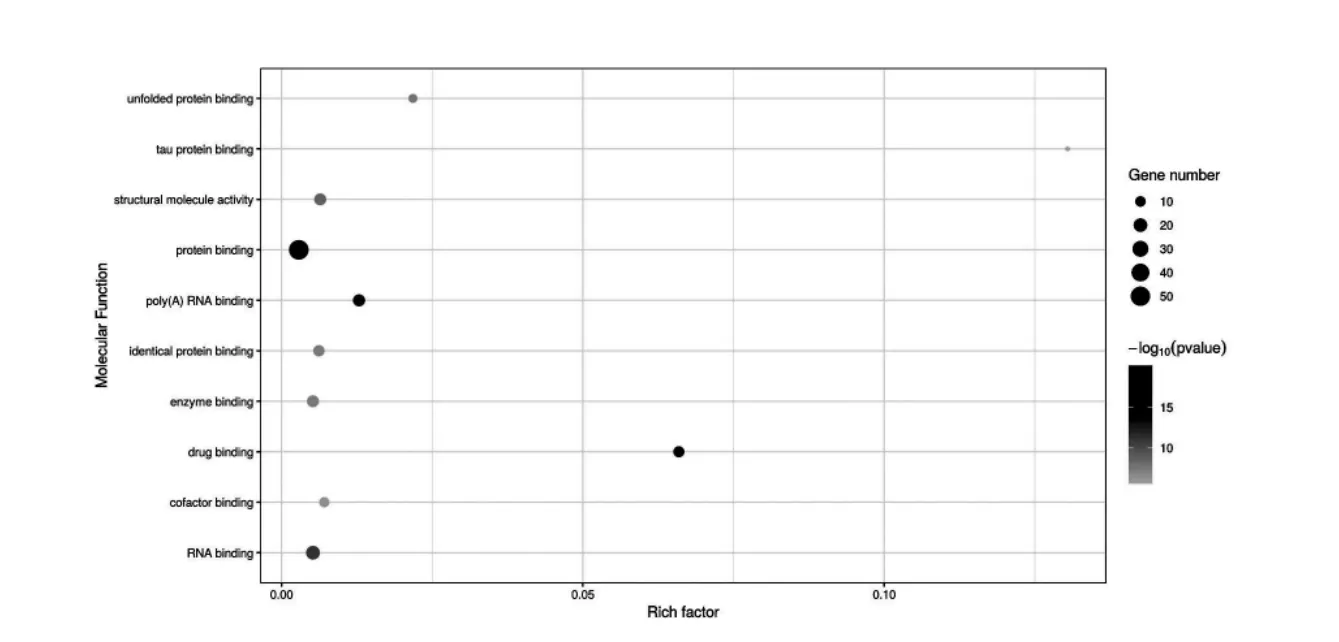
图8 PHF7 互作蛋白涉及的可信度最高的10 个分子功能

图9 PHF7 互作蛋白分子功能在level4 上的分布
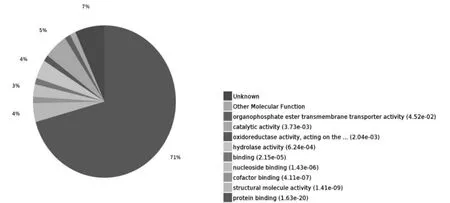
图10 PHF7 互作蛋白所涉及的分子功能分布饼图
三、PHF7 相互作用蛋白的KEGG 分析
KEGG 数据库中,信号通路分为以下6 个亚类:代谢(metabolism);遗传信息处理(genetic information processing);环境信息处理(environmental information processing);细胞过程(cellular processes);生物体系统organismal systems)和人类疾病(human diseases)。 PHF7互作蛋白共注释出KEGG 通路118 条, 其中有统计学意义的通路(P<0.05)27 条,其分布如图11 所示。 结果表明,这些蛋白涉及代谢,遗传信息处理,生物体系统和人类疾病4 个亚类, 富集基因较多的通路有代谢大类中的代谢通路(metabolic pathways),糖代谢(glycolysis),氧化磷酸化(oxidative phosphorylation)等,在遗传信息的处理大类中涉及核糖体(ribosome),在人类疾病中涉及帕金森病,阿尔茨海默症和亨廷顿舞蹈病等。 可信度最高的十条富集通路根据P 值从小到大排列依次是 核 糖 体 (ribosome), 丙 酮 酸 代 谢(pyruvate metabolism),大肠埃希菌感染(Pathogenic Escherichia coli infection),帕金森病(Parkinson’s disese),氧化磷酸化 (Oxidative phosphorylation), 代 谢 通 路(metabolic pathways), 亨廷顿病 (Huntington’s diaease), 糖代谢(glycolysis),药物代谢(drug metabolism),阿尔茨海默症(Alzhemer’disease),绘制气泡图如图12。 KEGG 结果表明,PHF7 在精子中的相互作用蛋白要参与了细胞代谢和遗传信息处理的多种信号通路。
讨 论
蛋白相互作用的研究是揭示蛋白作用机制的重要手段,之前的针对果蝇的研究中,我们对PHF7 在精子发生中的作用有了初步的了解。尽管PHF7 基因在不同物种之间的序列高度保守,但PHF7 在果蝇和哺乳动物中的位置及表达模式等差异很大, 哺乳动物和人类的生精过程调节机制也更为复杂,PHF7 在精子发生中的具体分子机制尚不清楚。 因此, 我们构建质粒并表达GST-PHF7 融合蛋白,通过体外实验钓取其在人精子中的互作蛋白,并通过生物信息学方法分析其富集通路,为进一步研究PHF7 在精子发生中的作用机制提供探索方向和理论基础。
GST pull-down 法和免疫共沉淀法是筛选细胞内与已知蛋白和位置蛋白相互作用的经典方法。 GST pull-down 法是将GST-PHF7 融合蛋白作为探针固定到凝胶柱上,与精子细胞总蛋白中的目的蛋白结合。 由于体外实验不同于细胞内的生理环境, 部分蛋白可能会由于分子力或者电荷相互作用与融合蛋白结合; 部分蛋白虽能与PHF7 直接相互作用,但由于在精子细胞内的空间分布不同,生理环境下无法直接接触,这些因素可能会造成假阳性[9]。 免疫共沉淀法可以分离得到天然状态下相互作用的蛋白复合体, 这种蛋白复合体不一定是蛋白与蛋白之间的直接结合, 可能有其他蛋白在中间起桥梁作用使无关蛋白与其间接结合, 从而造成假阳性。 本研究同时进行了免疫共沉淀实验和GST pull-down 实验,经过考马斯亮蓝染色验证,现有抗体无法在自然状态下拉下PHF7 相互作用蛋白复合体,而GST pull-down 法则成功钓取PHF7 蛋白复合体, 故本研究使用GST pull-down 实验产物进行质谱检测和进一步分析。 本次共鉴定出75 个与PHF7 直接或间接相互作用蛋白, 其中大部分未被已知的STRING 蛋白相互作用数据库收录[10]。
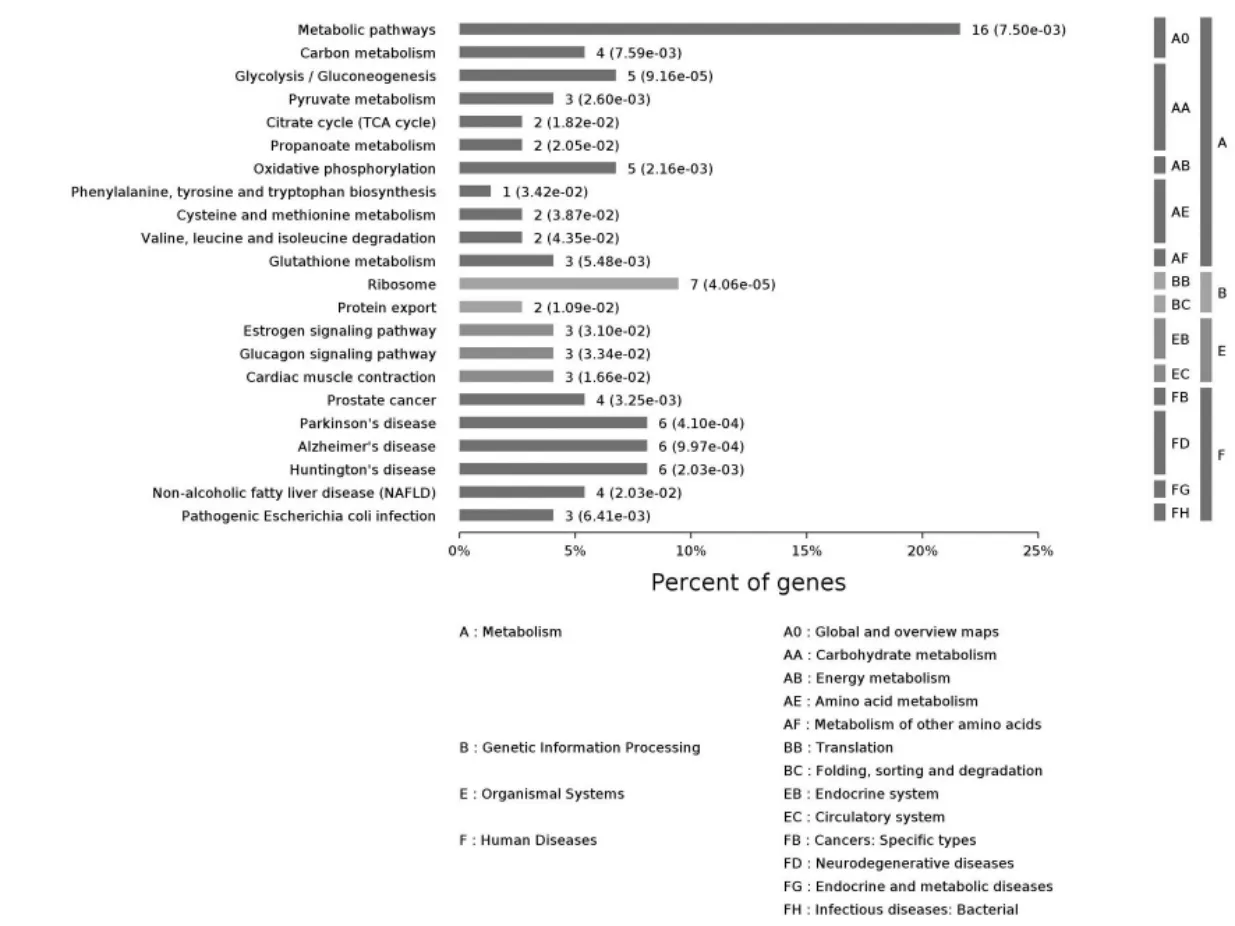
图11 PHF 互作蛋白在KEGG 数据库中的富集通路
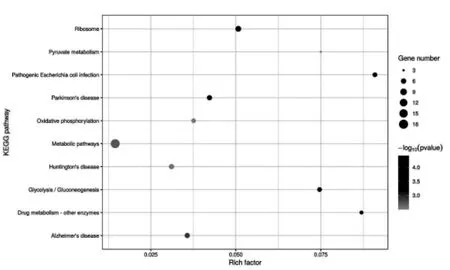
图12 PHF 互作蛋白富集通路气泡图
GO 功能富集和KEGG 代谢通路注释是蛋白质组学研究的重要方法,PHF7 的互作蛋白被显著富集在数个功能和代谢通路中, 为进一步验证其在精子发生中的功能提供了研究方向。 GO 富集分析的结果表明,PHF7 的互作蛋白在细胞组分上定位在从胞内细胞器、囊泡到细胞膜上, 涉及细胞器代谢和蛋白运输等生物学过程,这和其在泛素-蛋白酶体系统中的定位是一致的[11]。 精子发生后期,圆形的单倍体精子细胞将经历一系列的变形过程, 最终形成成熟精子。 精子形成过程中,组蛋白先被过渡核蛋白替代,然后又被鱼精蛋白所取代。 其中一个关键的过程是组蛋白,过渡蛋白等关键蛋白的胞内定向运输和降解。 这次注释出的组蛋白及其变体,核糖体蛋白RPL,翻译起始因子eIF,和热休克蛋白HSP 家族等,均参与了精子发生过程中蛋白合成,运输和代谢过程[12,13]。 这在一定程度上暗示了PHF7 及其互作蛋白可能的调节机制, 即在关键蛋白的装配和运输上发挥作用。 在分子功能上,PHF7 的互作蛋白注释出了酶结合,蛋白结合和核酸结合的条目,这和其在表观遗传学层面调节精子发生的功能是相符合的[14,15]。在KEGG 的信号通路注释中,PHF7 互作蛋白大多富集在各种代谢通路上,包括氧化磷酸化,丙酮酸代谢和糖代谢等, 这些关键蛋白的缺失均会影响生精功能[16,17]。考虑到PHF7 的互作蛋白有约10%富集在线粒体代谢复合体和呼吸链上, 对精子细胞能量代谢的影响可能是其另一种作用机制。 同时我们发现,PHF7 基因敲除小鼠的精子活力明显下降(数据未发表),PHF7 基因缺失影响了精子线粒体代谢是一种可能的解释。 此外,KEGG 的结果提示部分蛋白(NDUFS7,UQCR,ATP5F等) 可能与神经系统疾病如帕金森病和阿尔茨海默症等有关, 在这些神经系统疾病中这些基因的表达也表现出不同程度的相关性[18-20]。 考虑到PHF7 在脑组织中也有少量表达,而一些基因如DJ-1 也可同时涉及神经系统疾病和男性不育[21],PHF7 及其互作蛋白在神经系统中也可能发挥一定的调节作用。 但由于本实验存在着一定的假阳性可能, 富集在神经系统疾病通路的基因相比于背景基因也并不多,PHF7 及其互作蛋白是否能在神经系统中发挥作用仍待进一步的确认。

