原发性盆腔孤立性纤维性肿瘤1 例报告并文献复习*
欧龙华 魏正茂 李维清 王 燕 周颖琛 梅红兵 史本涛**
1.深圳市第二人民医院(深圳大学第一附属医院)泌尿外科(深圳518035)2.北京大学深圳医院泌尿外科; 3.新疆克拉玛依市中心医院4.中国医学科学院阜外医院深圳医院泌尿外科
孤立性纤维性肿瘤 (SFT) 是一种罕见的起源于CD34 阳性的树突状间叶细胞肿瘤, 具有分化潜能,多数为良性,少数为恶性[1],原发于盆腔的SFT 较为罕见,术前诊断困难,2018 年12 月深圳市第二人民医院泌尿外科收治1 例原发性盆腔SFT 患者,现报道如下。
一、病例资料
患者,男,35岁,因“发现PSA 升高11 天”于2018年12 月25 日就诊于深圳市第二人民医院, 患者无发热,无尿频、尿急、尿痛及肉眼血尿,无腰部胀痛。 既往无特殊病史。 体格检查:直肠指检:直肠右侧壁可及一肿物顶起,未能触及上界,表面光滑,质地韧,无触痛。辅 助 检 查:TPSA 6.61ng/ml↑,CPSA5.93ng/ml,FPSA/TPSA 0.1↓,入院影像学检查:盆腔MR 增强提示前列腺右侧外周带旁见一大小约48×50mm 类圆形肿块,边界清楚,有包膜,与前列腺分界清楚,信号欠均匀,增强扫描渐进性强化,考虑肿瘤性病变,良性- 中间型可能。 盆腔CT 平扫+增强:前列腺右侧旁见软组织密度影,密度欠均匀,病灶内未见明显血管走行,增强扫描病灶明显持续强化; 膀胱及前列腺未见异常强化灶及占位性病变(图1)。术前穿刺病理:(右侧叶结节第11、13、14 针穿刺活检组织) 结合组织形态学及免疫组化结果提示孤立性纤维性肿瘤。 患者于2019 年1 月25日在全身麻醉下行阴腹联合腹腔镜下盆腔肿物切除术, 术中见肿物位于前列腺右侧叶旁, 大小约5X5X5cm,肿瘤表面血管丰富,肿瘤紧贴前列腺,与前列腺、 盆底肌及直肠壁周围粘连, 完整切除肿瘤后送检,标本肉眼观:肿物有包膜,切面灰黄灰白、质中。 组织形态学:形细胞增生,细胞呈波浪状、席纹状或束状排列, 核呈梭形或卵圆形 (图2A)。 免疫组化病理:STAT6(+),CD34(+),Ki67(+,<2%),CD99(+),bcl-2(+),CK(-),SMA(-),S-100(-),AR(散在+),CD117(-),DOG1(-)(图2B,图2C,图2D),(盆腔肿物)确诊孤立性纤维性肿瘤。患者术后恢复良好,术后第11 天出院。随访至今,未见复发及转移。
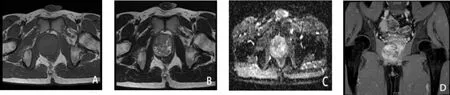
图1 盆腔增强MRI 影像

图2 盆腔孤立性纤维性肿瘤病理学表现
二、讨论
SFT 是一种罕见的间叶源性肿瘤, 最初由Klemperer[2]等于1931 年报道,虽然SFT 常发生于胸膜,但根据文献报道, 大约50%~70%的SFT 起源于胸膜外,如头部、颈部、腹部和骨盆[3],大多数SFTs 的生物学行为呈良性或交界性,恶性孤立性纤维性肿瘤罕见。 SFT 可发生于任何年龄,多发生于20~70岁的成年人,差异无统计学意义。
(一)发病机制
SFT 的发病机制还不清楚。 目前研究发现,SFT 中多有染色体异常,包括数量和结构异常[4],在SFT 中经常观察到着丝粒倒位引起染色体12q13 上的染色体内重排[5-6]。 这种重排影响相邻的和部分重叠的NAB2 基因和STAT6 基因在框架内相互并列, 产生NAB2-STAT6 融合基因[6]。 NAB2 是转化生长因子β(TGFβ)的重要调节剂,而STAT6(信号转导和转录激活剂)则是通过白介素4 和白介素13 调节信号传导的转录因子。 遗传融合可以发生在不同的断点,并且不同的融合类型可能与SFT 的不同临床病理亚群有关[7]。 另外,有研究表明, 小部分患者会出现副肿瘤性低血糖综合征(Doegge-Potter 综合征), 这可能与前激素形式的IGF2(胰岛素样生长因子II)的过度释放有关[8]。Hajdu 等人发现IGF2 和IR-A 在SFT 的解剖部位有过表达现象[9],IGF2 是一种蛋白质激素,与胰岛素有相似之处,通过与IR-A 结合发挥其生物学功能, 这种基因异常表达并不是由于基因扩增, 而似乎与基因标记丢失等表观遗传机制有关[10]。
(二)临床表现
胸膜外SFT 的临床症状由于发生部位不同而各异,多数胸膜外SFT 表现为生长缓慢的无痛性肿块,早期无明显临床症状,男女发病机率相似,但是发生在肝脏或者腹壁上的SFT 多见于女性,常见症状包括疼痛、可触及的肿块、神经或血管症状。 发生在腹部和盆腔的SFT 随着肿瘤的增大,可出现相应部位的压迫症状,如尿路梗阻或尿潴留、肠梗阻、便秘或腹胀[11]。还有少部分患者(5%)表现为低血糖[12]。 与SFT 相关的其他全身症状还有杵状指、肥大性骨关节病和关节痛[13,14]。
(三)诊断方法
影像学检查对SFT 的诊断和鉴别诊断具有重要价值。 超声检查常作为首诊筛查手段,一般表现为低回声或中低回声, 与邻近组织界限分明, 同时还可以动态观察肿瘤的位置变化[15],CT 和MRI 检查,互为补充,更准确提示肿瘤的部位、大小、形态、与周围组织关系等情况。 CT 表现为边界清楚、圆形或者椭圆形、血管丰富的肿块,可对邻近的器官如肠管、血管、膀胱和输尿管造成压迫或移位。 肿瘤可见中央低强化区或非强化区,表现为坏死或囊性改变。 钙化是罕见的,但是可以在大的良性或恶性肿瘤中看到[16,17]。MRI 检查,SFT 在T1WI 中表现为等信号强度,在T2WI 加权像上表现为非均匀的低信号强度。 T1WI 和T2WI 上的低信号强度病灶的存在主要是由于密集的胶原和纤维化成分、 低细胞性以及相关的质子迁移率降低。 此外,高纤维含量的病变可能在动脉期和门脉期表现为渐进性增强, 并在延迟图像上显示[18]。这些影像学特征的鉴别诊断包括其他高血管性肿瘤或以纤维成分为主的肿瘤,如平滑肌肉瘤、神经源性肿瘤、嗜铬细胞瘤、淋巴瘤、硬纤维瘤、恶性纤维组织细胞瘤、间皮瘤和纤维瘤。 仅使用影像学检查,不能准确区分这些肿瘤。 最终确诊需要结合病理组织学特点和免疫组化结果。
典型的SFT 在大体上为边界清楚的分叶状质韧肿块,切面淡褐色至灰白色,均质状, 可见出血和坏死区域, 肿瘤大小千差万别,从1 厘米到20 厘米不等[19],恶性SFT 与良性SFT 难以区分,恶性SFT 常显示更不规则的切面,有坏死区或邻近组织浸润的迹象。 光镜下特点:SFT 细胞多为无异型性的卵圆形或短梭形,细胞界限不清,间质可能呈现不同程度的粘液样改变,核空泡状,染色质散在分布,能看见大的分支或“鹿角形”的薄壁血管, 中等大小的血管伴有不同的血管周围玻璃化也是常见的特征,恶性SFT 通常以浸润边缘、多形性、细胞增生、坏死、核分裂大于4/10 高倍视野为特征[20]。免疫组织化学上,SFT 通常表现为STAT6、CD34、bcl2和CD99 的弥漫性强表达,其中,STAT6 诊断SFT 的敏感度和特异度分别为91%和75%[21], 而bcl2 是SFT 最敏感的标记物之一, 在SFT 中bcl2 的强表达有助于鉴别诊断[22-23]。
(四)治疗方案
治疗首选手术完整切除[24],视周围是否有脏器和血管侵犯可一并行联合脏器切除, 这是防止术后复发的关键,手术完整切除的5 年生存率接近100%[25]。
通过查阅文献发现,报道的病例中,治疗盆腔SFT均采取腹部开放性手术,Yokoyama[26]等诊治一例盆腔SFT 时,术前行2 次血管栓塞,再行开腹手术,术中总出血量440ml;Sueblinvong[27]等报道了5 例盆腔SFT 分析,5 例患者均行开腹探查;2013 年高杰[28]等报道了9例盆腔SFT 诊断与治疗,9 例患者均行开腹探查,手术平均用时6 h 29 min,平均出血量2 033 mL。 2017 年张彤[29]等报道了5 例盆腔SFT 分析,5 例患者均行开放盆腔肿瘤切除术,手术时问120~480 min,平均280 min。术中出血量400~2000 mL,平均1200 mL。
本病例中, 患者接受阴腹联合腹腔镜下盆腔肿物切除术, 取脐下腹正中切口长约5cm 建立气腹并放置腹腔镜,脐下两横指,腹直肌左侧和右侧做穿刺孔放置操作器械, 术中见肿瘤表面血管丰富, 肿瘤紧贴前列腺,与前列腺,盆底肌,直肠周围粘连,肿瘤后方粘连严重。 取会阴部奔驰切口,依次切开皮肤,肉膜,打开球海绵体肌,游离尿道,将肿块朝盆腔内顶入以协助腹腔镜手术,另以手指伸入直肠引导腹腔镜下手术。 以双极电凝将肿瘤表面血管充分凝固, 紧贴肿瘤包面表面完整切除肿瘤,手术用时90min,术中出血300mL。我们使用腹腔镜技术完整切除肿瘤,在国内外报道中尚属首例,与传统腹部开放手术相比,手术时间大大缩短,术中出血少,术后患者恢复快,未见手术并发症。
SFT 术后不需要常规的放射治疗或辅助化疗[30]。但是近年来有学者提出在外科手术后增加放射治疗,可以增强对肿瘤生长的局部控制,降低复发率[31]。 分子靶向治疗是治疗不能切除或转移的SFT 的一种很有前途的方法,目前正在研究针对IGF 信号通路和Akt/mTOR通路的靶向药物[32]。
四、结论
盆腔SFT 是一类临床上较为少见的肿瘤, 其临床特征和影像学表现无特异性, 主要通过组织病理和免疫组化病理明确诊断。 治疗首选手术完整切除肿物,根据不同患者肿瘤形态、大小、位置、血运及周围脏器情况,可选择腹腔镜手术或开放手术,对于不能完整切除的恶性倾向肿瘤,可辅以术后放疗或靶向治疗。 只要完整切除肿瘤,大多数患者的预后良好。 由于这种肿瘤有一定的复发倾向,术后仍需密切随访。

