老年AML患者在经地西他滨治疗中COX-2、VEGF及p53蛋白的表达及与预后关系
王战芳 张芳芳 杨海 陈超华
急性髓系白血病(acute myeloid leukemia,AML)是髓系造血干/祖细胞恶性疾病,是以外周血和骨髓中原始和幼稚髓系细胞异常增生为特征的一类恶性肿瘤。研究显示[1],在65 岁以上人群AML 的发病率是其他人群的10 倍,这与老年人机体抵抗力差、身体机能衰退等有关。化疗是治疗AML 的有效手段。但在老年患者中往往难以耐受标准剂量化疗,所以阿糖胞苷+阿克拉霉素+粒细胞集落刺激因子(Ara-c+ACR+G-CSF,CAG)方案常成为老年AML 患者治疗选择。地西他滨为一种DNA 甲基化转移酶抑制剂,其对于抑制肿瘤细胞增殖、分化和促进肿瘤细胞凋亡具有明显作用。陈冬等研究证实[2],地西他滨联合CAG 化疗方案用于急性白血病的治疗取得了较好的效果,改善患者预后。环氧化酶2(Cyclooxygenase 2,COX-2)可促进实体瘤的发生和发展,其表达水平与肿瘤预后密切相关,并在白血病患者中水平明显升高[3]。肿瘤的形成依赖于血管的异常增生,血管内皮生长因子(vascular endothelial growth factor,VEGF)为机体重要的血管生成因子,研究认为VEGF 与血液系统疾病的发生发展和预后存在明显关系[4-5]。P53 基因是目前已知的与肿瘤相关的基因,其编码的p53 蛋白结构稳定,半衰期长,可作为多种恶性肿瘤疾病诊断、治疗和预后的有效标志物[6]。因此,COX-2、VEGF、p53 蛋白可为地西他滨治疗老年急性AML 患者中的效果观测及预后评估的有效指标,本研究对此进行了探究,取得了一定的进展,具体总结如下。
1 资料与方法
1.1 一般资料
选取本院2014年1月至2019年1月收治的80例AML 患者作为研究组,其中男49例,女31例,年龄60~76 岁,平均(68.8±2.4)岁,M1 型8例,M2型14例,M4 型18例,M5 型31例,M6 型9例。并选取同期于本院健康体检者40例作为对照组,其中男24例,女16例,年龄60~78 岁,平均(68.3±2.5)岁。两组研究对象在性别、年龄等临床一般资料上比较差异无统计学意义(P>0.05),具有可比性。本研究内容获得院伦理委员会审核通过。
纳入标准:①均符合《血液病诊断与疗效标准》中关于AML 的诊断标准[7];②均行骨髓穿刺检查确诊;③年龄≥60 岁;④AML 的MICM 分型为M1、M2、M4、M5、M6 型;⑤所有患者及家属均充分了解本研究并自愿签署知情同意书。排除标准:①近期行化疗等相关治疗者;②肝肾等重要脏器严重功能障碍者;③合并内分泌系统疾病、免疫系统疾病者;④合并其他部位恶性肿瘤者;⑤不耐受本研究治疗方案或中途退出研究者。
1.2 方法
所有AML 患者采用地西他滨联合CAG 方案治疗:地西他滨15 mg/m2·d,d1-d5,静脉滴注;阿克拉霉素20 mg/d,d1-d4,静脉滴注;阿糖胞苷10 mg/m2,q12 h,d1-d14,皮下注射;粒细胞集落刺激因子150 μg,q12 h,d1-d14,皮下注射,实验室检查患者血细胞计数,白细胞>20×109/L 时,停止用药。所有患者在治疗结束后观察治疗效果,并统计完全缓解和未完全缓解患者例数。
1.3 观测指标
1.3.1 COX-2、VEGF 及p53 蛋白水平检测
所有研究对象在入院后当日空腹抽取5 mL静脉血,室温放置30 min,3 000 r/min 离心15 min分离上清,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定COX-2、VEGF及p53 蛋白水平,试剂盒购自上海西唐生物科技有限公司。所有操作严格按照试剂盒说明下进行。所有AML 患者在化疗14 d 后再次抽取5 mL 空腹静脉血并依照同种方法检测上述指标变化情况。
1.3.2 体液免疫及细胞免疫指标检测
所有患者在治疗前及治疗14 d 后采用免疫速率比浊法检测体液免疫指标IgA、IgG、IgM 水平,试剂盒购自上海生工生物工程有限公司。采用CyFlow 全自动流式细胞分析仪(德国Partec 公司)及其配套试剂检测细胞免疫指标T 淋巴细胞亚型CD3+、CD4+、CD8+变化,并计算CD4+/CD8+。
1.3.3 预后
所有患者化疗后随访1~5年,观察患者生存状况,并统计患者化疗缓解期发生中枢神经白血病(central nervous system leukemia,CNSL)的情况。CNSL 诊断标准依据《中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)》[8]进行判断。
1.4 统计学分析
采用SPSS 20.0 软件进行数据分析,计数资料以%表示,组间比较采用χ2检验;计量数据以()表示,组间比较采用t检验。Spearman 相关性分析COX-2、VEGF 及p53 蛋白之间的相关性及其与免疫指标的相关性;采用受试者工作特征曲线(receiver operator characteristic curve,ROC)分析COX-2、VEGF、p53 蛋白在CNSL 中的预测价值。P<0.05 为差异具有统计学意义。
2 结果
2.1 两组血清指标变化情况
研究组患者治疗前COX-2、VEGF 及p53 蛋白水平均显著高于对照组,但治疗后均较治疗前明显降低,差异具有统计学意义(P<0.05)。研究组患者治疗后体液免疫指标和细胞免疫指标均较治疗前明显降低,差异具有统计学意义(P<0.05)。见下表1。
表1 两组血清指标变化情况(±s)Table1 Changes of serum indicators in the 2 groups(±s)
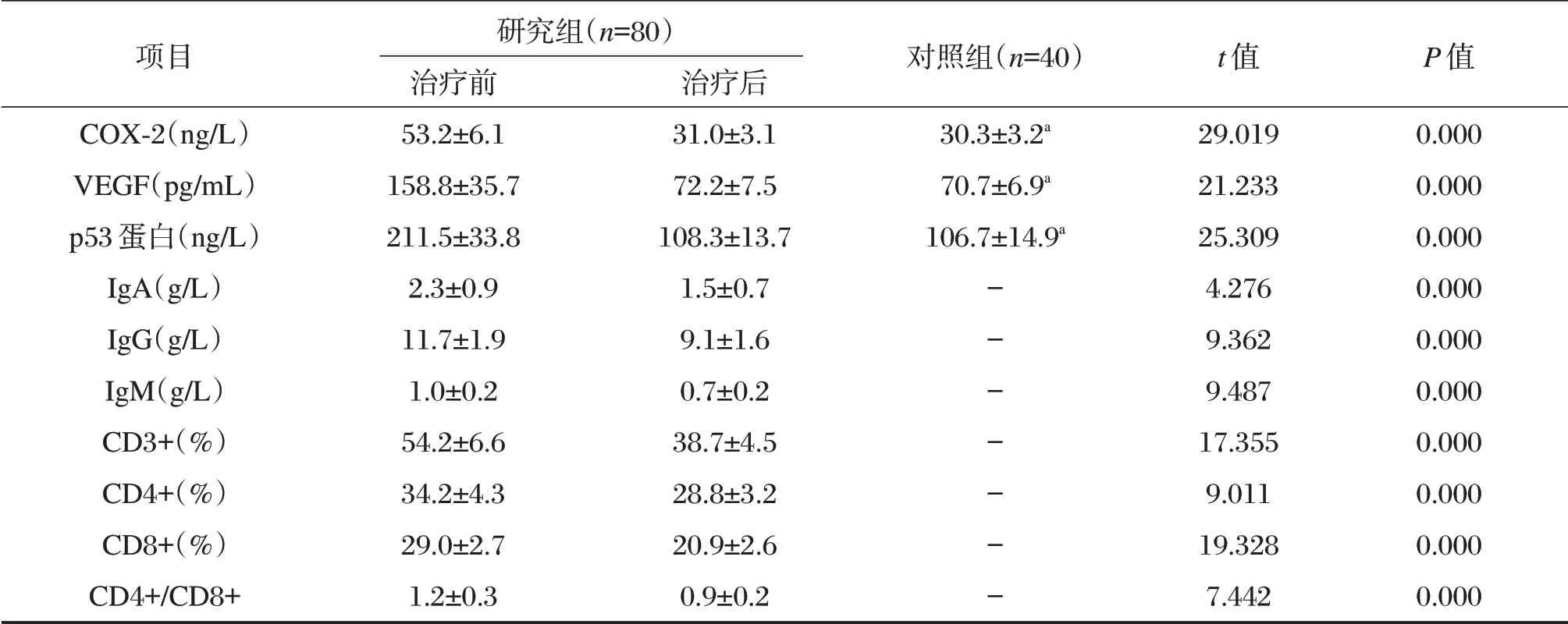
表1 两组血清指标变化情况(±s)Table1 Changes of serum indicators in the 2 groups(±s)
注:对照组与研究组比较,aP<0.05。
项目COX-2(ng/L)VEGF(pg/mL)p53 蛋白(ng/L)IgA(g/L)IgG(g/L)IgM(g/L)CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+研究组(n=80)治疗前53.2±6.1 158.8±35.7 211.5±33.8 2.3±0.9 11.7±1.9 1.0±0.2 54.2±6.6 34.2±4.3 29.0±2.7 1.2±0.3治疗后31.0±3.1 72.2±7.5 108.3±13.7 1.5±0.7 9.1±1.6 0.7±0.2 38.7±4.5 28.8±3.2 20.9±2.6 0.9±0.2对照组(n=40)30.3±3.2a 70.7±6.9a 106.7±14.9a-------t 值29.019 21.233 25.309 4.276 9.362 9.487 17.355 9.011 19.328 7.442P 值0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000
2.2 相关性分析
相关性分析结果显示,COX-2、VEGF 及p53 蛋白之间存在明显正相关性(P<0.05),见表2。

表2 COX-2、VEGF 及p53 蛋白与各指标的相关性分析Table2 Correlation analysis of COX-2,VEGF and p53 proteins with various indicators
2.3 不同治疗结果老年AML 患者COX-2、VEGF及p53 蛋白水平及总生存期(Overall Survival,OS)比较
完全缓解组AML 患者COX-2、VEGF 及p53蛋白水平明显低于未完全缓解组,差异具有统计学意义(P<0.05)。完全缓解组老年AML 患者OS明显大于未完全缓解组,差异具有统计学意义(P<0.05),见表3。
表3 不同治疗结果老年AML 患者各指标比较(±s)Table3 Comparison of various indicators in different treatment outcomes of elderly AML patients(±s)
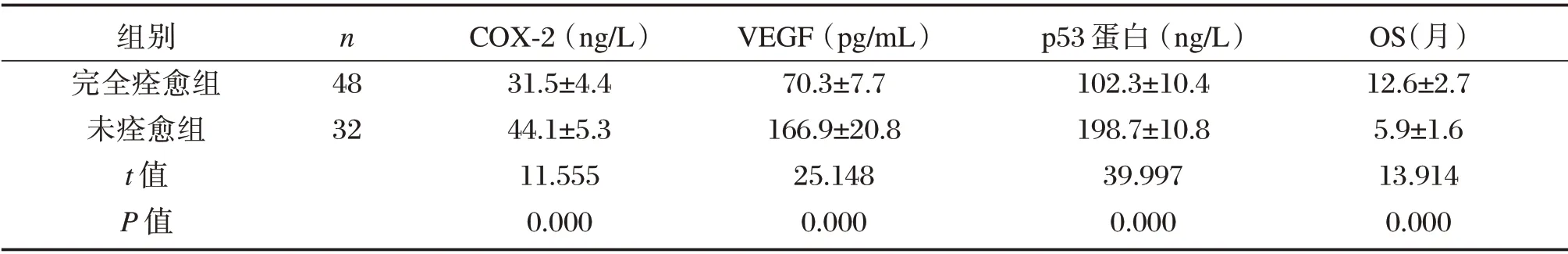
表3 不同治疗结果老年AML 患者各指标比较(±s)Table3 Comparison of various indicators in different treatment outcomes of elderly AML patients(±s)
组别完全痊愈组未痊愈组t 值P 值n 48 32 COX-2(ng/L)31.5±4.4 44.1±5.3 11.555 0.000 VEGF(pg/mL)70.3±7.7 166.9±20.8 25.148 0.000 p53 蛋白(ng/L)102.3±10.4 198.7±10.8 39.997 0.000 OS(月)12.6±2.7 5.9±1.6 13.914 0.000
2.4 COX-2、VEGF 及p53 预测CNSL 的ROC 曲线
ROC 曲线结果显示,COX-2、VEGF、p53 蛋白及联合检测在CNSL 诊断中的曲线下面积(AUC)分别为0.836(95%CI:0.776~0.896)、0.802(95%CI:0.730~0.873)、0.716(95%CI:0.639~0.793)及0.905(95%CI:0.863~0.947)。见图1。
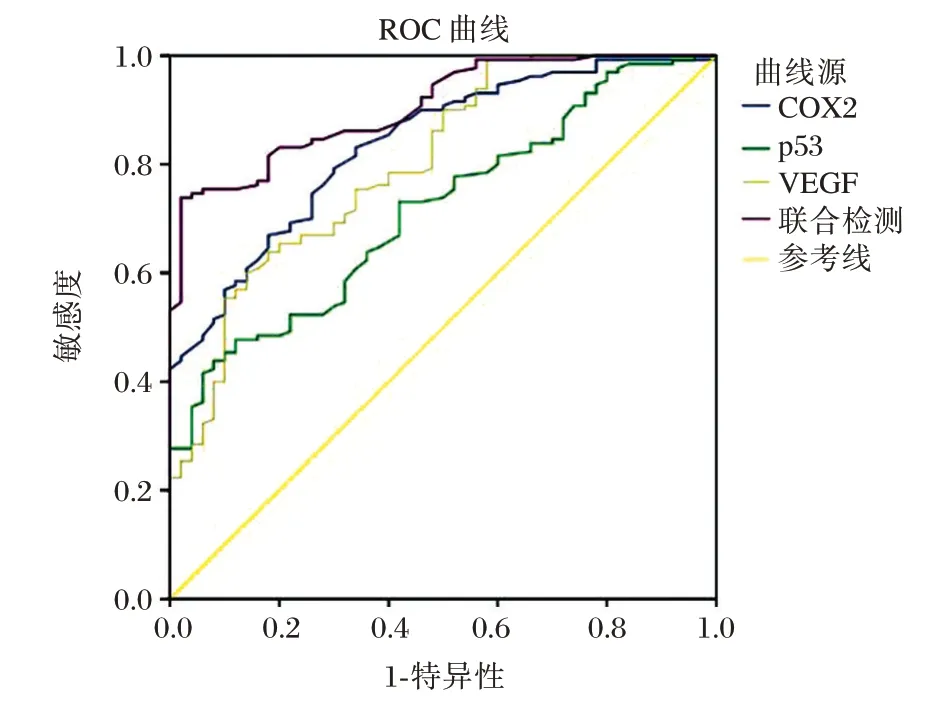
图1 COX-2、VEGF 及p53 预测CNSL 的ROC 曲线Figure1 COX-2,VEGF and p53 predict ROC curves of CNSL
3 讨论
随着化疗药物和治疗方案的不断改进完善,AML 患者的临床疗效得到了显著提升,但仍有相当部分患者病情控制较差,这在老年患者中更为常见。采用地西他滨进行去甲基化治疗联合CAG 方案为老年AML 的常用治疗方案。去甲基化治疗可促进白血病细胞由G0 期进入细胞周期,增加S 期细胞数量,从而提升化疗药物对于肿瘤细胞的杀伤效果[9]。地西他滨可以渗入DNA 链,抑制DNA 甲基转移酶实现甲基化,从而激活抑癌基因,起到抗AML 的效果[10]。在实体肿瘤的形成、生长、转移等过程中与新生血管存在密切相关性,新生血管是肿瘤细胞生长、增殖的必要条件。研究发现[11],抑制肿瘤血管生成,可切断肿瘤组织的氧气和营养物质供给,从而使其丧失营养来源而萎缩凋亡。
研究表明[12],COX-2 通过多个途径参与肿瘤的发生和发展,其可直接参与肿瘤血管新生;COX-2 及其前列腺素产物可促进细胞DNA 合成和细胞增殖;COX-2 还可抑制肿瘤下拨凋亡,引发机体体液免疫和细胞免疫平衡失调。多项研究表明[13-14],COX-2 在多种血液肿瘤疾病中存在明显高表达的情况。VEGF 为血管通透因子,能够与血管内皮细胞特异性结合,从而加速血管内皮细胞形成,促进心血管形成,其还能调节造血干细胞和眼性细胞因子的发育和表达,增强血管通透性。研究发现[15],在ALL、AML、CLL 等患者的外周血和骨髓均存在VEGF 及其受体高表达的情况。VEGF 在白血病细胞中大量合成释放,VEGF 在与其受体结合后促进白血病细胞增殖,减少白血病细胞凋亡。p53 蛋白与肿瘤密切相关,p53 基因突变可导致其丧失对DNA 修复、细胞增殖、凋亡等的调控作用,因此血清p53 蛋白水平提示了机体抗肿瘤能力[16-17]。本研究结果显示,经地西他滨联合CAG 方案化疗后,老年AML 患者的COX-2、VEGF 及p53 蛋白水平均显著降低。提示,地西他滨联合化疗可明显降低老年AML 患者血清COX-2、VEGF 及p53 蛋白水平,缓解患者病情。
本研究结果提示AML 患者在治疗后存在机体细胞免疫抑制状态。加上老年人群自身免疫功能较差、机体机能退化等,从而影响了老年AML 患者的预后。本研究中未完全缓解患者较完全缓解患者COX-2、VEGF 及p53 蛋白较高,OS 明显降低。提示,COX-2、VEGF、p53 蛋白水平为评估AML 患者治疗效果的有效指示指标。ROC 曲线结果显示,COX-2、VEGF、p53 联合检测在CNSL 诊断中的AUC 明显高于3 者单一检测。提示,COX-2、VEGF 及p53 蛋白联合应用在AML 患者地西他滨治疗后的预后评估和预测患者CNSL 的发生中存在明显价值。综上所述,COX-2、VEGF 及p53 蛋白水平检测对于老年AML 患者应用地西他滨化疗临床治疗效果观测及预后评估具有显著价值。

