血清LBP、HSP70、DcR3水平预测急性呼吸窘迫综合征患者疾病转归的价值
马玲玲 杨秋伟 孔汴躲
急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)具有起病急骤、病死率高等特点,数据显示,ARDS 病死率高达35.0%~46.0%[1]。文献报道,炎症反应失控、凋亡在ARDS发病机制中起着关键性作用[2]。同时,研究表明,脂多糖结合蛋白(Lipopolysacchoride Binding Protein,LBP)能激活Toll 样受体4(Toll like receptor,TLR-4)信号,诱发炎症级联信号通路[3]。热休克蛋白70(Heat shock proteins 70,HSP70)通过抑制炎症相关基因转录,可实现抗炎症、减轻损伤、保护机体的作用。诱捕受体3(Decoy receptor3,DcR3)作为多向性免疫调节因子,能发挥抗炎、免疫调节双重作用,是炎症性疾病、自身免疫性疾病的生物标志物[4]。但临床关于血清LBP、HSP70、DcR3 水平对ARDS 患者预后预测价值鲜有研究。鉴于此,本研究旨在探讨其对ARDS 患者预后的预测价值。具体分析如下。
1 资料和方法
1.1 一般资料
选取本院2017年5月至2019年5月收治的92例ARDS 患者作为研究对象,根据30 d 预后情况选取存活患者64例为生存组,全因死亡患者28例为死亡组。两组基本资料比较差异无统计学意(P>0.05),均衡可比所有患者及家属均签知情同意书。本研究经我院医学伦理委员会批准。
1.2 选取标准
纳入标准:①符合ARDS 相关标准[5];②均经X 线胸片正位扫描发现双肺出现斑片状阴影;③氧合指数≤200 mmHg;④肺动脉嵌顿压≤18 mmHg;⑤临床资料完整;⑥患者及家属知情并签署同意书。排除标准:①存在长期免疫抑制剂或激素类药物使用史者;②肝肾等重要脏器器质性病变者;③间质性肺疾病者;④精神行为异常者。
1.3 方法
空腹取3 mL 静脉血,离心12 min,3 000 r/min,分离取血清,采用酶联免疫吸附法检测血清DcR3、HSP70、LBP 水平,试剂盒购自上海康朗生物科技有限公司,均严格按照试剂盒说明书操作。
1.4 观察指标
①对比两组血清LBP、HSP70、DcR3 水平、SOFA、APACHEⅡ评分。其中SOFA 评分从呼吸系统、凝血系统、肝、循环系统、神经系统、肾脏6个方面进行评估,每个方面1~4 分,得分越高,预后越差;APACHEⅡ评分最高分71 分,>17 分为重症,得分越高,病情越严重,病死率越高。②分析血清LBP、HSP70、DcR3 水平与SOFA、APACHEⅡ评分相关性。③分析ARDS 患者预后的危险因素。④分析血清LBP、HSP70、DcR3 预测ARDS 患者预后价值。⑤分析血清LBP、HSP70、DcR3 高危组、低危组生存曲线。
1.5 统计学方法
采用SPSS 22.0 软件进行分析,计量资料采用()表示,两组间比较采用t检验,计数资料用n(%)表示,采用χ2检验,通过Logistic 进行多因素回归分析,采用Pearson 进行线性相关性分析,采用ROC 曲线预测预后价值,以卡普兰-迈耶(Kaplan-Meier,KM)曲线进行生存曲线分析,采用Log-Rank 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组基本资料比较
两组基本资料中,性别、年龄、BMI 等指标比较差异无统计学意义(P>0.05)。见表1。
2.2 两组血清LBP、HSP70、DcR3 水平
死亡组入院时、入院第7 天血清LBP、DcR3 水平高于生存组,HSP70 水平低于生存组(P<0.05),且生存组入院时与入院第7 天差值高于死亡组,差异具有统计学意义(P<0.05),见表2。

表1 两组一般资料比较[n(%)]Table1 Comparison of 2 groups of general data[n(%)]
表2 两组血清LBP、HSP70、DcR3 水平比较(±s)Table2 Comparison of serum LBP,HSP70 and DcR3 levels between 2 groups(±s)

表2 两组血清LBP、HSP70、DcR3 水平比较(±s)Table2 Comparison of serum LBP,HSP70 and DcR3 levels between 2 groups(±s)
组别n入院时28 64入院第7 天28 64入院时与入院第7 天差值死亡组生存组t 值P 值死亡组生存组t 值P 值死亡组生存组t 值P 值28 64 LBP(μg/mL)121.90±32.27 93.37±29.06 4.189<0.001 102.05±34.00 67.44±22.46 5.774<0.001 19.85±3.23 25.93±5.10 5.809<0.001 HSP70(μg/L)1.02±0.31 1.33±0.34 4.130<0.001 1.17±0.42 1.85±0.69 4.829<0.001 0.15±0.06 0.52±0.21 9.136<0.001 DcR3(ng/mL)3.16±0.62 2.59±0.58 4.247<0.001 3.04±1.01 1.83±0.60 7.149<0.001 0.12±0.04 0.76±0.25 13.431<0.001
2.3 两组SOFA、APACHEⅡ评分
死亡组入院时、入院第7 天SOFA、APACHEⅡ评分高于生存组(P<0.05),且生存组入院时与入院第7 天差值高于死亡组,差异具有统计学意义(P<0.05),见表3。
2.4 血清LBP、HSP70、DcR3水平与SOFA、APACHEⅡ评分的相关性
Pearson 线性相关性分析,血清LBP、DcR3水平与SOFA、APACHEⅡ评分呈正相关,HSP70与SOFA、APACHEⅡ评分呈负相关(P<0.05),见表4。

表4 血清LBP、HSP70、DcR3 水平与SOFA、APACHEⅡ评分的相关性Table4 Correlation of serum LBP,HSP70,DcR3 levels with sofa and Apache Ⅱscores
2.5 ARDS 患者预后的影响因素
以ARDS 患者预后作为因变量,以入院时合并MODS、入院时并发休克、血清LBP、HSP70、DcR3、SOFA、APACHEⅡ评分作为自变量,纳入Logistic 回归分析模型,结果显示,入院时合并MODS、入院时并发休克、血清LBP、HSP70、DcR3、SOFA、APACHEⅡ评分是ARDS 患者预后的重要影响因素(P<0.05),见表5。
2.6 血清LBP、HSP70、DcR3 对ARDS 预后的预测价值
ROC 曲线分析显示,入院时、入院第7 天血清LBP、HSP70、DcR3 对ARDS 预后均具有一定预测价值,入院第7 天HSP70 AUC(0.830)>入院第7天LBP(0.806)>入院第7 天DcR3(0.766)。见表6、图1。
表3 两组SOFA、APACHEⅡ评分比较(±s)Table3 Comparison of sofa and Apache Ⅱscores between 2 groups(±s)
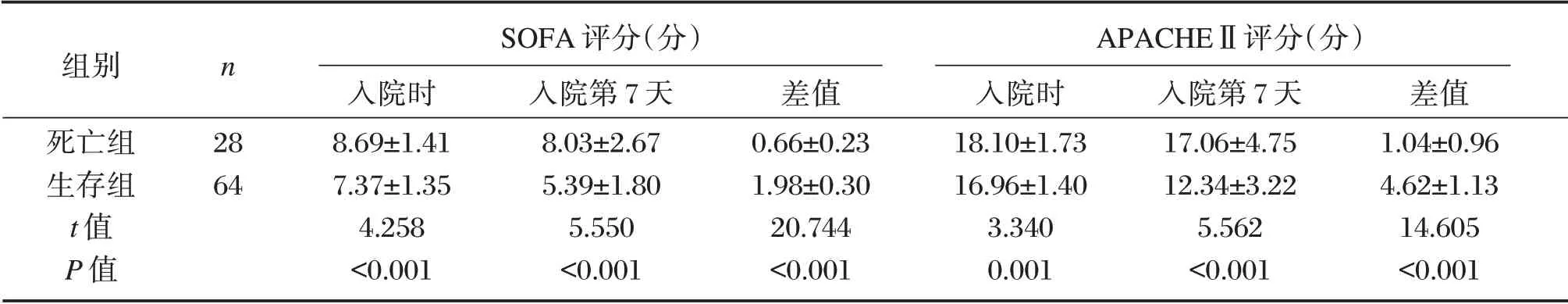
表3 两组SOFA、APACHEⅡ评分比较(±s)Table3 Comparison of sofa and Apache Ⅱscores between 2 groups(±s)
组别死亡组生存组t 值P 值n SOFA 评分(分)28 64入院时8.69±1.41 7.37±1.35 4.258<0.001入院第7 天8.03±2.67 5.39±1.80 5.550<0.001差值0.66±0.23 1.98±0.30 20.744<0.001 APACHEⅡ评分(分)入院时18.10±1.73 16.96±1.40 3.340 0.001入院第7 天17.06±4.75 12.34±3.22 5.562<0.001差值1.04±0.96 4.62±1.13 14.605<0.001

表5 ARDS 患者预后的影响因素Table5 Prognostic factors of death in patients with ARDS
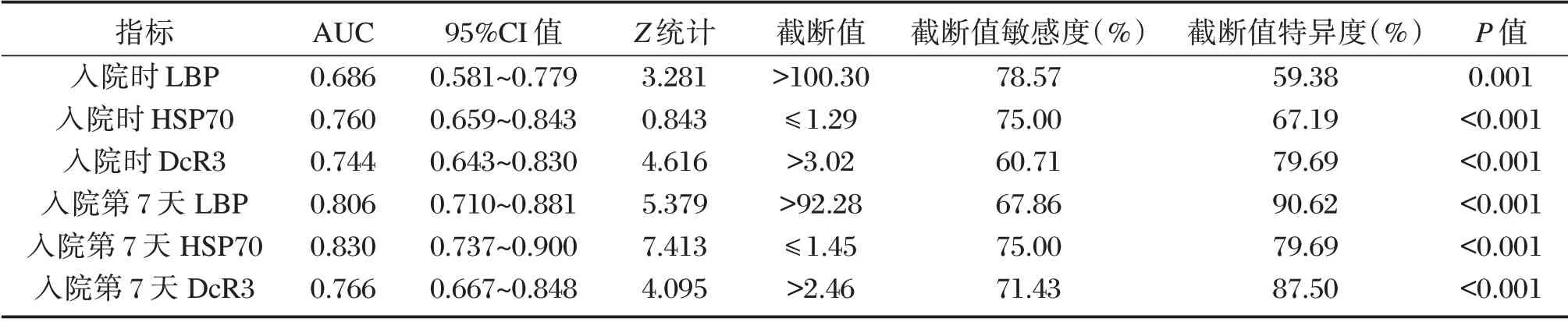
表6 ROC 分析结果Table6 ROC analysis results
2.7 生存分析
赋值生存=“0”、死亡=“1”。以ROC 曲线最佳截断值分为低危组、高危组,KM 曲线分析显示血清LBP、HSP70、DcR3 高危组、低危组生存曲线对比,差异有统计学意义(χ21=19.438;χ22=31.134;χ23=30.894,P<0.001),见图2。

图2 LBP、HSP70、DcR3 生存曲线Figure2 Survival curve(LBP、HSP70、DcR3)
3 讨论
ARDS 主要发病机制在于肺内及全身过度活化的炎症反应及大量活性氧所致氧化应激,可爆发级联性炎症反应,损伤肺微血管内皮细胞及屏障,进一步引发通透性肺损伤,危及患者生命安全[6-7]。LBP 属Ⅰ型急性期反应蛋白,正常人LBP血浆浓度为5~10 μg/mL,急性反应期24 h 内可迅速增至200 μg/mL,当LBP 致炎位点与内毒素(LPS)的类脂A 结合时,表现为信号的跨膜转导,能促进炎症介质生成[8-9]。本研究结果显示,ARDS 死亡患者入院时、入院第7d 血清LBP 水平均呈高表达状态。研究也证实,ARDS 发生时,可显著放大LPS 致炎作用,激活核转录因子(NF-κB),释放大量肿瘤坏死因子-α(TNF-α)、白介素6、细胞间黏附分子-1(ICAM-1)等促炎性因子及一氧化氮[10-11],形成恶性循环,诱发过度炎症反应,加重机体损伤。
HSP70 是生物细胞在应激状态下产生的高度保守蛋白质,具有抵御外界刺激、维持细胞稳定性等作用,可通过多途径参与免疫反应、抑制炎症反应[12-13]。同时,曹征等[14]通过小鼠实验发现,HSP70 水平显著升高,有助于降低支气管肺泡灌洗液中TNF-α、IL-1 等细胞因子含量,避免肺损伤加重。本研究通过对比两组入院时、入院第7 天血清HSP70 水平可知,ARDS 生存患者血清HSP70水平明显高于死亡患者,与上述研究相似。ARDS可诱发严重氧化应激反应,进而促进HSP70 表达增加,帮助免疫系统清除毒性细胞,协助抗原提呈细胞浆抗原提呈至T 细胞,参与细胞免疫调控,抑制TNF-α 等促炎因子的表达,发挥抗炎、肺保护作用[15]。且入院时、入院第7 天血清HSP70 均超出基线值,说明血清HSP70 对ARDS 预后具有一定预测价值。
DcR3 是一种33 kD 可溶性分子,可竞争性结合FasL,抑制细胞凋亡,调节过激炎症免疫应答,而FasL/DcR3 水平紊乱,一定程度会迅速降低肺炎球菌清除功能,诱导病情进展,增加病死率[16]。谢姿等[17]采用前瞻性巢式病例对照研究21例ARDS存活者、20例ARDS 病死者DcR3 浓度发现,ARDS病死者DcR3 浓度呈明显高表达状态,推测血清DcR3 水平可能与ARDS 发生、进展有关,同时经Cox 回归分析显示DcR3≥2.7 ng/mL 是ARDS 患者30 d 死亡的独立危险因素,与本研究观点一致。ARDS 发生可诱发抗炎反应与促炎反应平衡失调,促进血清DcR3 过度表达,使巨噬细胞趋向具有抗炎特性的M2 表型,抑制抗炎细胞因子分泌,增加ICAM-1、IL-8 等炎性因子含量,加重肺损伤,影响预后转归。经Pearson 线性相关性分析发现,DcR3与SOFA、APACHEⅡ评分存在正相关关系,提示血清DcR3 水平越高,ARDS 病情严重程度越高,可见血清DcR3 在ARDS 预后评估中具有一定预测价值。
综上可知,血清LBP、HSP70、DcR3 水平与ARDS 患者病情严重程度密切相关,是ARDS 患者预后的重要影响因素,可成为评估ARDS 患者预后的重要预测因子。

