人附睾蛋白4和趋化因子配体9在狼疮性肾炎诊断及预后的应用价值
魏华 张彩凤 王佳丽
狼疮性肾炎(Lupus nephritis,LN)属于系统性红斑狼疮(Systemic lupus erythematosus,SLE)最常见且严重并发症之一,可明显提高心血管疾病、终末期肾病发生风险[1-2]。目前,临床尚无根治LN 手段,患者通常预后较差。据流行病学调查显示,肾脏受累在我国SLE 患者死亡原因中仅次于感染居于第二位[3]。积极探索可靠诊断及预后相关指标对及时调整治疗方案、改善预后情况、降低死亡风险具有重要意义。相关研究表明,趋化因子配体9(CXCL9)属于趋化因子家族重要成员,可结合受体介导细胞迁移,激活免疫活性细胞、抗原递呈细胞,调控机体免疫机制,参与SLE 发病、进展过程[4]。另有文献指出,慢性肾脏疾病造成肾脏受损后,肾远曲小管可释放人附睾蛋白4(Human epididymal protein 4,HE4)进入血液,导致其血清含量异常升高[5]。但关于两者在LN 诊断与预后的价值仍缺乏循证依据。基于此,本研究首次综合分析HE4、CXCL9 在LN 诊断及预后的应用价值,旨在为临床诊治该病提供参考依据。详情如下。
1 资料与方法
1.1 一般资料
选取本院2016年1月~2018年1月收治的82例LN 患者作为研究组,男性12例,女性70例,年龄20~63 岁,平均年龄(35.31±7.33)岁,肾功能指标:血肌酐(126.30±35.27)μmol/L,尿素氮(9.22±2.05)mmol/L。另选取80例系统性红斑狼疮(SLE)未合并LN 患者作为对照组,男性11例,女性69例,年龄21~64 岁,平均年龄(36.48±6.90)岁,肾功能指标:血肌酐(98.23±27.76)μmol/L,尿素氮(7.81±1.75)mmol/L。两组年龄、性别等一般资料均衡可比(P>0.05),两组肾功能指标(血肌酐、尿素氮)相比,差异有统计学意义(P<0.05)。本研究经我院伦理委员会审批通过。
纳入标准:①研究组均经临床诊断、肾组织活检证实为LN,且符合美国风湿病学会制定的LN相关诊断标准[6];②对照组均确诊为SLE,且未合并LN;③两组临床资料完整;④患者及家属均知情本研究方案,自愿签署知情承诺书。排除标准:①伴有恶性肿瘤疾病者;②存在慢性炎症性疾病、免疫性疾病者;③心肝肺等其他重要脏器严重功能异常者;④合并其他急慢性肾脏疾病者;⑤参与本研究前1 个月内服用细胞毒性药物或免疫抑制剂者;⑥伴有全身感染性疾病者;临床资料缺失者。
1.2 方法
1.2.1 检测方法
采集空腹静脉血4 mL,离心处理,离心速率为2 500 r/min,离心半径为15 cm,离心时间为10 min,取上清液,保存于-70℃条件下,待检。采用化学发光法检测血清HE4 水平,购自美国雅培公司的全自动化学发光分析仪及配套试剂盒进行检测;采用酶联免疫吸附法检测血清CXCL9 水平,选择购自美国BIOTEK 公司的酶标检测仪(Elx800 型)及试剂盒进行检测,严格按照说明书实施操作步骤。
1.2.2 治疗方法
研究组所有患者均给予泼尼松,初期口服1.0 mg/(kg·d),2 个月后减少剂量至10 mg/d;来氟米特最初3 d 负荷量50 mg/d,之后口服20 mg/d;厄贝沙坦口服100 mg/次,1 次/d。共治疗6 个月。随访1年,统计复合肾脏终点事件发生情况,主要包括终末期肾病、血清肌酐倍增、肾小球滤过率(eGFR)下降≥50%、全因死亡。
1.4 统计学处理
使用SPSS 24.0 软件进行数据处理,计量资料以()表示,t检验,计数资料以n(%)表示,χ2检验,采用Logistic 回归分析探究LN 预后影响因素,应用ROC 曲线分析血清HE4、CXCL9 水平对LN诊断及预测预后价值,P<0.05 为差异有统计学意义。
2 结果
2.1 两组入院时血清HE4、CXCL9 水平
研究组入院时血清HE4、CXCL9 水平高于对照组(P<0.05),见表1。
表1 两组入院时血清HE4、CXCL9 水平比较(±s)Table1 Comparison of serum HE4 and CXCL9 levels in two groups at admission(±s)

表1 两组入院时血清HE4、CXCL9 水平比较(±s)Table1 Comparison of serum HE4 and CXCL9 levels in two groups at admission(±s)
n 组别研究组对照组t 值P 值82 80 HE4(U/mL)184.35±62.24 126.27±58.82 6.101<0.001 CXCL9(pg/mL)234.46±42.09 207.11±38.20 4.328<0.001
2.2 血清HE4、CXCL9 水平诊断价值
ROC 曲线分析显示,血清HE4、CXCL9 联合诊 断AUC 为0.773,大 于HE4(0.670)、CXCL9(0.613),当HE4 截断值>160.07 U/mL、CXCL9 截断值>218.93 pg/mL,敏感度为76.83%,特异度为76.25%。见表2。
2.3 不同预后患者一般资料
治疗随访1年,无脱落病例,共发生复合肾脏终点事件15例,包括2例全因死亡、8例终末期肾病、5例肾小球滤过率(eGFR)下降≥50%。预后良好者年龄、性别、病程与预后不良者相比,差异无统计学意义(P>0.05);预后良好者SLE 疾病活动指数(SLEDAI)评分低于预后不良者(P<0.05),见表3。
表3 不同预后患者一般资料比较(±s)Table3 Comparison of General information of patients with different prognosis(±s)
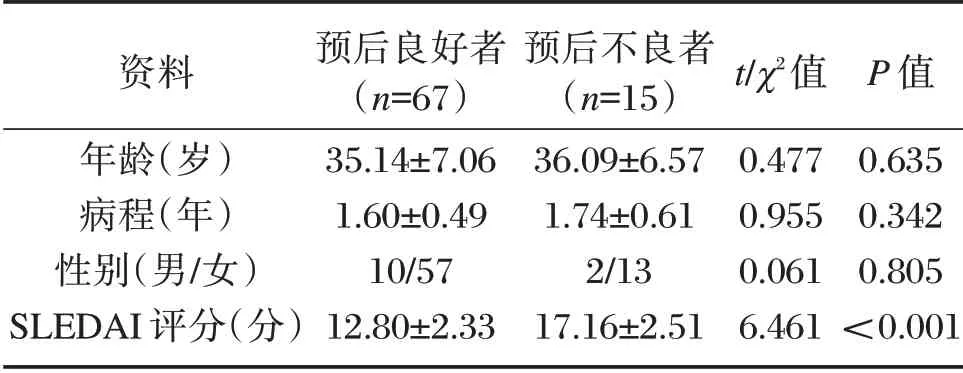
表3 不同预后患者一般资料比较(±s)Table3 Comparison of General information of patients with different prognosis(±s)
资料年龄(岁)病程(年)性别(男/女)SLEDAI 评分(分)预后良好者(n=67)35.14±7.06 1.60±0.49 10/57 12.80±2.33预后不良者(n=15)36.09±6.57 1.74±0.61 2/13 17.16±2.51t/χ2值0.477 0.955 0.061 6.461P 值0.635 0.342 0.805<0.001
2.4 不同预后患者入院时、治疗6 个月后血清HE4、CXCL9 水平
两者入院时血清HE4、CXCL9 水平无明显差异(P>0.05);预后不良者治 疗6 个月 后血清HE4、CXCL9 水平高于预后良好者(P<0.05),见表4。
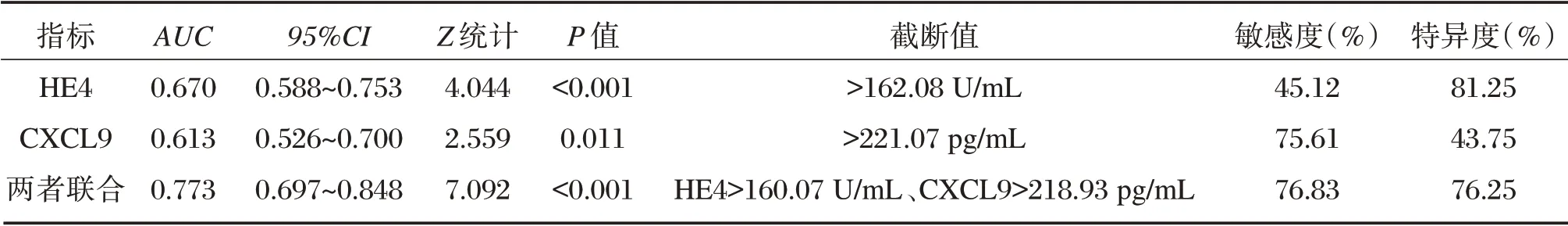
表2 ROC 分析结果Table2 ROC analysis results
表4 不同预后患者入院时、治疗6 个月后血清HE4、CXCL9 水平(±s)Table4 Serum HE4 and CXCL9 levels at admission to patients with different prognosis at 6 months after treatment(±s)

表4 不同预后患者入院时、治疗6 个月后血清HE4、CXCL9 水平(±s)Table4 Serum HE4 and CXCL9 levels at admission to patients with different prognosis at 6 months after treatment(±s)
组别预后不良者组预后良好者组t 值P 值n 15 67 HE4(U/mL)入院时193.39±35.49 182.32±31.26 1.210 0.230治疗6 个月后137.58±27.25 116.19±24.17 3.027<0.05 CXCL9(pg/mL)入院时247.73±38.84 231.49±34.77 1.601 0.113治疗6 个月后201.85±33.51 174.31±28.26 3.297<0.05
2.5 LN 预后影响因素分析
以是否发生预后不良事件作为因变量(未发生预后不良事件赋值为0,发生预后不良事件赋值为1),将SLEDAI 评分、血清HE4、CXCL9 水平作为自变量,纳入Logistic 多因素回归分析模型,结果显示,SLEDAI 评分、血清HE4、CXCL9 水平是LN 预后的重要影响因素(P<0.05),见表5。
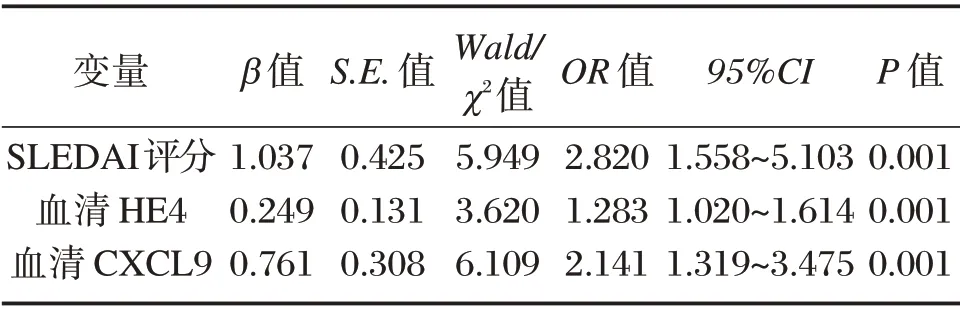
表5 LN 预后影响因素分析Table5 Analysis of factors affecting LN prognosis
2.6 血清HE4、CXCL9水平对预后不良的预测价值
ROC 曲线分析显示,治疗6 个月后CXCL9 预测预后不良AUC 为0.670,大于HE4(0.667),当截断值>191.88 时,敏感度为60.00%,特异度为76.12%。图1。
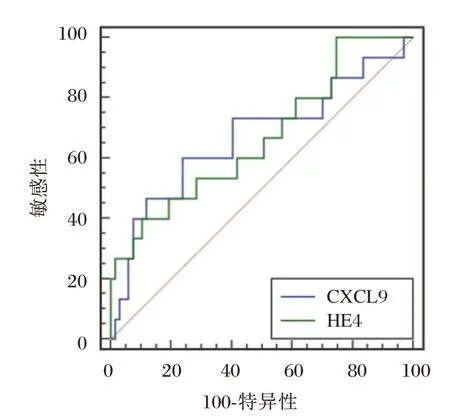
图1 血清HE4、CXCL9 预测预后不良ROC 曲线Figure1 Serum HE4,CXCL9 predict prognosis ROC curve
3 讨论
据相关资料数据统计显示,与无肾脏累及的SLE 患者相比,LN 患者死亡率高2.23 倍,一旦发生终末期肾病,则将死亡风险升高至9.2 倍,防治形势极为严峻[7]。目前,肾组织活检是临床诊断LN 金标准,对治疗及预后判断均具有较高应用价值,但其属于有创检查方式,操作可重复性差,加之采取肾组织标本有限,无法全面反映肾组织病理改变[8]。因此,寻找易获取、非侵入性且灵敏的生物学标志物成为临床重要研究方向。
HE4 属于新型肿瘤标志物,主要表达于近端气管上皮、生殖道、肾脏远曲小管、结肠黏膜、乳腺上皮,在正常人体内表达较低[9-10]。既往临床研究多侧重HE4 与卵巢癌、子宫内膜癌、肺癌等恶性肿瘤发生之间关系分析,证实其与多种恶性病变密切相关[11-12]。近年来,HE4 在肾功能损伤方面的相关机制成为国内外研究热点。桑国耀等[13]报道发现,血清HE4 在慢性肾脏疾病中具有较高辅助诊断价值,其表达水平与病情严重程度呈正相关,有利于准确判断疾病分期,提示血清HE4 可能参与肾脏组织病理改变过程。本研结果显示说明血清HE4 在LN 中呈异常高表达趋势,且与预后情况密切相关。同时,李红卫等[14]研究在SLE 患者预后和风险评估中进行多项指标检测,证实血清HE4在其诊疗及预后中具有重要意义。
临床普遍认为,LN 病理进展的主要机制是免疫复合物形成、沉积于肾小球,导致肾组织细胞产生大量细胞因子,造成免疫细胞功能异常[15]。文献指出,CXCL9 属于IFN-γ 诱导型CXC 类趋化因子,是一种高效淋巴细胞趋化剂,与系统性、器官特异性自身免疫疾病发病机制密切相关[16]。CXCL9 与受体结合后,可激活CD4 阳性的T 细胞、杀伤细胞、巨噬细胞,促使其移动、积聚,最终形成免疫性炎性反应[17]。而LN 患者系膜增生程度异常升高、T 淋巴细胞显著增加被认为与CXCL9 表达在病变发生后持续升高密切相关[18]。本研究还发现,治疗6 个月后,LN 患者血清CXCL9 明显下降,预后良好者下降幅度较为明显,且Logistic 回归分析显示,血清CXCL9 水平是LN 预后的重要影响因素。提示较高血清CXCL9 水平会影响预后,临床应予以重视,及早给予针对性治疗措施。
本研究结果说明临床针对LN 患者可通过检测血清HE4、CXCL9 水平辅助疾病诊断,并于治疗期间监测两者血清水平变化预测预后结局,有利于及时调整治疗方案,积极改善预后情况。
综上可知,血清HE4、CXCL9 在LN 中呈高表达状态,联合检测具有良好诊断价值,是预后的重要影响因素,可作为预后不良的预测因子。

