17β-雌二醇对rBMSCs肝祖细胞定向分化及Wnt信号通路的调控作用
曾令锋 黄俊宇 熊瑶 张志东 王景浩 黄硕 韦宏成★
人工肝支持系统(artificial liver support system,ALSS)作为替代肝脏功能的治疗方法,可暂时延缓或维持晚期肝脏疾病患者的生命,包括非生物型、生物型以及混合型。研究表明,生物型人工肝通过稳定的体外培养肝细胞生物反应器,发挥肝细胞多种功能,能明显降低病死率,是未来人工肝发展的方向[1-2]。因此,如何在体外获得稳定的肝细胞源,是人工肝技术发展的关键。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)可直接分化成肝细胞,降解细胞外基质蛋白,减少细胞外基质沉积,并刺激肝细胞功能的修复和免疫调节等方式,从而改善肝功能,减缓肝硬化进程。另外,研究表明[3-6],雌激素对肝硬化具有保护作用。目前,BMSCs肝向分化的机制和雌激素是否影响大鼠骨髓间充质干细胞(rat Bone marrow mesenchymal stem cells,rBMSCs)肝向分化均尚不清楚。本研究通过体外诱导rBMSCs定向分化成肝祖细胞,探讨17β-雌二醇(17β-estradiol,17β-E2)对rBMSCs肝祖细胞向分化的影响及其潜在作用机制,验证17β-E2是否通过调控Wnt 信号通路影响rBMSCs肝祖细胞向分化。
1 材料与方法
1.1 实验细胞
rBMSCs由暨南大学肿瘤研究所捐赠。
1.2 主要试剂与仪器
α-MEM 培养基(美国HyClone);成骨诱导完全培养基、成脂诱导完全培养基、D-Hanks 平衡盐缓冲液(广州PanEra);优级胎牛血清(天津灏洋);0.25%胰蛋白酶(美国Gibco);17β-雌二醇(西安嘉博盈);CCK-8 试剂盒(北京Dojindo);CD29 抗体、CD45 抗体、CD80 抗体、CD90 抗体(美国Biolegend);Tris-HCL(pH 8.3))(北京索莱宝);β-Catenin 蛋白抗体、Wnt3a 蛋白抗体、LRP-5 蛋白抗体、GAPDH 蛋白抗体、WB 一抗稀释液(美国CST)。单人双面净化工作台(上海一恒SW-CJ-IF)、CO2培养箱(美国Thermo Scientific3111 型)、低速/高速离心机(德国eppendorf Centrifuge 5702)、倒置相差显微镜(日本OLYMPUS CK40)、酶标仪(美国Bio-Rad680 型)、流式细胞仪(美国BD FACSAria 型)。 微量核酸蛋白定量仪(上海Boyue ScanDrop 100)、转膜仪(北京 赛百奥17-4070)、凝胶成像系统(上海天能Tanon-1600)、水平电泳槽(上海天能HE-120)。
1.3 方法
1.3.1 细胞培养与细胞增殖
取P3-P5代的rBMSCs,培养于25 cm2培养瓶中,条件:37℃、5%CO2及饱和湿度培养箱中培养,每3 d 换液,待细胞铺满整个培养瓶,以1∶2 比例进行传代。细胞分为4 组:α-MEM 完全培养基(Control)组、15% FBS 成肝诱导完全培养基(经典)组、(10-6mol/L)17β-E2+α-MEM 完全培养基(E2)组、(10-6mol/L)17β-E2+成肝诱导完全培养基(经典+E2)组。
取P3-P5代的rBMSCs,弃去培养基,用D-Hanks液清洗2 次及胰酶消化制成单细胞悬液。96 孔板中每孔接种2 000 个细胞,设置6 个复孔,共6 行10 列,每孔加入200 μL 完全培养基,放入37℃、5%CO2培养箱中培养;隔日起,每日取1 列6 孔进行CCK-8 细胞活性检测,每孔100 μL 培养基加入10 μL CCK-8 溶液,并置于培养箱中孵育2.5 h 后,置于酶标仪下,调零后测量在450 nm 处的吸光度(OD 值)。以时间(天)为横坐标,OD 值为纵坐标绘制rBMSCs生长曲线。
1.3.2 细胞流式
制成单细胞悬液。2 000 rpm 离心6 min,去上清,用D-Hanks 液重悬细胞,重复3 次,取300 μL 单细胞悬液于1.5 mL 离心管中,再加入700 μL 无水乙醇,充分混匀,用封口膜封闭,4℃过夜。D-Hanks 液洗涤2 次,取500 μL 重悬细胞,1 600 rpm 离心10 min,弃上清,加入200 μL PI 染液,混匀,室温避光孵育15 min,过滤,用流式细胞仪检测细胞周期。
1.3.3rBMSCs表面标志物测定
制成单细胞悬液并调整密度为1×106cells/mL;按操作说明分别加入CD29、CD45、CD80、CD90,37℃下孵育30 min;使用流式细胞仪测定;
1.3.4rBMSCs骨向及脂向分化能力鉴定
按1.4.1 操作培养细胞,待细胞融合60%左右分别加入成骨诱导培养基、成脂诱导培养基,待细胞长满后,弃去培养瓶中培养基,用D-Hanks 液清洗3 次,分别加入95%乙醇固定10 min,用蒸馏水漂洗3 次,分别加入0.1% Tris-HCL-茜素红染液、饱和油红O 染液37℃孵育45 min、60 min,用蒸馏水漂洗多余Tris-HCL-茜素红染液,60%异丙醇漂洗多油红O 染液,置于显微镜下观察并拍照。
1.3.5rBMSCsAFP 的测定
按1.4.1 及1.4.2 操作培养细胞,第3、6、10 天对4 组细胞重悬并进行裂解,取300 μL 置于化学发光免疫分析仪上测定各组AFP 值。
1.3.6 Wnt 信号通路的调控作用
按1.4.1及1.4.2操作培养细胞,制成单细胞悬液,离心后加入细胞裂解液,置于冰上;提取总蛋白,微量核酸蛋白定量仪测定总蛋白浓度,以1∶4 比例加入蛋白上样缓冲液,充分混匀,99℃水浴加热10 min,冷却至室温,灌胶、电泳,转膜,一抗(β-Catenin、Wnt3a、LRP-5)4℃孵育过夜,二抗37℃孵育2 h,显影。
1.3.7 统计学方法
采用SPSS 13.0 软件对实验数据进行统计分析,计量资料以()表示,多组间的差异比较采用单因素方差分析,两组间的差异比较采用Bonferroni 检验分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 rBMSCs 的鉴定
镜下见rBMSCs呈贴壁生长,细胞呈放射状、梭形或平行排列。且细胞形态随传代次数的增多而表现的越均一。见图1A。rBMSCs呈倒“S”形增长,从第2 d 开始快速增长,第8 d 到达顶峰,随后逐渐进入平台期,增长较为缓慢。见图1B。rBMSCsG0/G1期细胞为87.5%,G2+S/M 期细胞为12.5%,表明大部分rBMSCs处于静息期,只有少部分细胞处于增殖期,符合干细胞生物学特性。见图1C。
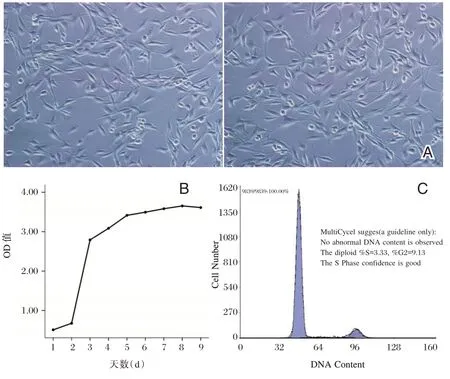
图1 rBMSCs 的鉴定Figure1 Identification of rBMSCs
2.4 rBMSCs 表面标志物的鉴定
结果显示rBMSCs表达CD29、CD90 的阳性率为99.72%、97.45%;而CD45、CD80 的阳性率为1.28%、1.01%,符合干细胞生物学特性。见图2。

图2 P4代rBMSCs 表面标志物的鉴定Figure2 Identification of surface markers of P4
2.5 rBMSCs 骨向及脂向分化能力鉴定
成骨诱导第14 天后,对rBMSCs进行茜素红染色,镜下可见矿化结节中沉积的钙盐被染成红褐色,而周围细胞未着色。见图3A。对rBMSCs进行油红O 染色,镜下可见脂肪细胞因脂质累及被染成红色。见图3B。

图3 rBMSCs 的骨向及脂向分化能力鉴定(×100)Figure3 Identification of differentiation potency ofrBMSCs from P4 generation(×100)
2.7 rBMSCs 向肝祖细胞定向诱导后形态学变化
第3 天,经典组与经典+E2组的rBMSCs由长梭形逐渐呈多边形、类圆形改变,细胞增殖速度减缓,核浆比例变小,贴壁能力逐渐减弱,至第10 天,大多数细胞失去原有形态,呈三角形或肝板样排列,与肝祖细胞形态相似。而Control 组和E2组无明显形态学改变,基本呈均匀的长梭形。见图4。

图4 各组rBMSCs 定向诱导3、6、10 d 后细胞形态(×100)Figure4 Cell morphology after 3、6 and 10 days ofrBMSCs induction in each group(×100)
2.8 各组rBMSCs AFP 值的测定
Bonferroni 检验结果,不同组间AFP 值均数显著不同(F=8.948,P=0.012),差异有统计学意义,而不同天数间AFP 值均数无明显改变(P>0.05),差异无统计学意义。经典组、经典+E2组的AFP 值显著增高于Control、E2组(P<0.05),且经典+E2组AFP 值显著高于经典组(P<0.05),而Control、E2组AFP 值均为0 ng/mL。见图5。
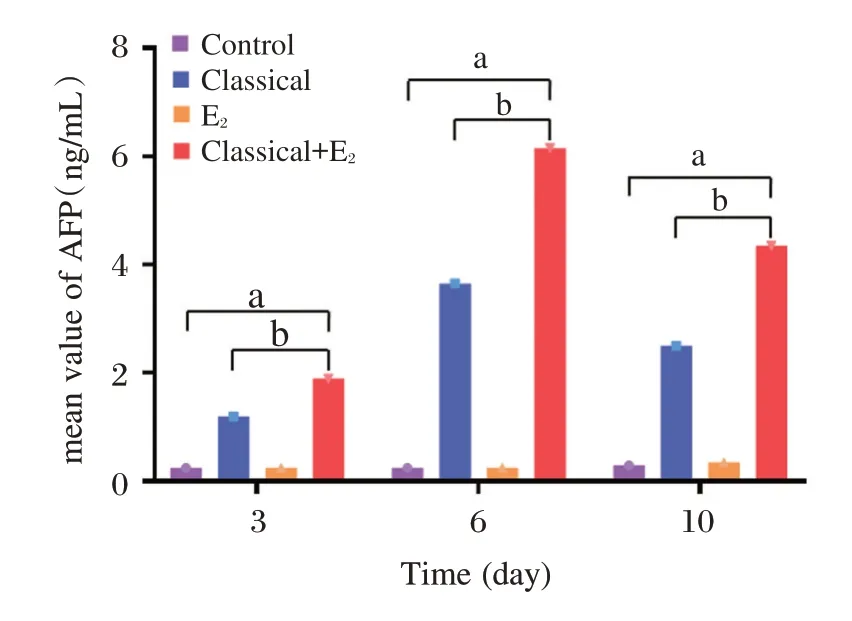
图5 各组rBMSCs AFP 均值Figure5 Average AFP ofrBMSCs in each group
2.9 各组rBMSCs 肝祖细胞向分化过程中Wnt 信号通路的表达情况
运用Western Blot 法分别检测第3、6、10 天各组rBMSCs 中Wnt3a、β-Catenin、LRP-5 的蛋白表达量。与Control 组及E2组相比,经典组与经典+E2组中的β-Catenin、Wnt3a 表达量均显著降低(P<0.05),且经典+E2组β-Catenin、Wnt3a 表达量均显著低于经典组(P<0.05);而4 组间LRP-5 的表达差异均无显著性(P>0.05);且不同天数间各组β-Catenin、Wnt3a、LRP-5 的表达差异均无显著性(P>0.05)。见图6。
3 讨论
肝纤维化是一个不可逆的过程,若发展为肝硬化失代偿期,目前治疗手段有限,且病死率高。最近,肝细胞移植成为了国内外研究的热点[7-8],但如何构建稳定安全的功能性肝细胞体外培养体系仍是一个难题。BMSCs 来源于骨髓,是一类具有多向分化潜能的干细胞,其易于获取、增殖迅速及无排斥反应等优点,无需考虑伦理问题,是较为理想的肝细胞源。

图6 各组Wnt 信号蛋白的表达Figure6 Expression of Wnt signaling protein in each group
rBMSCs源于大鼠骨髓,倒置显微镜下观察原代的rBMSCs多呈类圆形,贴壁生长,随着传代次数增多,逐渐变为长梭形,呈簇状生长,且形态越均一。rBMSCs在骨髓有核细胞中含量不足0.1%,且其生物学特性易在体外扩增时被破坏[9],由此,寻找一种合适的体外培养体系极为重要。本实验运用全骨髓贴壁法体外培养rBMSCs,通过验证,均符合干细胞生物学特性,从而建立了稳定的rBMSCs体外培养体系。
研究发现[10-11],雌激素作用于BMSCs 时,除了影响其分泌生长激素的量,还可降低在氧化应激时的凋亡率,其中可能与促进抗凋亡因子及抑制凋亡因子的表达相关。而雌激素影响BMSCs 的增殖、分化和迁移的机制主要通过核受体及质膜受体信号通路,前者指雌激素与雌激素受体相结合,作为转录因子启动基因转录,从而刺激BMSCs的核酸合成;后者则指通过与质膜上表达的雌激素受体相结合,激活细胞内信号通路,影响BMSCs的增殖[12-13]。本实验结果证实17β-E2可促进rBMSCs向肝祖细胞分化,其机制可能与17β-E2促进rBMSCs活化,抑制其凋亡,进而促使更多的rBMSCs向肝祖细胞分化相关。
Wntβ-catenin 信号通路作为经典的Wnt 信号通路,在细胞的增殖分化、动物胚胎形成等事件中起重要作用[14-16]。研究发现,Wntβ-catenin 信号通路在非肝细胞的内胚层细胞转变成肝细胞的过程中起着关键的作用。本实验通过Wersten Blot 法检测4 组rBMSCsWnt3a、β-Catenin、LRP-5 的蛋白表达量,结果示经典+E2组Wnt3a、β-Catenin 蛋白含量明显低于其它3 组,从而推测17β-E2可能通过调控Wntβ-catenin 信号通路来促进rBMSCs向肝祖细胞分化。其机制可能与17β-E2下调Wntβcatenin 信号蛋白Wnt3a 和β-Catenin 有关。

