醋酸染色联合窄带成像对胃黏膜肠上皮化生的诊断价值
蒋 淼, 李正阳, 周 皓, 张轶群
1. 复旦大学附属金山医院消化内科,上海 201508 2. 复旦大学附属中山医院内镜中心,上海 200032
胃癌是最常见的恶性肿瘤之一,病死率在所有恶性肿瘤中位于第三位[1]。胃癌发病被认为是一个多阶段进行性发展的过程, 包括浅表性胃炎-萎缩性胃炎-胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)-胃黏膜上皮内瘤变-肠型胃癌[2]。其中GIM为胃癌癌前状态,GIM的病理组织学分级和胃的分布范围与胃癌发生率密切相关[3]。
病理学检查是诊断GIM的金标准。GIM在常规白光内镜检查(esophagogastroduodenoscopy,EGD)下的表现缺乏特异性,所以常规内镜诊断GIM仍较困难[4]。醋酸染色(acetic acid chromoendoscopy, ACC)是一种染色内镜技术,在肠化柱状上皮可产生白化增强和延迟褪色现象[5]。窄带成像(narrow band imaging,NBI)是一种电子染色技术,可利用窄带光来强化黏膜表面结构的视觉图像。本研究比较EGD模式、ACC模式、ACC+NBI模式对GIM的诊断效果,并评估ACC+NBI模式对GIM的筛查价值。
1 资料与方法
1.1 研究对象 收集2018年4月至6月就诊于复旦大学附属金山医院的幽门螺杆菌(helicobacter pylori, HP)抗体血清学阳性患者资料,共纳入93例。纳入标准:40~75岁的HP抗体血清学阳性患者。排除标准:(1)有进展期胃癌、胃切除手术史、胃活动性出血患者;(2)近期使用抗血小板药物, 抗凝药物或凝血功能异常患者;(3)对醋酸过敏者;(4)不同意接受该检查患者;(5)各种原因无法完成内镜检查者。本研究经过本院伦理委员会批准,患者均知情本研究并签署知情同意书。
1.2 设备与材料 内镜主机为Olympus 290(奥林巴斯,日本),内镜为Olympus GIF-HQ290(奥林巴斯,日本),喷洒管为链蛋白酶颗粒(2万U/袋,泰德制药,中国),二甲硅油散剂5 g(含0.3g二甲硅油,健能制药,中国),6%醋酸(500 mL/瓶,宝鼎酿造,中国)。
1.3 内镜前准备 患者于内镜检查开始前20 min口服链蛋白酶颗粒20 000 U、5%碳酸氢钠溶液20 mL、二甲硅油散5 g、生理盐水30 mL组成的混合液,以祛除胃黏膜表面的黏液和泡沫。所有患者由麻醉师采用丙泊酚静脉麻醉。6%醋酸5 mL加入15 mL蒸馏水配制成1.5%醋酸溶液[6-7]。
1.4 内镜操作过程 冲洗完胃腔后,常规对全胃各部分仔细观察,拍摄并记录有无GIM病灶。观察结束后自胃窦至胃体均匀喷洒稀释至1.5%的醋酸溶液,30 s后在EGD模式下观察并记录有无白化增强病灶。然后切换至NBI光学模式进行观察,同样判定有无白化增强病灶。
1.5 肠化病灶判定和表面结构分类 喷洒醋酸后胃肠化黏膜可表现为一过性白化现象,GIM病灶处可出现白化增强及白化延迟,NBI下观察可使白化效果更加增强,与正常胃黏膜有明显分界。根据醋白反应不同特点做出判断[8-9]:正常白化;减弱白化;增强白化。对存在增强白化且有明显分界线的病灶可判定为GIM可能,并近焦观察,参照Tanaka[5]增强放大内镜对胃黏膜表面结构进行分型,详见图1,最后结合病理结果进行分类。
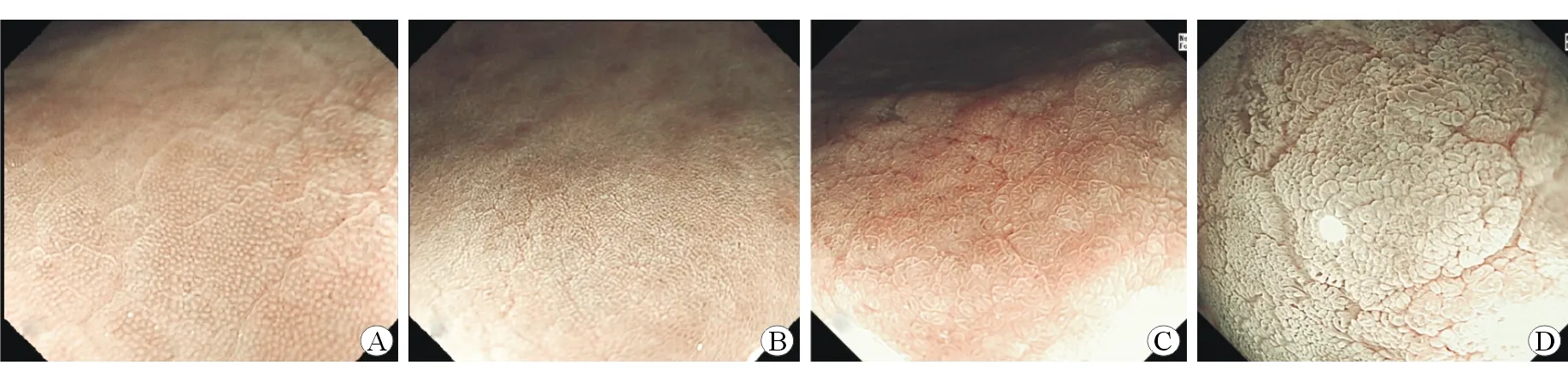
图1 喷洒醋酸后增强的胃黏膜表面微结构
A:typeⅠ型,胃小凹呈大小、排列规则的小类圆型结构,正常白化;B:typeⅡ型,胃小凹呈裂隙样规则排列,正常白化;C:type Ⅲ型,胃小凹裂隙样规则排列,扩大、不平,白化减弱;D:type Ⅳ型,胃小凹成绒毛状、短指状隆起规则排列,白化增强
1.6 活检 先予以常规EGD观察摄图,如发现可疑肠化病灶,则由助手在图像上标记可疑肠化病灶,如未发现可疑肠化病灶则不标记。同样方法进行ACC和NBI+ACC观察。最后按3种观察模式各自标记点分别进行活检并记录。如未发现可疑肠化病灶,则按新悉尼系统标准[10]对胃窦大弯、胃窦小弯、胃角、胃体大弯、胃体小弯处进行至少5点活检。
1.7 病理学检测 每位患者均进行活检,所有活检标本均固定在4%的福尔马林溶液,包埋于石蜡中进行H-E染色。所有标本由同一位丰富经验的病理医生进行检测,该医生对本研究中所有患者的内镜诊断均不知情。GIM病理诊断标准参照新悉尼系统分类法[10]。
1.8 统计学处理 采用SPSS 17.0对数据进行分析,采用χ2检验对2组进行比较。以病理组织学为参考值, 绘制ROC曲线,比较3种模式下的诊断效果,并对结果进行Kappa一致性检验。检验水准(α)为0.05。
2 结 果
2.1 患者一般资料 本研究共纳入93例病例。患者平均年龄为57.2岁,男性42例(45%),女性51例(55%),63例患者病理诊断为GIM,见表1。

表1 患者一般资料
2.2 不同方案下GIM诊断结果的比较 病理诊断为金标准。EGD模式下发现疑似GIM病例23例,其中19例经病理诊断为GIM;ACC模式观察发现疑似GIM病例52例,其中47例经病理诊断为GIM;ACC+NBI模式观察发现疑似GIM病例64例,其中58例经病理诊断为GIM,见表2。
在EGD下判断为GIM阴性的70例患者中有28例通过ACC观察发现并病理诊断为GIM,在ACC判定为GIM阴性的41例患者中有11例患者通过ACC+NBI观察发现并病理诊断为GIM,详见图2。
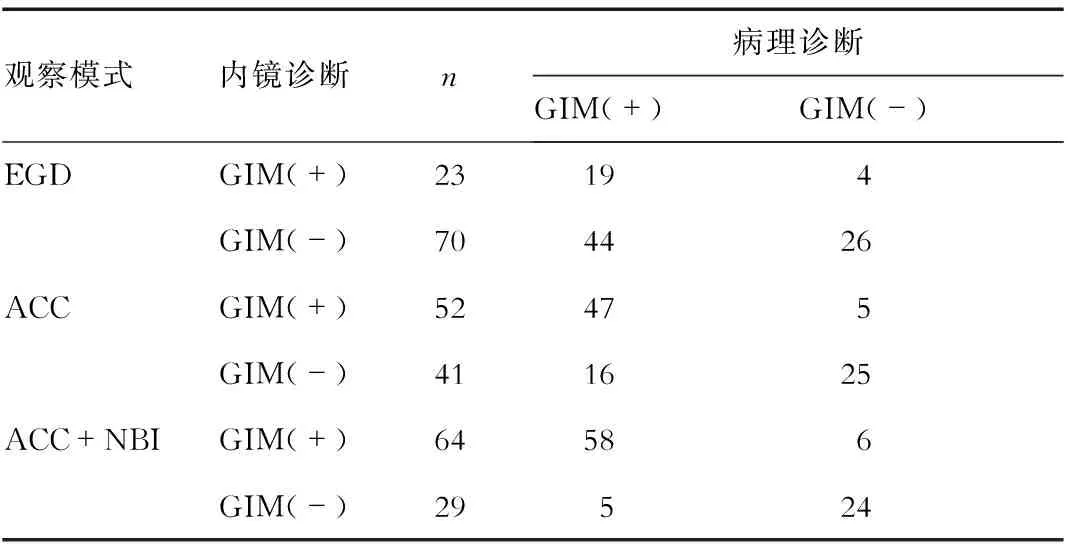
表2 不同方案下GIM诊断结果的比较
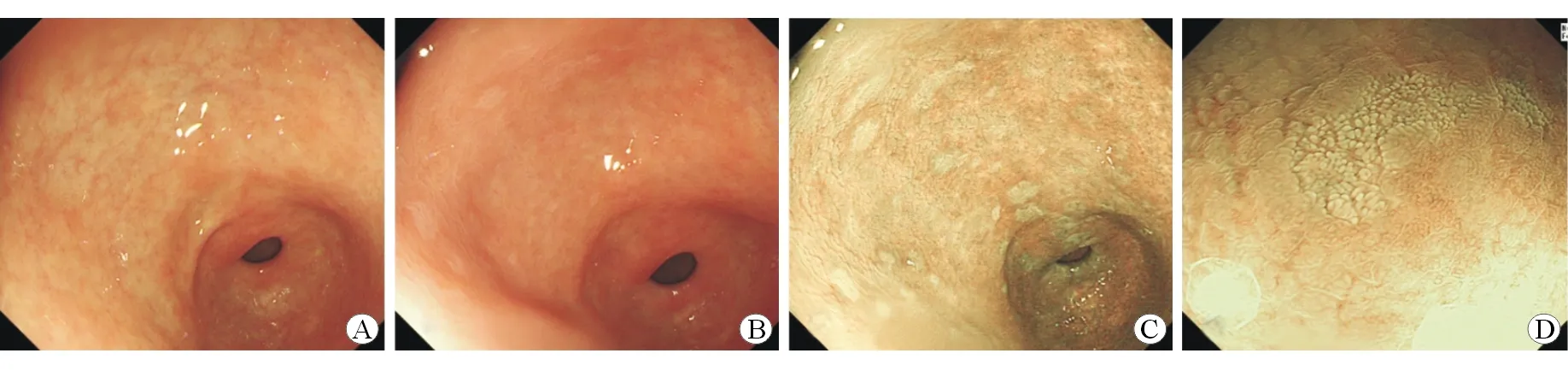
图2 典型病例3种观察模式下GIM检查图像
A:白光下胃窦小弯图像,未见明显GIM病灶;B:醋酸染色后下胃窦小弯图像,可见散在白化灶不明显;C:切换至NBI下观察,可见明显的多处增强白化灶,分界明显;D:近距离切换至近焦模式,可见增强白化病灶表面结构成短绒毛状,分界清楚,type Ⅳ型,活检病理为GIM,中度
2.3 ROC曲线分析 结果(图3、表3)显示,EGD模式的灵敏度为30.16%,特异度为86.67%,AUC为0.584;ACC模式的诊断灵敏度为74.60%,特异度为83.33%,AUC为0.790;ACC+NBI模式的诊断灵敏度为92.06%,特异度为80.00%,AUC为0.860。3种模式诊断灵敏度的差异均有统计学意义(P<0.01),特异度差异均无统计学意义。
2.4 Kappa一致性结果分析 EGD、ACC和ACC+NBI与病理结果的一致性Kappa值分别为0.125(P=0.079),0.529(P<0.001),0.727(P<0.001)。EGD与病理结果的一致性较差,ACC与病理结果的一致性中等,而ACC+NBI与病理结果的一致性较高,见表3。
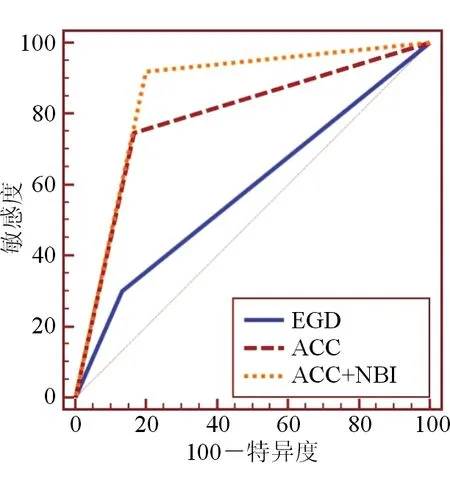
图3 3种观察模式下诊断的ROC曲线图
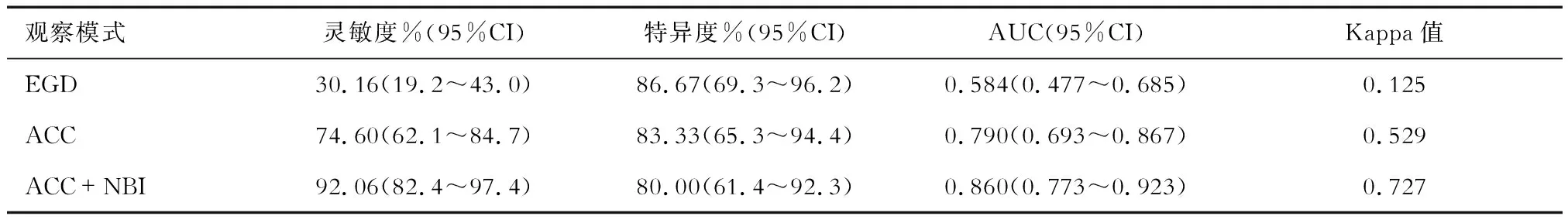
表3 3种观察模式下ROC曲线和Kappa一致性分析
3 讨 论
目前国内外对胃黏膜GIM的评估参照OLGIM(operative link for gastric intestinal metaplasia assessment)方案[11-12]。OLGIM是从慢性胃炎新悉尼系统发展而来的,认为分期为Ⅲ/Ⅳ期为胃癌高风险患者[13]。评估中需要对胃窦大小弯、胃角、胃体大弯、胃体小弯进行多点活检。GIM病灶在常规内镜下表现为淡黄色、瓷白色小结节,或呈弥漫型及鱼鳞状颗粒型。大部分为多灶性糜烂、水肿,与非萎缩性糜烂较难区别,常规内镜下表现的特异性不高,检出率仅12%~38%[14-15],所以OLGIM在临床实际应用时存在活检遗漏或者随机抽样活检,导致OLGIM评估准确性不足。
近年来内镜技术的发展增加了GIM的检查方法,如染色内镜(亚甲蓝、醋酸)、NBI、共聚焦激光内窥镜等[16-18],但目前尚无统一的染色内镜诊断标准。ACC是利用醋酸使柱状上皮细胞内细胞质蛋白的可逆变性,从而使柱状上皮黏膜结构产生变化,更加容易被识别。ACC与放大内镜结合技术最早由Guelrud等[5-6]报道,用于识别Barrett食管中的肠化病灶,并将其命名为增强放大内镜。Tanaka首次将ACC用于胃部内镜检查,可有效识别GIM。但在实际操作中ACC的白化增强在白光内镜检查中并不都是十分明显,特别是散在分布的肠化病灶不容易被分辨。当病灶醋白反应不明显时,会给医生带来困惑导致误诊,主观性很强。NBI是一种内窥镜成像技术,可识别GIM特有的“亮蓝脊征”,对GIM的诊断敏感性可达89%,特异性为93%[19-20]。但是NBI是弱光,并不适合做中远景观察[21],也只能在白光下发现可疑病灶后抵近观察才能起作用,无法在全胃范围达到筛查目的。
本研究先全胃喷洒醋酸进行染色,使GIM病灶黏膜表面结构发生变化。然后利用NBI的窄波特点来强化醋酸对GIM病灶的白化效果,利用NBI的弱光特点提高了GIM病灶与周围正常黏膜的对比度,从而增加了病灶检出率。研究中ACC+NBI模式下对GIM诊断灵敏度达92.06%,明显高于常规EGD的30.16%和ACC模式的74.60%。研究中也发现在ACC模式下诊断为GIM阴性的41例患者中有11例患者通过ACC+NBI观察发现并病理诊断为GIM,表明ACC+NBI模式在对GIM诊断灵敏度上确实要优于ACC模式。ROC曲线分析结果显示,ACC+NBI模式的AUC大于ACC模式,且完全包含无相交,显示ACC+NBI方法要优于ACC方法。ACC+NBI模式与病理结果的一致性Kappa值为0.727,一致性较高,明显优于ACC组(0.529)。表明ACC+NBI方法能很好地帮助医生进行GIM病灶筛查。
本研究也存在不足之处:(1)由于常规胃镜检查体位原因,胃底及胃体大弯上部常常为重力最低位,所以喷洒后的醋酸往往积聚在胃底处,导致该部位黏膜在醋酸持续作用下处于持续白化状态。故ACC无法对胃底及胃体大弯上部黏膜进行有效识别,容易误判,出现假阳性诊断。由于研究中胃底及胃体大弯上部出现GIM的病例仅1例,故无法判断该影响;(2)由于本研究醋酸染色后,先进行常规EGD然后再NBI模式观察,且不同个体白化延迟时间不同。为了保证能在NBI模式下能观察到醋酸白化现象,所以EGD在染色后30~90 s内进行,约60 s的时间也可能导致医生无法完全详尽地观察,影响ACC观察的数据准确性;(3)研究发现ACC+NBI模式对散在分布的小病灶检出优势较明显,但对大范围的GIM较EGD和ACC无明显优势;(4)目前未发现内镜下表现与其病理组织学肠化严重程度分级有关联。
综上所述,随着国内胃癌早期筛查工作的广泛开展,除了提高早期胃癌诊断能力,如何通过OLGIM分级进行管理和随访好胃癌高风险人群也是很重要的前期工作。内镜下ACC+NBI观察模式可以快速显示胃黏膜GIM病灶,是胃黏膜GIM诊断的良好工具。

