新型冠状病毒肺炎危重症患者营养治疗专家建议
中国营养学会临床营养分会重症营养管理项目组 专家组成员 张家瑛, 邵春海, 杨嘉红, 苏健光, 钱 甜, 饶志勇, 蔡 骏, 张 明, 韩 磊, 李 莉, 陆冬梅, 田 芳, 周 赟, 张 静, 唐 敏0, 吴 江, 徐仁应, 吴 静, 刘 珍, 耿 峰, 陈 伟*, 刘景芳*
1. 复旦大学附属华山医院临床营养科,上海 200040 2. 复旦大学附属儿科医院临床营养科,上海 201102 3. 四川大学华西医院临床营养科,成都 610041 4. 上海中医药大学附属龙华医院临床营养科,上海 200032 5. 北京大学深圳医院临床营养科,深圳 518036 6. 青岛大学附属医院临床营养科,青岛 266005 7. 新疆医科大学第一附属医院临床营养科,乌鲁木齐 830054 8. 复旦大学附属华山医院重症医学科,上海 200040 9. 复旦大学附属华山医院护理部,上海 200040 10. 安徽医科大学第四附属医院消化肝病科&临床营养科,合肥 230000 11. 上海交通大学医学院附属新华医院临床营养科,上海 200092 12. 上海交通大学医学院附属仁济医院临床营养科,上海 200127 13. 广东省中山市陈星海医院临床营养科,中山 528400 14. 江西省鹰潭市人民医院临床营养科,鹰潭 335000 15. 湖北省武汉市中心医院重症医学科,武汉 430010 16. 中国医学科学院北京协和医院临床营养科,北京 100730
新型冠状病毒肺炎COVID-19危重症患者(以下简称“新冠危重症患者”)是指符合以下任何一条的确诊患者:出现呼吸衰竭,且需要机械通气;出现休克;合并其他器官功能衰竭需收入重症监护室(ICU)治疗。
新冠危重症患者常存在明显的全身炎症反应,机体处于高分解代谢状态[1-3]。由于多种应激相关激素和促炎症细胞因子的释放以及供氧不足等原因,其营养代谢特点主要表现为:(1)葡萄糖氧化供能减少,糖酵解增加,糖异生增强,胰岛素抵抗,血糖增高;(2)蛋白质分解增加,急性期蛋白合成增加,肌肉蛋白合成减少,氨基酸谱改变,如支链氨基酸(BCAA)浓度下降;(3)脂肪动员和分解增加;(4)多种维生素和微量元素消耗增加。在这种情况下,患者容易出现营养不良,且对于伴有慢性基础疾病的患者,营养不良的发生率更高。
发生营养不良的主要原因是机体能量供需的失衡,包括:(1)能量消耗增加。由于发热、呼吸肌做功增加、机械通气等因素,机体能耗增加,对能量的需求也增加。(2)代谢紊乱。葡萄糖利用障碍,蛋白质和脂肪分解增加,机体出现负氮平衡。(3)摄入不足与营养吸收不良。长期卧床后食欲减退、呼吸困难、机械通气、意识障碍等因素可导致患者摄入不足;新冠病毒可直接攻击胃肠道,药物治疗或肠内营养不耐受等引起的腹泻、恶心、呕吐等胃肠道症状或功能障碍,可导致营养吸收不良及丢失增加[4]。
新冠危重症患者如果出现营养不良,不仅会降低呼吸肌功能,出现呼吸肌无力,还会加重免疫功能障碍,使病情进一步恶化。因此,对新冠危重症患者积极进行营养不良风险筛查,以期及早发现营养不良患者,并予以合理的营养治疗,是新冠危重症患者的重要治疗措施之一。
1 新冠危重症患者的营养筛查
1.1 筛查工具 对于新冠危重症患者,建议进行动态营养风险筛查,可采用NRS 2002进行营养风险筛查(表1)。结合抗疫前线的实际情况,一些危重症患者的体质量和饮食史等资料可能难以获取,NRS 2002的应用受到一定限制。在这种情况下,推荐采用改良的NUTRIC评分(表2)进行筛查。
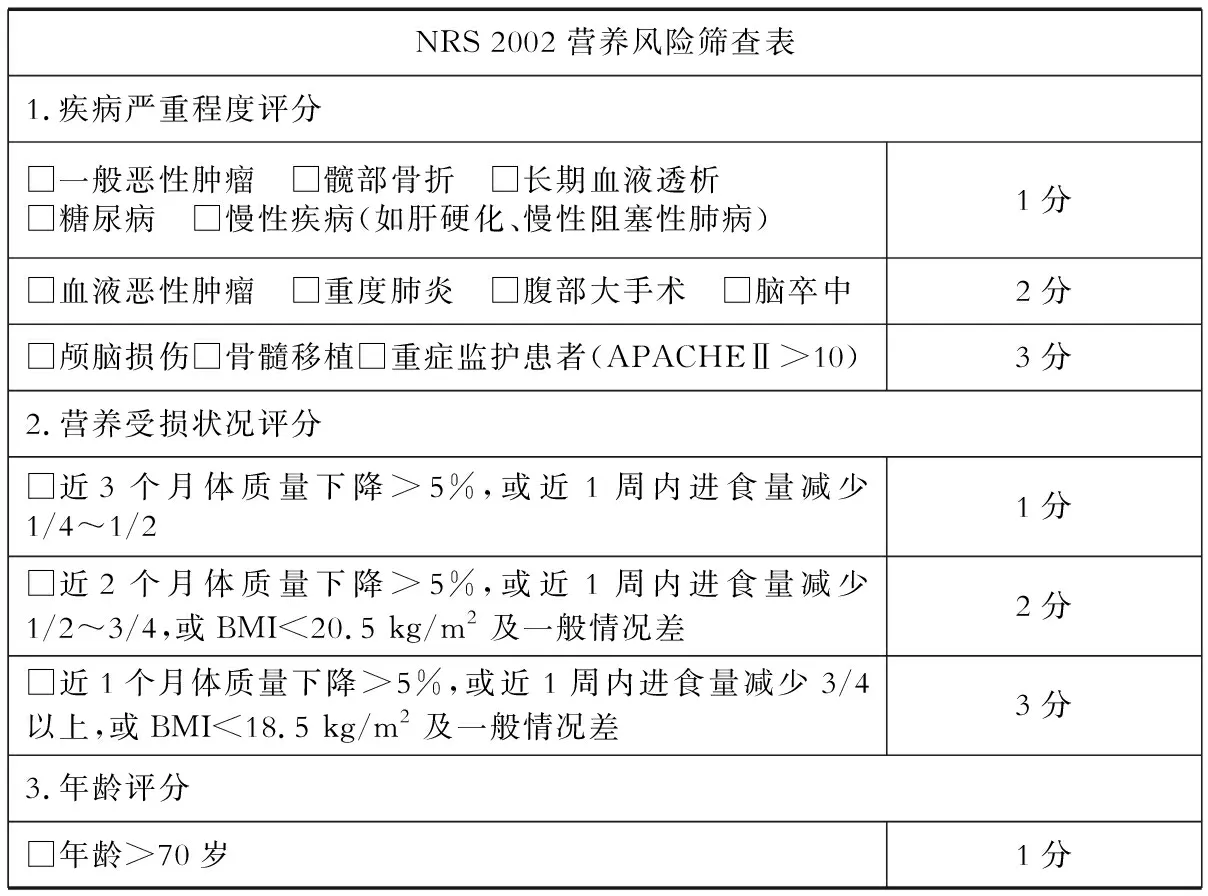
表1 NRS 2002营养风险筛查表
总分=疾病严重程度评分+营养受损状况评分+年龄评分
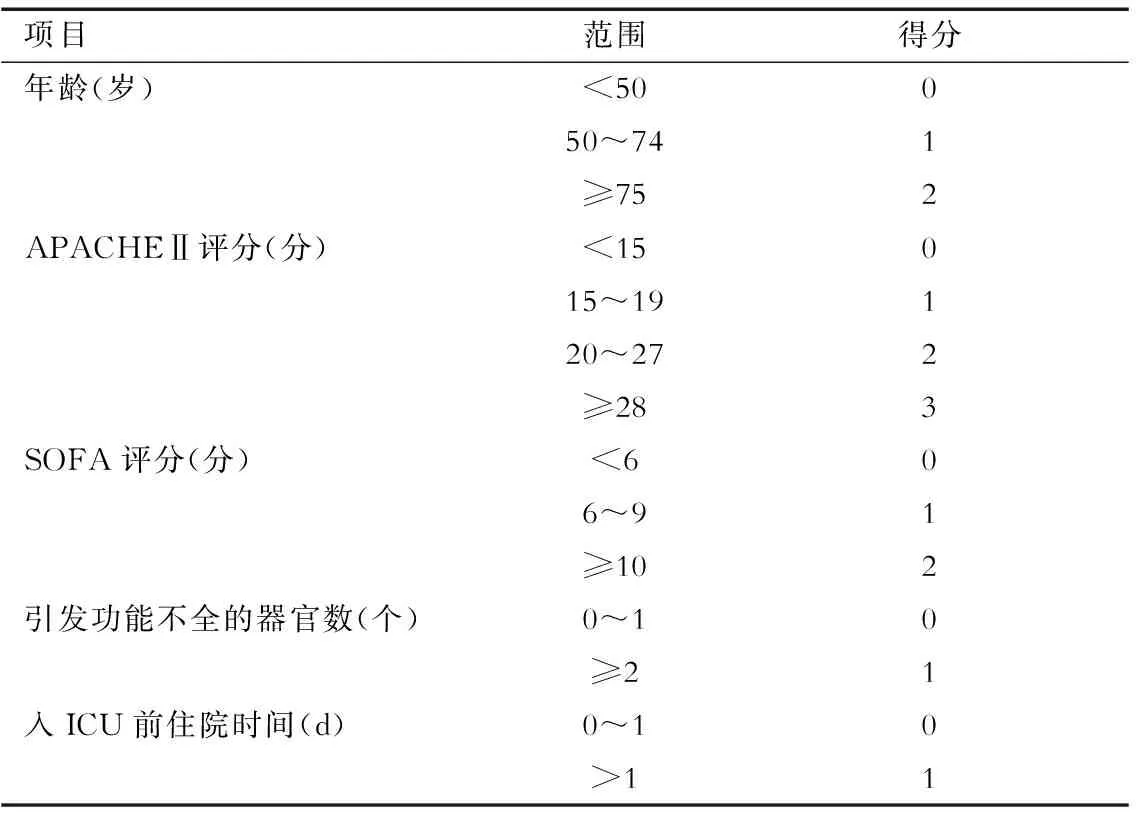
表2 改良的NUTRIC评分表
APACHEⅡ评分:急性生理与慢性健康评估Ⅱ评分;SOFA评分为序贯性脏器功能衰竭评分;总分为各项得分之和
1.2 评判标准 NRS 2002评分≥3分,提示有营养风险,需要进行营养干预;NRS 2002评分≥5分或改良NUTRIC评分≥5分(不考虑IL-6),则提示患者有较高的营养风险,要尽早给予营养支持[1,5]。新冠危重症患者的营养状况可能会有快速变化,对首次筛查结果为低营养风险的患者,建议3 d后再次进行筛查。
2 新冠危重症患者的营养治疗
2.1 营养目标量的确定
2.1.1 能量
能量目标量:间接测热法(代谢车)是目前公认的测定人体实际能量消耗值的理想方法,但抢救新冠危重症患者的前线医疗资源比较匮乏,常无代谢车配备,且该方法操作繁琐,易交叉感染,故并不适用。因此推荐可通过呼吸机测得的VCO2值来计算静息能量消耗(resting energy expenditure,REE),计算公式为:REE(kcal)=VCO2×8.19。如无法进行VCO2测定,则根据体质量估算能量需要量:对于非肥胖危重症患者,能量目标推荐量为每天25~30 kcal/kg(用理想体质量计算)[5,7-9],理想体质量(kg)=身高(cm)-105(适合于成年男性),理想体质量(kg)=[身高(cm)-100]×0.85(适合于成年女性)。对于肥胖危重症患者,如BMI为30~50 kg/m2,能量目标推荐量为每天11~14 kcal/kg(用实际体质量计算)。如BMI>50 kg/m2,能量目标推荐量为每天22~25 kcal/kg(用理想体质量计算)[5]。另外,需将药物如含葡萄糖液体(如右旋葡萄糖:3.4 kcal/g、甘油/丙三醇:4.3 kcal/g)和含脂肪液体(如丙泊酚:1.1 kcal/mL)等提供的额外能量考虑进去[5]。
以低剂量起始喂养,3~7 d达到能量目标量:对于血流动力学不稳定的新冠危重症患者,应在液体复苏完成、血流动力学基本稳定后,尽早启动营养支持[7]。在感染等应激初期,应以低剂量起始喂养,营养供给不应超过目标量的70%[6],也可尝试允许性低热量(≤50%的目标喂养量[10]或每天10~15 kcal/kg[11])。平稳后应在3~7 d逐渐增加能量摄入至目标量[8]。
2.1.2 蛋白质
蛋白质目标量:提高蛋白质供能比,由平时的15%提高到25%~30%[8]。也可以根据体质量估算:对于非肥胖患者,推荐每天蛋白质目标量为1.2~2.0 g/kg(用理想体质量计算)[5,8];对于肥胖患者,如BMI为30~40 kg/m2,蛋白质目标量为2 g/kg(用理想体质量计算);如BMI≥40 kg/m2,蛋白质目标量为2.5 g/kg(用理想体质量计算)[5]。肾功能受损者且未行连续肾脏替代疗法(CRRT)应适当减少蛋白质的摄入;对于行CRRT的患者,应增加蛋白质摄入,目标量为1.5~2.0 g/kg。
提高优质蛋白质和支链氨基酸(BCAA)供给:提高优质蛋白质的供给,如乳清蛋白及其他动物蛋白,使其比例达到蛋白质总量的50%,更有益于预防肌肉减少、促进下床活动,增强呼吸肌力量、促进咳嗽排痰[8]。推荐补充BCAA并提高其比例到35%,不仅可显著抑制肌肉分解,还可以改善胰岛素抵抗,增强干扰素疗效[8]。
非蛋白热能/氮比:推荐降低非蛋白热能/氮比为(100~150 kcal)∶1 g[8]。
2.1.3 脂肪
脂肪目标量:推荐膳食及管饲营养的总脂肪供能比达到总能量的25%~30%[12]。对于肠外营养的新冠危重症患者,由于脂肪的吸收和代谢均发生改变,静脉注射过高的脂肪会导致脂质过负荷和毒性,导致高三酰甘油血症和肝功能异常,而低血浆三酰甘油浓度水平与改善的生存相关[6]。因此推荐每天静脉脂肪为1 g/kg,最多不超过1.5 g/kg,并且需要根据个体化耐受度调整剂量[6]。
脂肪的种类:对于可经口饮食的新冠危重症患者,通过多种烹调植物油增加必需脂肪酸的摄入,特别是单不饱和脂肪酸的植物油[12]。对于肠外营养的新冠危重症患者,优先使用中长链脂肪酸,与长链脂肪酸相比,可以提高脂肪酸的氧化利用[8],但不建议使用纯大豆油脂肪乳剂。另外,危重症患者使用ω-3脂肪酸后感染、死亡风险更低,住院时间更短,故推荐提高鱼油(以ω-3脂肪酸为主)比例[8]。ω-9脂肪酸具有免疫中性作用,对血流动力学、内皮细胞功能、免疫功能和肝脏功能干扰更小,故推荐提高橄榄油(以ω-9脂肪酸为主)比例[8]。
2.1.4 糖脂比 危重症患者内源性的葡萄糖产生增加,而且存在胰岛素抵抗。过多的葡萄糖会导致高血糖,增加CO2产生,增加脂肪合成,增加胰岛素需要量。另外,与以脂肪为主的供能相比,以葡萄糖为主的供能对于节约蛋白质不存在优势。因此推荐降低葡萄糖供能比例,糖/脂为(50~70)/(50~30)[8]。碳水化合物最低需要量为葡萄糖每天2 g/kg。对于新冠危重症患者,应持续动态监测血糖水平,血糖目标值应控制在7.8~10.0 mmol/L[10]。高血糖(血糖水平>10 mmol/L)会增加患者死亡率和感染并发症,应尽量避免[6]。如血糖持续大于20 mmol/L,建议用微量泵输注胰岛素[10]。
2.1.5 液体量 遵循液体疗法的一般原则,即稳定患者每天30~40 mL/kg。危重症患者满足主要营养素需求的最小液体量,量出为入。体温每升高1℃,补3~5 mL/kg(按4 mL/kg计算)[8]。新冠危重症患者多存在肺水肿、液体积聚等情况,在维持液体平衡的同时,更加需要防止液体过量,特别是静脉输液量[8]。
2.1.6 微量营养素 新冠危重症患者,均应常规补充多种微量营养素,特别是维生素B1、维生素C、硒、锌,剂量参照标准为正常人的推荐营养素摄入量值(RNI)[6,8-9]。全肠外营养的微量营养素推荐量见表3[13-14]。当患者合并肝肾功能受损、胃肠道丢失增加、再喂养综合征或电解质紊乱等情况时,应根据实际情况加以调整。
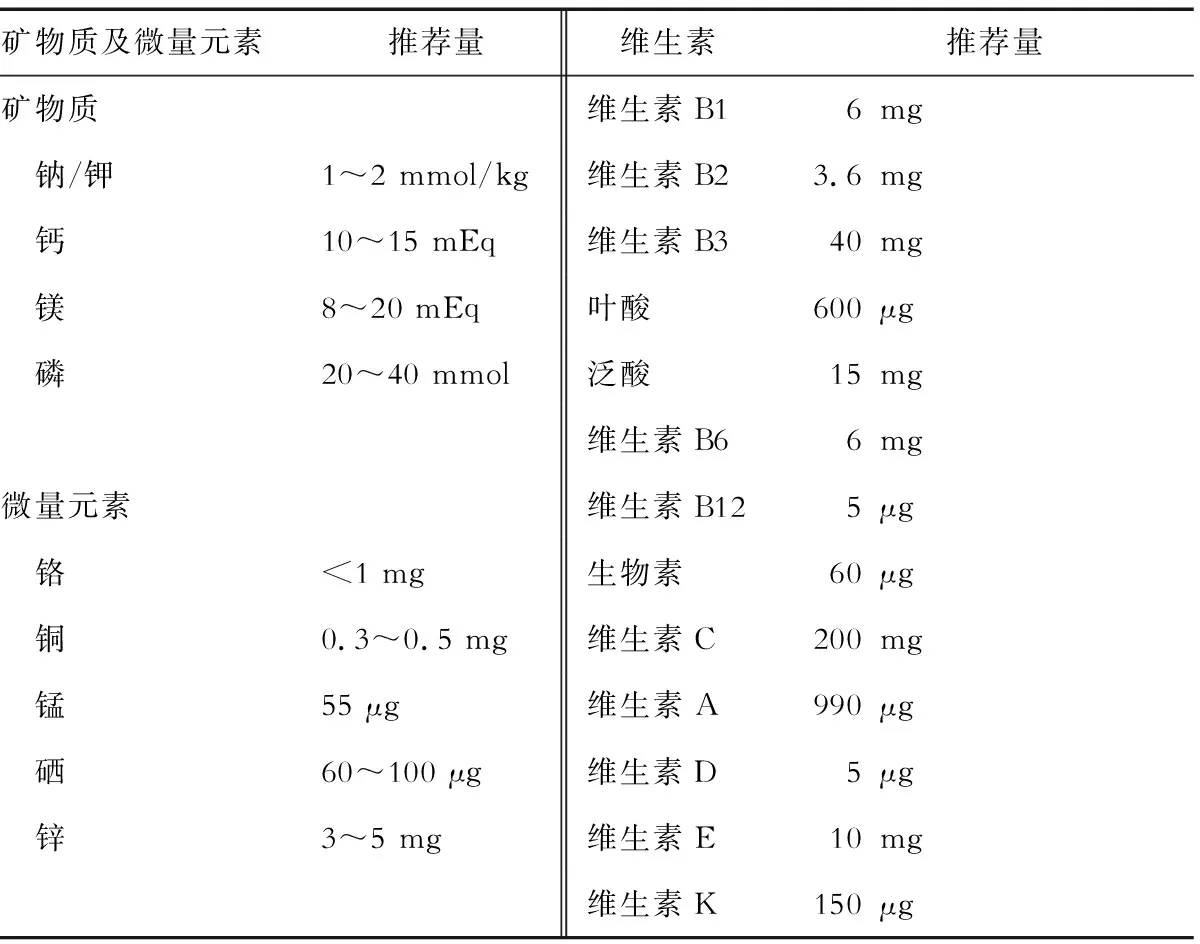
表3 全肠外营养的微量营养素每日推荐量
mEq为毫当量=毫摩尔乘以离子价数,如钙10 mEq换算成毫摩尔=10 mEq/2=5 mmol,换算成质量=5mmol×40=200 mg
维生素C:近年来多个研究显示大剂量维生素C(3~10 g/d)静脉注射可以显著降低重症患者死亡率、缩短升压药使用及机械通气时间,对病毒感染导致的急性呼吸窘迫综合征(ARDS)也有疗效[15],故推荐对危重症患者在常规补充维生素C推荐摄入量外,静脉使用大剂量维生素C可能有获益[8]。
维生素D:维生素D缺乏在危重症患者中很常见,且与不良临床结局相关,包括更高的死亡率和感染率、更长的住院时间和机械通气时间。因此如果新冠危重症患者血25(OH)维生素D3水平低于12.5 ng/mL或50 nmol/L,应补充维生素D3,并且可以在进入重症监护室1周后,一次性给予大剂量的维生素D3(500 000 UI)[6]。
磷:危重症患者常常出现低磷血症,如血磷≤0.5 mmol/L,需警惕是否存在再喂养综合征[16]。因此,建议密切监测血清磷酸盐浓度,必要时适当给予磷酸盐补充[5]。
临床诊治中,新冠危重症患者在不同阶段,机体代谢改变不尽相同,能量及营养底物需求亦处于动态变化中。因此.机体对营养物质需求量应根据不同疾病状况、不同阶段及重要器官功能情况而定[17]。
2.2 新冠危重症患者的营养治疗方案及途径选择
2.2.1 原 则 以营养不良五阶梯治疗[18]原则实施营养治疗。其中营养干预的每一级阶梯分别为:(1)饮食+营养教育,(2)饮食+口服营养补充(oral nutritional supplement, ONS),(3)全肠内营养(total enteral nutrition, TEN),(4)部分肠内营养(partial enteral nutrition, PEN)+部分肠外营养(partial parenteral nutrition, PPN),(5)全肠外营养(total parenteral nutrition, TPN)。当下一阶梯中的营养支持方式不能满足60%目标能量需求3~5 d时,应选择上一阶梯的营养支持方式。对于某些危重患者,还应根据临床实际进行调整。
2.2.2 经口饮食 对于能够自主进食且无呕吐或误吸风险的新冠危重症患者,应尽早优先给予经口饮食,并以在3~7 d内满足70%营养需求量为目标[6]。鼓励患者进食,必要时可采取少量多餐。如果经口饮食不能达到患者的热量目标,应优先考虑ONS,其次再考虑EN[6]。根据患者具体情况,可给予一般或疾病专用型ONS(如糖尿病、肾病制剂等)。每日通过ONS给予能量400~600 kcal,以达到ONS的最佳作用。对存在吞咽困难的患者,可以首先尝试通过改变食物性状等方法降低误吸风险,如吞咽困难加重,应给予EN[6]。
2.2.3 肠内营养(EN)
EN的禁忌证:包括未控制的休克、未控制的低氧血症和酸中毒、上消化道出血、肠缺血、肠梗阻、腹腔间室综合征和无远端喂养通路的高输出瘘[6,19]。另外,在血流动力学不稳定或胃潴留量大于500 mL/6 h情况下,应暂停EN[5]。
EN的适应证:肠内营养可维持肠道屏障和功能的完整性[19],预防机械通气患者胃肠道并发症[13,19],促进肠道免疫功能[13,20]。因此,对于无法经口进食且无EN禁忌证的新冠危重症患者,应首选EN,在24~48 h内给予早期EN[5-6,19,21]。对接受体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)的患者同样建议使用早期EN[22]。
EN的滋养型喂养:滋养型喂养(通常定义为10~20 mL/h或10~20 kcal/h)可以防止肠黏膜萎缩并保持肠道完整性[13]。因此,推荐在新冠危重症患者因胃肠道不耐受或其他原因导致EN无法增加时,如情况允许,建议不要完全停止EN,而尽量维持滋养型EN喂养以保持肠黏膜完整。
EN的实施途径:胃通路(鼻胃管)应作为启动EN的标准途径。如出现胃喂养不耐受症状且在使用胃动力药物后仍无法改善时,应采用幽门后喂养(鼻十二指肠管、鼻空肠管)[6,16]。存在高误吸风险的情况,如机械通气尤其俯卧位通气、年龄>70岁、使用镇静剂、ECMO患者使用肌松剂,意识水平下降、咽反射弱、口腔护理差、护士与患者比率不足、神经系统缺陷、有胃食管反流病史等可直接考虑给予幽门后喂养[6,16]。
EN的输注方式:连续性输注与单次输注相比,可显著降低其引起腹泻的风险,因此在有条件的情况下,首选连续输注(输注泵)[6]。连续输注开始速度为20~30 mL/h,2 h后若无潴留,则以10 mL/h的速度递增,直至60~100 mL/h[44]。为减少误吸性肺炎的风险, 所有接受EN的气管插管患者应将床头抬高30°~45°,并考虑每天使用两次氯己定漱口水清洁口腔[16]。如采取俯卧位通气,在体位翻转前0.5 h~1 h应暂停使用肠内营养,并检测胃残留量,避免在翻转过程中因反流、呕吐等导致误吸、窒息等并发症的发生。
EN的制剂选择:(1)常规配方:适用于不伴有血糖升高和肾功能不全,且胃肠道功能正常的新冠危重症患者。但由于新冠危重症患者对蛋白质的需求要比对能量的需求高,常规肠内制剂可能无法满足对蛋白质的需求,必要时可添加蛋白质组件(乳清蛋白粉等)[5]。(2)糖尿病配方:适用于糖尿病或伴有血糖升高的患者。(3)肾病配方:适用于伴有肾功能不全的患者。(4)高能量密度配方(1.5~2 kcal/mL):适用于伴有容量超负荷或需控制入液量的患者[5]。(5)高膳食纤维配方:适用于不伴有肠缺血或严重胃肠道动力障碍的持续腹泻患者。也可在标准配方中添加可溶性膳食纤维(果寡糖、菊粉等),24 h内分次给予10~20 g[5]。(6)短肽型配方:适用于经鼻空肠管途径给予EN或因胃肠道吸收不良导致腹泻的患者[5]。(7)肺病型配方(高脂肪/低碳水化合物):运用机械通气的重症患者是否使用高脂肪/低碳水化合物配方目前尚存在争议。既往认为使用该配方可以减少CO2产生,降低呼吸熵。但有研究显示当不存在过度喂养,即能量摄入值大致等于能量消耗时,宏量营养素的组成比例并不会影响CO2的产生[5,23]。另外该配方中高含量的ω-6脂肪酸可能会驱动炎症过程[5]。因此不推荐对新冠危重症患者使用该配方[5]。(8)以免疫调节为特征的配方:如添加ω-3、γ-亚麻酸、谷氨酰胺等的配方,鉴于相互矛盾的研究数据[5-6,24],暂不推荐新冠危重症患者首选使用。
EN的胃肠道并发症:由于新冠病毒可直接攻击胃肠道、使用抗病毒药物、镇静类药物及机械通气等原因,新冠危重症患者常出现腹胀、呕吐、腹泻等胃肠道不耐受,严重者可导致EN无法继续。(1)腹胀、呕吐:首先使用促胃动力药物,如每日3~4次甲氧氯普胺10 mg或红霉素3~7 mg/kg,不建议给予多潘立酮,因其可能引起严重室性心动过速等症状。在使用促胃动力药物后仍无法改善,应采用幽门后喂养(鼻十二指肠管、鼻空肠管)[6,16]。(2)腹泻:减慢输注速度,用水将EN配方稀释以降低渗透压,或可尝试换成高膳食纤维配方或短肽型配方,检查营养液温度。不推荐因胃肠道不耐受而完全停止EN,应尽量维持滋养型EN喂养。
2.2.4 肠外营养(PN)
PN的禁忌证:在心血管功能紊乱或严重代谢紊乱尚未控制、循环/机体内环境不稳定时,暂缓实施PN,因为此时PN可能会增加循环系统负担,造成更严重代谢紊乱[4]。
PN的适应证:新冠危重症患者普遍存在水钠潴留、肺水肿等,入液量限制非常重要,但PN容易造成液体负荷,因此推荐首选EN,存在EN禁忌或EN无法达到目标量时,才使用PN。(1)全肠外营养(TPN):EN禁忌的患者,如果已经存在严重营养不良或高营养风险(NRS 2002≥5分或NUTRIC评分≥5分),应在进入ICU后尽快开展TPN;如果低营养风险(NRS 2002≤3 或NUTRIC评分≤5)[5],ESPEN推荐可在3~7 d内给予TPN[6],而ASPEN建议应在7 d后给予TPN[5]。(2)补充性肠外营养(SPN):有证据显示危重症患者给予早期SPN并不会改善预后,而且可能对患者有害,尤其是在过量喂养的情况下[11]。因此,对于存在高营养风险患者,当EN在48~72 h内无法达到目标量的60%时,推荐尽早实施SPN[11,44],而对于低营养风险患者,若EN在7~10 d不能达到目标需求量的60%,才推荐给予SPN[5,11]。
PN的实施路径:对于需要较长时间PN支持者(≥2周)或机体对营养物质需求量大为增加者,宜用中心静脉输注。对于预期较短(<2周)PN支持的患者或接受SPN(输注营养液的量较少)的患者,可通过外周静脉输注,同时需注意外周静脉的最大耐受渗透压为900 mOsm/L[13]。
PN的输注方式: (1)全合一制剂:推荐使用全合一制剂取代多瓶输注。对于无肠外营养配置中心的医院,优先推荐使用商品化多腔袋[10]。(2)葡萄糖输注:新冠危重症患者葡萄糖输注起始速度不超过每分钟5 mg/kg[6]。超过这个剂量,氧耗量增加,CO2生成增加,特别是对于此类患者易发生呼吸功能不全。(3)脂肪乳剂输注:当血三酰甘油水平>4~5 mmol/L,需禁用脂肪乳剂;当血三酰甘油水平为2~2.5 mmol/L,需慎用脂肪乳剂。脂肪乳剂输注速度过快(>3 mg·kg-1·min-1)会导致肺功能恶化,因此输注时间应≥8 h[4],尤其在使用的最初几天,输注速度应尽可能慢(如输注含LCT时应≤0.1 g·kg-1·h-1[4],输注含MCT≤40%的混合脂肪乳剂时应≤0.15 g·kg-1·h-1)。脂肪乳剂不能直接通过ECMO管路输注,而应通过单独的静脉通道输注。
PN的免疫制剂:(1)ω-3脂肪酸:详见2.1.3;(2)谷氨酰胺:新冠重症患者处于急性应激状态,机体分解代谢加剧,谷氨酰胺被大量消耗,因而在理论上补充谷氨酰胺可保护肠道黏膜屏障功能、防止黏膜萎缩以及因此引起的肠道细菌和毒素移位。早期研究多显示静脉谷氨酰胺可降低死亡率,然而其后荟萃分析显示给予静脉谷氨酰胺制剂的患者死亡率显著增加[5]。因此,新冠危重症患者应慎用谷氨酰胺。(3)精氨酸:精氨酸是半必需氨基酸,在感染、创伤等应激状况下精氨酸有利于机体蛋白质合成,减少尿素氮排泄,改善氮平衡[28]。但最近的荟萃分析提示,补充精氨酸显著升高老年人、肿瘤患者及基础CRP升高患者的CRP[29]。因此,不推荐新冠危重症患者使用精氨酸。
PN的停用:对于实施PN稳定的患者,当胃肠道可用时,尽量努力尝试过渡到EN。可从滋养型喂养开始,随着EN耐受性的提高,当EN可提供大于60%目标能量需求时,可逐渐减少PN剂量,并最终停用[5]。
3 新冠危重症患者的营养监测
在肠内或肠外营养干预过程中,应当动态监测营养治疗的效果和相关不良反应情况,包括以下方面。
(1)营养方案的完成情况:包括经口进食、肠内营养和肠外营养。
(2)生化指标:如血常规、肝功能、肾功能、电解质、血糖、血脂等。
(3)人体测量:如体质量等。
(4)胃肠道症状:如腹泻、腹胀、腹痛、呕吐等症状。
(5)其他:如胃残留量、腹内压、肠鸣音、出入液量(24 h出入液量、3~5 d动态出入液量平衡)等。
具体监测的项目和建议监测的频率可参考表4[5,30-31]。

表4 营养监测项目与建议监测频率
4 儿童新冠危重症患者营养治疗
儿童新型冠危重症患者(28 d~18岁)的营养治疗与成人基本类似,稍有不同之处在于:能量目标量的确定可选用Schofield公式,也可参考1~8岁儿童每天50 kcal/kg或 5~12岁儿童880 kcal/d作为急性期预估能量消耗参考目标值[32-33];蛋白质目标量为每天≥1.5 g/kg,对于婴幼儿蛋白质可能需要量更高以达到正氮平衡[32-33];危重患儿的EN制剂选择短肽型配方较为常见。

