绿茶提取物EGCG对老年痴呆鼠和肥胖鼠的改善作用研究
刘 杨,张万圣,顾仁济,刘 云
专题报道(一)
绿茶提取物EGCG对老年痴呆鼠和肥胖鼠的改善作用研究
刘 杨,张万圣,顾仁济,刘 云
(北京化工大学 生命科学与技术学院,北京 100029)
以老年痴呆症和肥胖症模型小鼠为实验对象,每天用50 mg/kg的绿茶提取物(-)表没食子儿茶素没食子酸酯(EGCG)喂食30 d,分别从实验鼠的外形、生化指标和组织切片等指标进行分析,探讨EGCG对老年痴呆症和肥胖的改善作用。结果表明,EGCG能改善老年痴呆症小鼠大脑认知水平,作用机制可能与脑组织胆碱乙酰转移酶(ChAT)和乙酰胆碱酯酶(AchE)酶活、丙二醛(MDA)含量和-淀粉样蛋白-42(A42)沉积有关。EGCG具有抑制肥胖功效,其作用机制可能与体内血清脂肪酶和淀粉酶活力有关,影响脂肪和能量代谢。同时,EGCG还具有一定的修复肥胖引起的肝损伤的作用。这一研究成果为绿茶功能食品的开发奠定了理论基础。
绿茶提取物;(-)表没食子儿茶素没食子酸酯;老年痴呆症鼠;肥胖鼠;胆碱乙酰转移酶;乙酰胆碱酯酶;-淀粉样蛋白-42;肝组织空泡化;脂肪浸润
绿茶中含丰富的儿茶素,约为干重的30%~ 42%。儿茶素有多种结构类似物,包括表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯((-)-epicatechin gallate,ECG)、表没食子酸酯儿茶素((-)-epigallocatechin,EGC)和没食子儿茶素没食子酸酯((-)-Gallocatechin gallate,GCG)等,其中,EGCG含量最高,约占茶多酚总量80%[1]。文献报道,EGCG具有多种生理活性[1],如清除自由基,防止活性氧生成等抗氧化活性[2]、抗菌和抗病毒活性等[3]。研究表明,EGCG是癌症[4]、糖尿病[5]、肥胖[6]以及老年痴呆症[1]等患者的潜在改善剂。
EGCG改善老年痴呆症的作用机制与淀粉样A蛋白成纤有关。譬如,刘杨等和Zhan等研究表明[1,7],EGCG能改变A蛋白的聚集路径,形成无规则、无毒性聚集体,降低毒性。有研究显示,EGCG影响A淀粉样蛋白聚集成纤不是通过改变A蛋白的聚集路径,而是通过影响成纤过程中的最初成核阶段[8]。热力学研究表明,EGCG与A42蛋白相互作用是氢键和疏水作用的非特异性结合[9]。多酚化学结构明显影响淀粉样A蛋白聚集效果,多酚化合物结构中的羟基数目和位置均对淀粉样蛋白聚集的抑制效果起到关键作用[10-11]。
EGCG作为糖尿病和肥胖患者的改善剂,其作用机理是抑制人体内α-淀粉酶和脂肪酶活性,从而影响葡萄糖和脂肪代谢。Wang等[12]从分子水平上,揭示了EGCG与胰脂肪酶相互作用关系,探讨EGCG对脂肪酶活力和抑制类型、酶蛋白结构、反应动力学和热力学等影响。Fei等[13]报道茶多酚不仅有效地抑制a-淀粉酶活力,而且还都能改变α-淀粉酶构象。Cheng等[14]认为茶多酚抑制淀粉酶活力与其结构上的羟基数量和位置有关,相比ECG而言,EGCG抑制a-淀粉酶活性要强。Forester等[15]通过动物喂养实验发现,EGCG降低实验鼠体内血糖浓度,原因是EGCG抑制了体内淀粉酶活力。
本文以SAMP8老年痴呆鼠和ob/ob肥胖小鼠为模型,通过喂食30 d后,观察实验鼠外形、生化特性和组织形态切片等指标变化,探讨EGCG对老年痴呆鼠和肥胖鼠的改善作用机制,为EGCG功能食品的开发奠定理论基础。
1 材料与方法
1.1 实验材料与动物分组
绿茶提取物EGCG,EGCG纯度≥98%:上海绿叶生物技术有限公司。
SAMP-8老年痴呆实验模型小鼠:数量10只,雄性,体重(27±2) g,年龄3个月,实验分两组,每组5只。SAMR-1小鼠为实验对照组:数量5只,雄性,体重(29±2) g,年龄3个月,健康。
ob/ob肥胖实验模型小鼠:数量10只,雄性,体重(27±2) g,年龄5个月,实验分两组,每组5只。C57BL/6小鼠为实验对照组:数量5只,雄性,体重(20±2) g,年龄5个月,健康。
实验小鼠购于北大实验动物中心,饲养条件:温度(23±2) ℃,湿度50%±10%,光照12 h昼夜交替,自由取食。
实验前,首先将模型小鼠进行7d的适应性饲养,然后将模型小鼠随机分为数量相等的两组,一组为阳性对照组(患病组),另一组为EGCG处理组(给药组)。同龄健康小鼠为阴性对照组(Control组)。喂食30 d期间,给药组小鼠每天给为50 mg/kg/d的EGCG,给药方式为灌胃给药,阳性和阴性对照组小鼠同样以灌胃给药方式,每天给以50 mg/kg/d的生理盐水。
1.2 体长、体重和Lee’s体重指数
实验肥胖小鼠的体长和体重分3个阶段测量,给药前为第1阶段测量并记录小鼠的体重和体长;给药期间,每3 d测量1次并记录小鼠体重为第2阶段;等喂食30 d结束后,第3阶段测量并记录小鼠体重和体长。根据给药前后小鼠体重和体长的变化,计算肥胖鼠Lee’s指数,计算公式如下:

1.3 组织样品的分离与称重
按照文献[16]方法和步骤,分离动物组织。简单来说,喂食30 d结束后,杀死老年痴呆小鼠,分离脑组织,先浸泡于0.9%盐水中,然后解剖大脑皮层和海马区,称重,评价EGCG给药前后,老年痴呆小鼠脑组织重量的变化。
喂食30 d结束后,杀死肥胖小鼠,分离小鼠腹腔内脂肪组织和肝组织,分别称湿重,计算脂肪组织相对重量,评价EGCG给药前后,肥胖小鼠脂肪组织重量的变化。
1.4 生化指标检测
1.4.1 乙酰胆碱酯酶(AchE)和乙酰胆碱转移酶(ChAT)活力测定
研究表明,反映老年痴呆患者的重要生化指标之一,就是脑组织中AchE和ChAT活力发生改变[17]。将预冷的裂解液分别加入到上述分离得到的大脑皮层(cerebral cortex)和海马区(Hippocampus)组织中,充分匀浆后,4 ℃高速离心10 min,转速为13 000 ×g,之后轻轻吸取上清液加入2 mL离心管中,置于4 ℃冰箱中备用。按照酶活检测试剂盒说明书操作步骤,采用分光光度法,测定AchE和ChAT活力,评价EGCG给药前后,对老年痴呆鼠脑组织生化指标改善的影响。
1.4.2 丙二醛(MDA)含量测定
体内脂质过氧化终产物丙二醛(Malondialdehyde,MDA)的蓄积,会诱发神经元凋亡,导致大脑认知功能障碍[18]。根据文献[1]方法,分析小鼠大脑皮层(cerebral cortex)和海马区(Hippocampus)匀浆中的MDA含量变化,评价EGCG喂食前后,对老年痴呆鼠改善作用的影响。
1.4.3 血脂指标测定
按照文献[1]所述步骤,根据试剂盒说明书操作方法,分别测定实验小鼠血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和游离脂肪酸(FFA)的含量,评价EGCG喂食前后,对肥胖鼠改善作用的影响。
1.4.4 淀粉酶和脂肪酶活力测定
根据酶活检测试剂盒说明书操作步骤,分析小鼠血浆样品中淀粉酶和脂肪酶活力,评价EGCG喂食前后,对肥胖鼠改善作用的影响。
1.5 组织形态学观察
1.5.1 蛋白组织免疫学分析
通过脑组织病理切片和蛋白免疫组化方法,分析A42蛋白在海马体和大脑皮层的沉积情况,初步探讨EGCG喂食前后,对老年痴呆鼠改善作用机制,具体分析方法和步骤详见文献[1][19]。
1.5.2 脂肪组织切片观察
依次将小鼠脂肪组织进行4%甲醛固定、石蜡包埋、4 μm厚切片和HE染色等处理后,采用光学显微镜,放大倍数(×100倍和×400倍)条件下观察脂肪组织形态变化[1]。
1.5.3 肝组织切片观察
类似1.5.2操作方法,采用HE染色和油红(Oil red O)染色,分析肝组织病理变化。
1.6 统计学分析
所有实验数据采用SPASS 22.0 进行方差分析和显著性检验(<0.05),用平均数±SD表示最终数据结果。
2 结果与讨论
2.1 EGCG对老年痴呆小鼠和肥胖小鼠体长、体重和Lee’s指数的影响
实验小鼠喂食EGCG前后,小鼠体重和体长的变化值,以及肥胖小鼠的Lee’s指数等测定结果列于表1。由表1可知,对于老年痴呆模型小鼠而言,阴性对照组、阳性对照组(AD组)和给药组(EGCG组)相比,经统计学分析,小鼠体重和体长没有呈现显著性变化,表明大脑认知功能障碍不会影响实验小鼠的正常食物摄入,不影响小鼠体重和体长的发育。这一现象与Liu等[20]报道结果相一致,Liu等认为,EGCG喂食老年痴呆鼠12周,小鼠的体重和食物摄入没有明显变化[20]。对于肥胖模型小鼠来讲,相比阴性对照组,阳性对照组和EGCG给药组小鼠体重变化,具有统计学上的显著性变化(<0.05),体重明显增加,但是EGCG给药组比阳性对照组小鼠的体重要轻,结果表明,EGCG可能有效地抑制肥胖小鼠的体重增加。
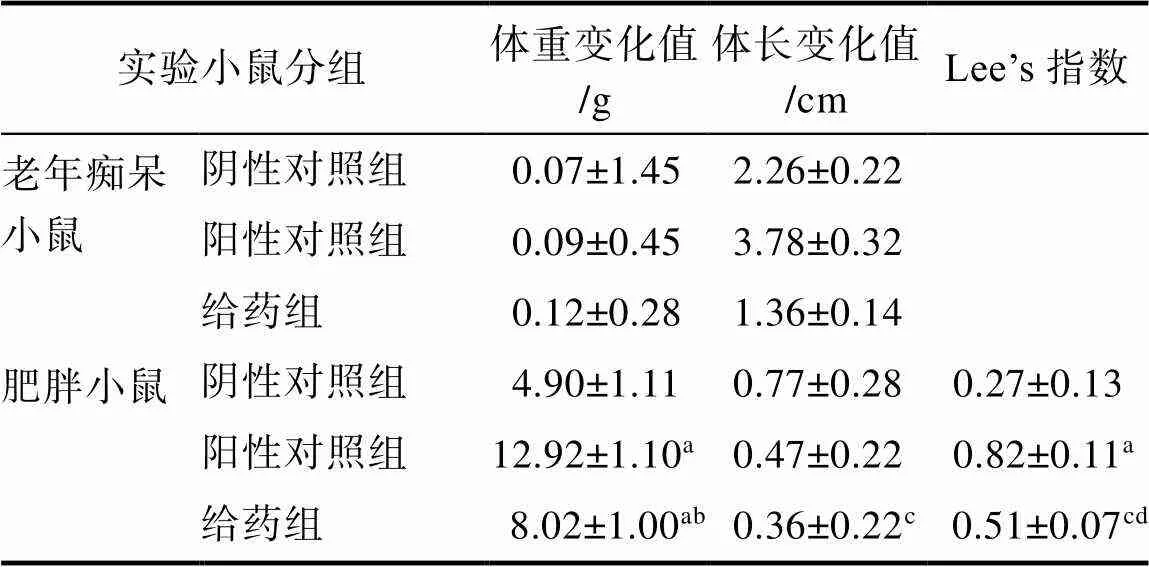
表1 EGCG对实验小鼠体重和体长变化以及Lee’s指数的影响
注:a:<0.001 vs Control; b:<0.05 vs Obese; c:<0.05 vs Control; d:<0.001 vs Obese
2.2 EGCG对老年痴呆小鼠脑组织生化指标和蛋白免疫学的影响
2.2.1 AChE和ChAT酶活分析
AchE和ChAT是调控乙酰胆碱神经递质的重要酶系,乙酰胆碱神经递质的下降,会导致大脑认知功能的降低,诱发老年痴呆病症[21]。通过分析实验小鼠的脑组织海马体和大脑皮层中AchE和ChAT酶活力变化,研究EGCG喂食对老年痴呆鼠的改善作用机制,实验结果见表2。
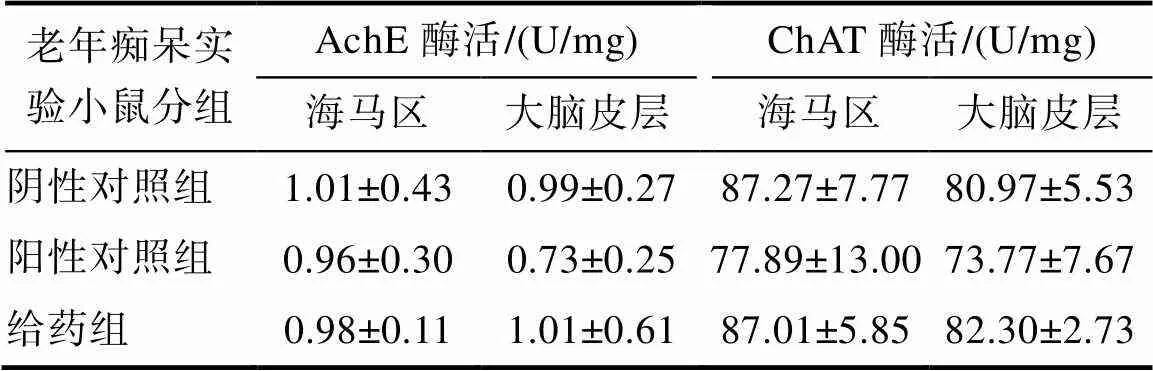
表2 EGCG对老年痴呆鼠脑组织AchE和ChAT酶活力的影响
由表2可知,相对于阴性对照组,AD组小鼠脑组织海马区和大脑皮层中的AchE和ChAT活力较低。EGCG给药30 d后,AchE和ChAT活力增加,接近甚至略高于阴性对照组,表明EGCG 对老年痴呆鼠的大脑认知功能有一定改善作用。这一结果在文献报道中也得到验证[22]。Wang等[22]报道,增强ChAT活力,提高乙酰胆碱神经递质水平,对大脑神经有良好的保护作用。
2.2.2 MDA含量分析
MDA是脂质过氧化最终产物,反映细胞氧化应激损伤程度的重要指标[1,7]。实验小鼠脑组织海马区(Hippocampus)和大脑皮层(cerebral cortex)中MDA含量变化结果见图1。
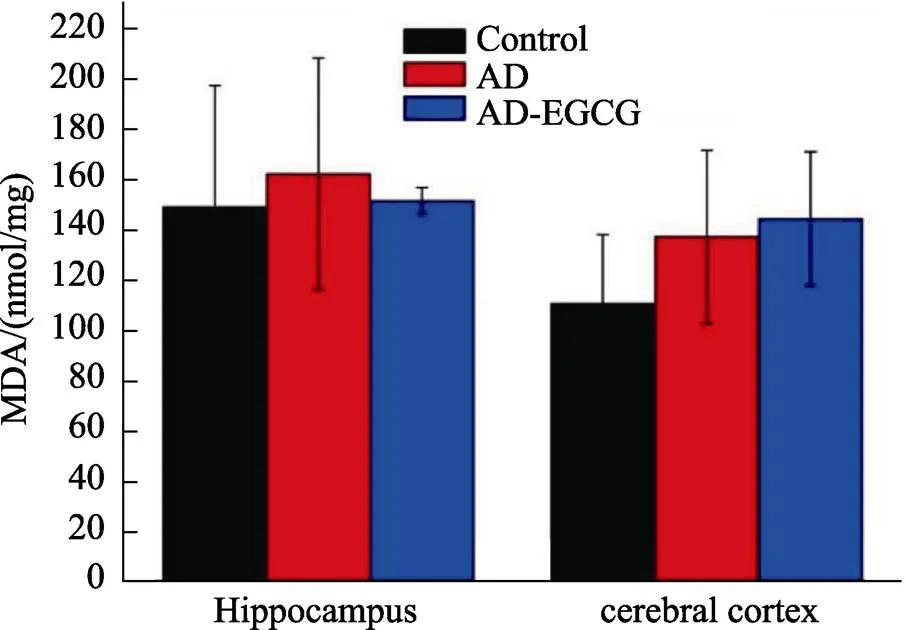
图1 老年痴呆小鼠脑组织中MDA含量变化的影响
由图1可知,相比于阴性对照组control小鼠脑组织海马区(145 nmol/mg)和大脑皮层(110 nmol/mg)而言,阳性对照组AD小鼠脑组海马区(161 nmol/mg)和大脑皮层(137 nmol/mg)MDA含量要高,表明老年痴呆鼠脑组织中MDA水平较高,这一结果与前人报道相一致[23]。EGCG给药30 d后,小鼠脑组织海马区MDA含量下降,基本与阴性对照组相接近,表明EGCG可以降低脂质过氧化应激对大脑的损伤,有利于老年痴呆鼠神经改善。Yin等[24]研究发现,EGCG可以降低铅诱导的老年痴呆鼠脑组织海马区MDA水平。有趣的是,实验发现EGCG给药组小鼠大脑皮层MDA含量((144.52±26.74) nmol/mg)上升,表明EGCG给药组小鼠大脑皮层仍存在一定的氧化应激损伤。这一现象与Wu等[25]实验结果相一致,文献作者同样发现,EGCG对脑缺血I/R模型大鼠脑组织海马区和大脑皮质中MDA水平影响,存在差异。
2.2.3 蛋白组织免疫学分析
实验小鼠脑组织海马体选择了3个区域,分别为CA31、CA3和DG区,大脑皮层选择1个区域为CER区,分析A42蛋白在脑组织中的沉积情况,进一步探讨EGCG喂食对老年痴呆鼠脑组织认知功能的改善作用机制,结果见图2。
如图2所示,图中蓝色表示细胞核,图中棕黄色表示A42蛋白沉积体。结果表明,虽然阴性对照组小鼠脑组织海马体和大脑皮层均有少量A42蛋白沉积体,但是,阳性对照组小鼠的海马体和大脑皮层中,A42蛋白沉积体明显增多。EGCG给药30 d后,小鼠海马体和大脑皮层中A42蛋白沉积体少于阳性对照组,基本接近阴性对照组,这一现象在小鼠海马CA3区尤为明显(图2D-F)。采用image-Pro 6.0测定了阳性对照组和给药组小鼠脑组织的平均光密度值(见图2左上角数字),定量说明A42蛋白沉积体数量。相比阳性对照组而言,EGCG给药组小鼠脑组 织中A42沉积体平均光密度值低,表明A42蛋白在小鼠脑组织中沉积受到了抑制。研究认为,A42蛋白沉积成纤,是诱发老年痴呆病症的主要原因[1,7]。Liu等[26]同样证实了上述结论,EGCG给药4周后,经统计学分析,APP/PS1小鼠海马区A42蛋白沉积物明显低于模型组(<0.05)。

图2 EGCG对老年痴呆鼠脑组织海马区和大脑皮层区Ab42蛋白沉积的影响
2.3 EGCG对肥胖小鼠脂肪组织生化特性的 影响
研究了肥胖小鼠喂食EGCG前后,小鼠各脏器脂肪组织的重重变化,结果见图3a。由图3a可知,与阴性对照组相比,阳性对照组小鼠腹腔内肠系膜(Mensenteric)、附睾(Epididymal)、腹膜(Retroperitoneal)的脂肪重量以及脂肪总重量均呈现显著升高趋势(<0.001)。EGCG给药30 d后,与阳性对照组相比,给药组小鼠各脏器脂肪组织明显下降(<0.05),表明EGCG对肥胖小鼠有一定的抑制作用。图3b表示实验小鼠的肝脏重量和肝指数变化情况,阳性对照组小鼠的肝重和肝指数都明显高于阴性对照组(<0.001),EGCG给药30 d后,小鼠的肝脏重量和肝指数有所下降,但是,没有呈现统计学上的显著性。实验小鼠血清中总胆固醇(TC)、甘三酯(TG)、高密度脂蛋白(HDL-C)和游离脂肪酸(FFA)等生化指标变化情况见图3c。由图可知,与阴性对照组相比,阳性对照组小鼠血清各项指标均高。EGCG给药30 d后,相比阳性对照组来讲,给药组小鼠血清大部分指标都有所降低,经统计学分析,TC降低效果显著(<0.05),但是血清中HDL-C指标比阴性对照组上升,提高了约1.36倍。一般来说,高密度脂蛋白可以将身体中胆固醇运输到身体各个器官,来提高身体免疫力,防止动脉粥状硬化。通过实验小鼠血清指标分析表明,EGCG可以改善肥胖小鼠血清指标,对肥胖有一定抑制效果,这一结论与Hong等[27]报道相一致。最后,采用酶活检测试剂盒,分析了实验小鼠血清中脂肪酶(lipase)和淀粉酶(amylase)活力,结果见图3d。由图可知,EGCG喂食30 d后,与阳性对照组相比,给药组小鼠血清中脂肪酶活力基本不变,而淀粉酶活力降低,表明在体内生理条件下EGCG是通过抑制淀粉酶活力,降低能量过度摄入,来发挥抑制肥胖功效的作用。这一结论与Rouse等[28]报道相一致,文献作者采用高脂和高碳水化合物饲料来喂饲模型小鼠,之后皮下注射艾塞那肽6周,检测小鼠血清中脂肪酶和淀粉酶活力,结果显示脂肪酶活力没有发生变化,而淀粉酶活力却下降了,证明了EGCG通过降低小鼠能量摄入来抑制肥胖。

图3 EGCG对肥胖小鼠脂肪组织生化特性的影响
(注:***表示为<0.001,**表示为<0.05)
2.4 EGCG对肥胖小鼠组织形态的影响
2.4.1 EGCG对小鼠脂肪组织形态的影响
EGCG喂食30 d前后小鼠脂肪细胞形态,结果见图4。按照文献[29]报道方法,计算脂肪组织细胞横截面积,结果见图5。
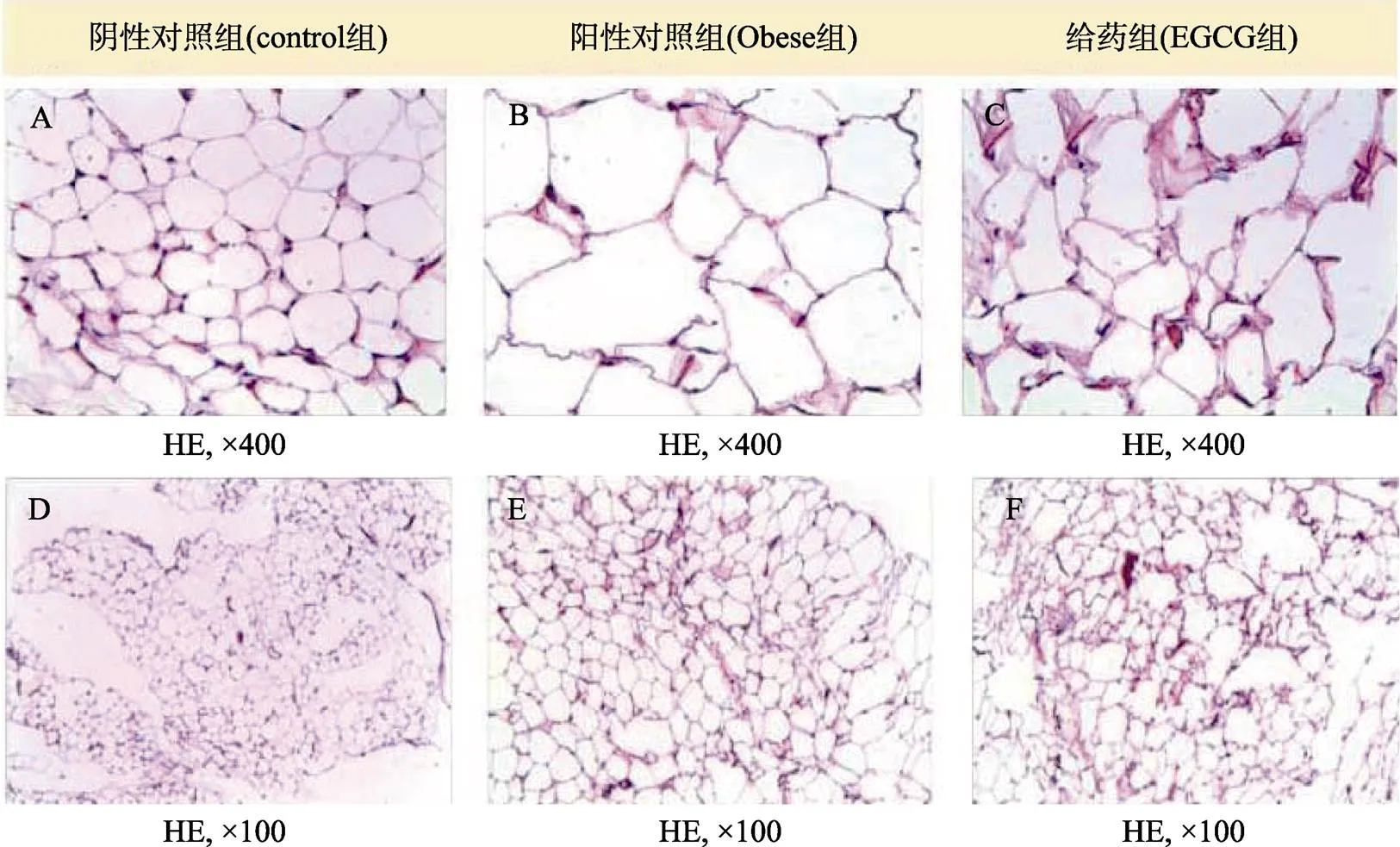
图4 小鼠脂肪组织形态观察
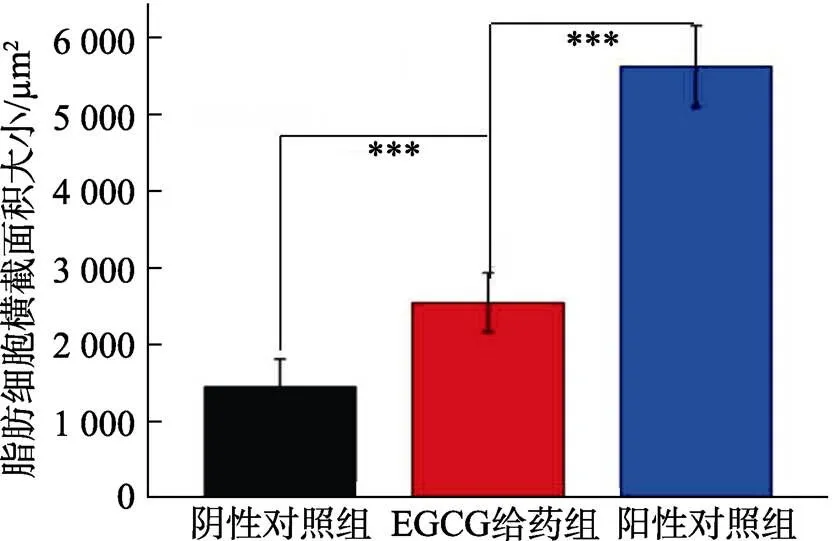
图5 EGCG对小鼠脂肪细胞横截面积的影响
(注:***表示为<0.001)
由图4可知,阴性对照组小鼠的脂肪细胞排列规整,细胞膜形态清晰,阳性对照组小鼠的脂肪细胞内腔体积增大,细胞排列松散,细胞膜变得模糊。EGCG喂食30 d后,给药组小鼠脂肪细胞的细胞膜虽然仍不十分清晰,但是,与阳性对照组相比,给药组小鼠脂肪细胞内腔体积变小,细胞排列相对紧凑。由脂肪组织横截面积大小可知(图5),与阳性对照组相比,EGCG喂食30 d后,EGCG给药组小鼠脂肪细胞横截面积显著降低(<0.001),表明EGCG具有一定的抑制小鼠肥胖的功效。类似地,Melo等[30]从小鼠脂肪细胞的横截面积的变化,认为天然三萜类桦木酸对小鼠减肥有一定作用。
2.4.2 EGCG对小鼠肝组织形态的影响
通过组织切片,观察实验小鼠肝组织形态的变化情况,研究EGCG肥胖引起肝组织损伤的修复功效,结果见图6。
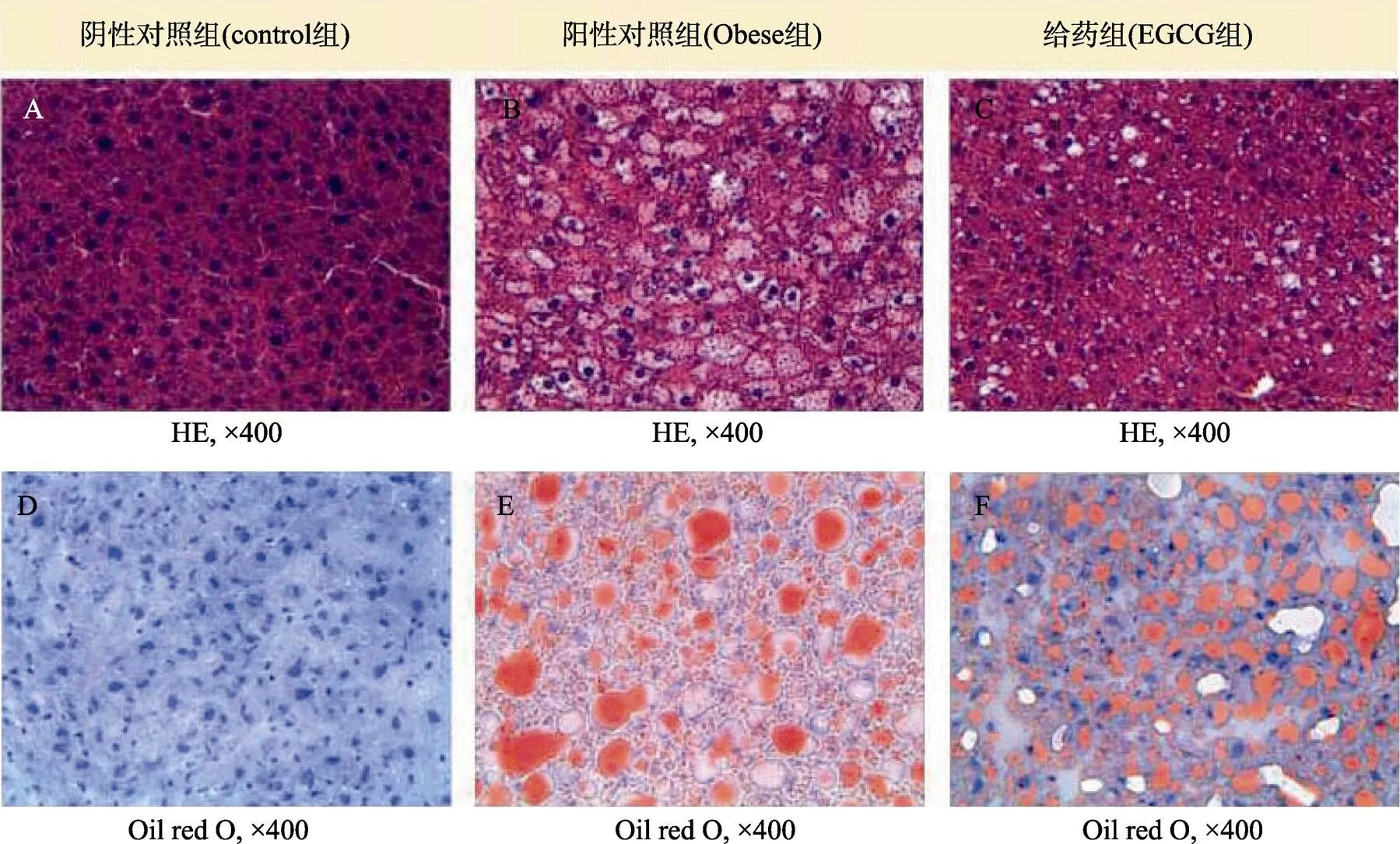
图6 EGCG修复肥胖引起的肝损伤
图6可知,阴性对照组小鼠肝细胞排列整齐,结构清晰,胞浆均匀,而阳性对照组肥胖小鼠肝细胞体积增大,胞浆浅染,细胞核周围呈明显空泡化。EGCG喂食30 d后,给药组小鼠肝组织细胞界限明显,空泡面积明显减少,病理症状减轻。进一步通过油红染色,观察小鼠肝组织脂肪浸润情况,结果发现,阴性对照组健康小鼠肝组织切片中未见脂滴,而阳性对照组肥胖小鼠肝组织脂肪浸润严重。EGCG喂食30 d后,给药组小鼠肝组织脂滴体积变小,脂肪浸润现象减轻。由此可见,EGCG对肥胖引起的肝脏损伤起到了一定的保护作用。这一结论与Fiorini等[31]报道结果 一致。
3 结论
以模型小鼠为研究对象,从动物组织个体水平,研究了绿茶提取物EGCG对老年痴呆症鼠和肥胖鼠的改善作用。
EGCG喂食前后,老年痴呆鼠的体长、体重与正常对照组没有显著变化,表明老年痴呆这一神经退行性疾病不影响患病小鼠正常饮食和能量摄入。EGCG喂食30 d后,老年痴呆鼠血清中AchE和ChAT活力升高,接近于阴性对照组,说明EGCG可以提高体内乙酰胆碱神经递质,有利于大脑认知能力的提升。大脑皮层中MDA含量降低,表明EGCG对老年痴呆鼠氧化应激损伤有改善作用。脑组织切片和免疫组化实验显示,EGCG能够抑制小鼠海马体和大脑皮层中A42沉积,抑制诱发老年痴呆症的发生。
EGCG喂食30 d,肥胖鼠体重、体长和Lee’s指数明显降低,肝重量和肝指数变化不明显,血脂指标降低,淀粉酶活力下降,表明EGCG有一定的抑制肥胖功效。组织切片显示,EGCG对肥胖引起的肝损伤具有一定的保护作用。
[1] 刘杨. EGCG结构类似物与Aβ蛋白和α-淀粉酶相互作用机理研究[D]. 北京化工大学硕士学位论文, 2016.
[2] SANG S, LAMBERT J D, HO C T, et al. The chemistry and biotransformation of tea constituents[J]. Pharmacological Research the Official Journal of the Italian Pharmacological Society, 2011, 64(2): 87-99.
[3] WEI L, FERNANDES A P, HOLMGREN A, et al. Bacterial thioredoxin and thioredoxin reductase as mediators for epigallocatechin 3-gallate-induced antimicrobial action[J]. Febs Journal, 2015, 283(3). 10. 1111/febs. 13587
[4] WANG X, HAO M. Apoptosis induction effects of EGCG in laryngeal squamous cell carcinoma cells through telomerase repression[J]. Archives of Pharmacal Research, 2009, 32(9): 1263-1269.
[5] CAI E P, JEN-KUN L. Epigallocatechin gallate (EGCG) and rutin suppress the glucotoxicity through activating IRS2 and AMPK signaling in rat pancreatic beta cells[J]. Journal of Agricultural & Food Chemistry, 2009, 57(20): 9817-9827.
[6] SHU W, NAIMA M M, LIXIA C, et al. Novel insights of dietary polyphenols and obesity[J]. Journal of Nutritional Biochemistry, 2014, 25(1): 1-18.
[7] ZHAN W, LIU Y, LI D, et al. Advancing insights on the anti-obesity biochemical mechanism of (-) epigallocatechin gallate (EGCG)by inhibiting a-amylase activity [J]. RSC Adv., 2016, 6, 96918-96927.
[8] EHRNHOEFER D E, BIESCHKE J, BOEDDRICH A, et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers[J]. Nature Structural & Molecular Biology, 2008, 15(6): 558-566.
[9] WANG S H, DONG X Y, SUN Y. Thermodynamic analysis of the molecular interactions between amyloid β-protein fragments and (-)-epigallocatechin-3-gallate[J]. Journal of Physical Chemistry B, 2012, 116(20): 11576-11583.
[10] CHURCHES Q I, CAINE J, CAVANAGH K, et al. Naturally occurring polyphenolic inhibitors of amyloid beta aggregation[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(14): 3108-3112.
[11] AKAISHI T, MORIMOTO T, SHIBAO M, et al. Structural requirements for the flavonoid fisetin in inhibiting fibril formation of amyloid β protein[J]. Neuroscience Letters, 2008, 444(3): 280-285.
[12] WANG S, SUN Z, DONG S, et al. Molecular interactions between (-)-epigallocatechin gallate analogs and pancreatic lipase [J]. Plos One, 2014, 9(11): e111143-e111143.
[13] FEI Q, GAO Y, ZHANG X, et al. Effects of oolong tea polyphenols, EGCG, and EGCG3 '' me on pancreatic alpha-amylase activity in vitro[J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9507-9514.
[14] CHENG Q, CAI S, NI D, et al. In vitro antioxidant and pancreatic α-amylase inhibitory activity of isolated fractions from water extract of Qingzhuan tea[J]. Journal of food science and technology, 2015, 52(2): 928-935.
[15] FORESTER S C, GU Y, LAMBERT J D. Inhibition of starch digestion by the green tea polyphenol, (−)-epigallocatechin-3- gallate[J]. Molecular Nutrition & Food Research, 2012, 56(11): 1647-1654.
[16] WANG Q, WANG C, SHU Z, et al. Valeriana amurensis improves Amyloid-beta 1-42 induced cognitive deficit by enhancing cerebral cholinergic function and protecting the brain neurons from apoptosis in mice [J]. Journal of Ethnopharmacology, 2013, 153(2): 318-325.
[17] NILSON N T, LUÍS EDUARDO S, BERNARDO S, et al. Inhibition of choline acetyltransferase as a mechanism for cholinergic dysfunction induced by amyloid-β peptide oligomers[J]. Journal of Biological Chemistry, 2012, 287(23): 19377-19385.
[18] HE X L, ZHOU W Q, BI M G, et al. Neuroprotective effects of icariin on memory impairment and neurochemical deficits in senescence-accelerated mouse prone 8 (SAMP8) mice[J]. Brain Research, 2010, 1334(3): 73-83.
[19] YANG N C, LIN H C, WU J H, et al. Ergothioneine protects against neuronal injury induced by β-amyloid in mice[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2012, 50(11): 3902-3911.
[20] LIU H W, CHAN Y C, WANG M F, et al. Dietary (−)-Epigallocatechin-3-gallate supplementation counteracts aging-associated skeletal muscle insulin resistance and fatty liver in senescence-accelerated mouse[J]. Journal of Agricultural & Food Chemistry, 2015. 63 (38): 8407-8417
[21] CUANG J Y, LEE C W, SHIH Y H, et al. Interactions between amyloid-β and hemoglobin: implicationsfor amyloid plaque formation in Alzheimer's disease[J]. Plos One, 2012, 7(3): 367-377.
[22] WANG Q, WANG C, SHU Z, et al. Valeriana amurensis improves Amyloid-beta 1-42 induced cognitive deficit by enhancing cerebral cholinergic function and protecting the brain neurons from apoptosis in mice[J]. Journal of Ethnopharmacology, 2014, 153(2): 318-325.
[23] YAN J J, CHO J Y, KIM H S, et al. Protection against beta-amyloid peptide toxicity in vivo with long-term administration of ferulic acid[J]. British Journal of Pharmacology, 2001, 133(1): 89-96.
[24] YIN S T, TANG M L, SU L, et al. Effects of Epigallocatechin- 3-gallate on lead-induced oxidative damage[J]. Toxicology, 2008, 249(1): 45-54.
[25] WU K J, HSIEH M T, WU C R, et al. Green tea extract ameliorates learning and memory deficits in ischemic rats via its active component polyphenol epigallocatechin-3-gallate by modulation of oxidative stress and neuroinflammation[J]. Evidence-based complementary and alternative medicine: eCAM, 2012, 2012: 163106-163106.
[26] LIU M, CHEN F, SHA L, et al. (−)-Epigallocatechin-3-Gallate ameliorates learning and memory deficits by adjusting the balance of TrkA/p75NTR signaling in APP/PS1 transgenic mice[J]. Molecular Neurobiology, 2014, 49(3): 1350-1363.
[27] HONG Y K, WU H T, MA T, et al. Effects of glycyrrhiza glabra polysaccharides on immune and antioxidant activities in high-fat mice[J]. International Journal of Biological Macromolecules, 2009, 45(1): 61-64.
[28] RODNEY R, LESHUAI Z, KATHERINE S, et al. Extended exenatide administration enhances lipid metabolism and exacerbates pancreatic injury in mice on a high fat, high carbohydrate diet[J]. Plos One, 2014, 9(10): e109477-e109477.
[29] 商悦, 李毅, 陈淑珍, 等. 茶多酚EGCG对小鼠棕色脂肪代谢醮影响[J]. 科技导报, 2014, 11: 21-25.
[30] DE MELO C L, QUEIROZ M G R , ARRUDA FILHO A C V , et al. Betulinic acid, a natural pentacyclic triterpenoid, prevents abdominal fat accumulation in mice fed a high-fat diet[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 8776-8781.

备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/ index.axpx)、中国知网、万方、维普、超星等数据库下载获取。
Effect of green tea extract EGCG on the improvement of Alzheimer’s and obesity mice
LIU Yang, ZHANG Wan-sheng, GU Ren-ji, LIU Yun
(College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China)
The present work reports the positive effect of green tea extract EGCG on the improvement of Alzheimer’s and obesity mice with the administration of 50 mg EGCG/kg mice every day for 30 days, and the mechanism is elucidated from three aspects of mice body, biochemical indexes and tissue immunology. The results showed that the EGCG can improve the cognitive function of Alzheimer’s mice, its function mechanism is probably attributed to enzyme activities of choline acetyltransferase (AchE) and acetylcholine esterase (ChAT), as well as the content of malondialdehyde (MDA) in serum and the accumulate of-amyloid protein 42 (A42) in the hippocampus. Furthermore, EGCG has a positive effect on the inhibition against obesity desease, it is related to the enzyme activities of lipase and amlyase in serum of obesity mice, which will affect triglycerol metabolism and energy intake. It is worthily noticed that EGCG can protect obesity-induced liver tissue damage. The findings in this work will provide future directions for development of green tea functional foods.
green tea extract; (-)-epigallocatechin gallate (EGCG); alzheimer’smice; obesity mice; choline acetyltransferase (ChAT); acetylcholine esterase (AchE);-amyloid protein 42 (A42); liver tissue vacuolation; adipose infiltration
TS201.1
A
1007-7561(2020)03-0001-09
10.16210/j.cnki.1007-7561.2020.03.001
2020-03-02
北京市自然科学基金(5142013);农业部农业技术试验示范与服务支持项目(农产品加工)(2267004600)
刘杨,1990年出生,女,硕士生,研究方向为功能食品的研究.
刘云(ORCID: 0000-0002-7521-3831),男,教授,博导,研究方向为功能食品和生物资源利用,E-mail: liuyun@mail.buct.edu.cn
2020-04-21 11:18:00
http://kns.cnki.net/kcms/detail/11.3863.ts.20200420.1721.001.html

