CHK1和RAD51蛋白表达与胰腺导管腺癌浸润和转移的关系
闫静波,李 辉,卫 茹,齐 蕾,王 博
胰腺癌的发生是多因素共同作用的复杂过程。90%以上的胰腺癌为导管腺癌,其来源于胰腺导管上皮细胞,是恶性度较高预后最差的恶性肿瘤之一。近年来胰腺癌的发病率呈上升趋势[1]。因此,现阶段胰腺导管腺癌的早期筛查诊断和新的标志物发现具有重要意义。细胞周期检验点激酶1(checkpoint kinase 1, CHK1)在肿瘤的发生发展、肿瘤耐药性等方面发挥重要作用,在许多肿瘤细胞中表达升高,是一种细胞检验点的转导因子[2]。DNA双链断裂修复蛋白(RAD51)能够促进肿瘤的生长及转移,是一种DNA双链断裂修复蛋白[3]。本文采用Western blot法及免疫组化EnVision法检测CHK1及RAD51蛋白在胰腺导管腺癌组织中的表达,分析两者在胰腺导管腺癌浸润和转移中的作用。
1 材料与方法
1.1 临床资料 收集2006~2017年河北医科大学附属邢台市人民医院病理科存档的103例胰腺导管腺癌标本。患者术前均未行放、化疗。103例中男性68例,女性35例;年龄<60岁者45例,≥60岁者58例;肿瘤最大直径<2 cm 35例,≥2 cm 68例;组织学分级:高分化41例,中+低分化62例;无淋巴结转移者50例,淋巴结转移者53例;肿瘤分期:Ⅰ+Ⅱ期63例,Ⅲ+Ⅳ期40例。另收集癌旁正常胰腺标本(取自胰腺癌标本距离肿瘤边缘3 cm以外的正常胰腺组织)103例。
胰腺导管腺癌标本和癌旁正常胰腺标本,均分两种方法保存:一种液氮冻存,行Western blot法检测;另一种经10%中性福尔马林固定保存,行常规HE及免疫组化染色。
1.2 方法
1.2.1 免疫组化 采用免疫组化EnVision法检测CHK1及RAD51蛋白表达,具体实验步骤严格按照试剂盒说明书进行。(1)根据阳性细胞数与总细胞数比值计分:阳性细胞数<10%为0分,10%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分。(2)根据细胞着色强度来计分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:≥2分为阳性,0~1分为阴性。
1.2.2 Western blot法 对癌旁正常胰腺标本和胰腺导管腺癌标本的蛋白进行提取,然后绘制蛋白标准曲线,参照蛋白标准曲线测定蛋白含量,进行SDS聚丙烯酰胺凝胶电泳,电泳后转膜,硝酸纤维素膜经TBS振荡漂洗2次,5%BSA常温振荡封闭。TBST振荡漂洗3次,在膜上滴加封闭液稀释的抗鼠单克隆一抗(CHK1及RAD51),4 ℃过夜。次日回收一抗,TBST振荡漂洗硝酸纤维素膜3次。在膜上滴加二抗,室温1 h,TBST振荡漂洗3次,TBS振荡漂洗。加入碱性磷酸酶显色剂显色,见有清晰条带出现即用双蒸水终止显色。将硝酸纤维素膜用扫描仪对蛋白表达条带进行灰度扫描,经自动图像分析系统进行半定量分析,癌旁正常胰腺标本组的平均光密度值(OD值)取值为1,胰腺导管腺癌标本与正常胰腺标本相比取值。
1.3 统计学分析 采用SPSS 19.0软件进行统计学分析,采用χ2检验CHK1及RAD51蛋白在胰腺导管腺癌和癌旁正常胰腺组织中的表达及与胰腺导管腺癌临床病理特征的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化法检测CHK1及RAD51蛋白表达 免疫组化结果显示:CHK1及RAD51蛋白在胰腺导管腺癌组织中的表达高于癌旁正常胰腺组织(P<0.05,表1,图1、2)。
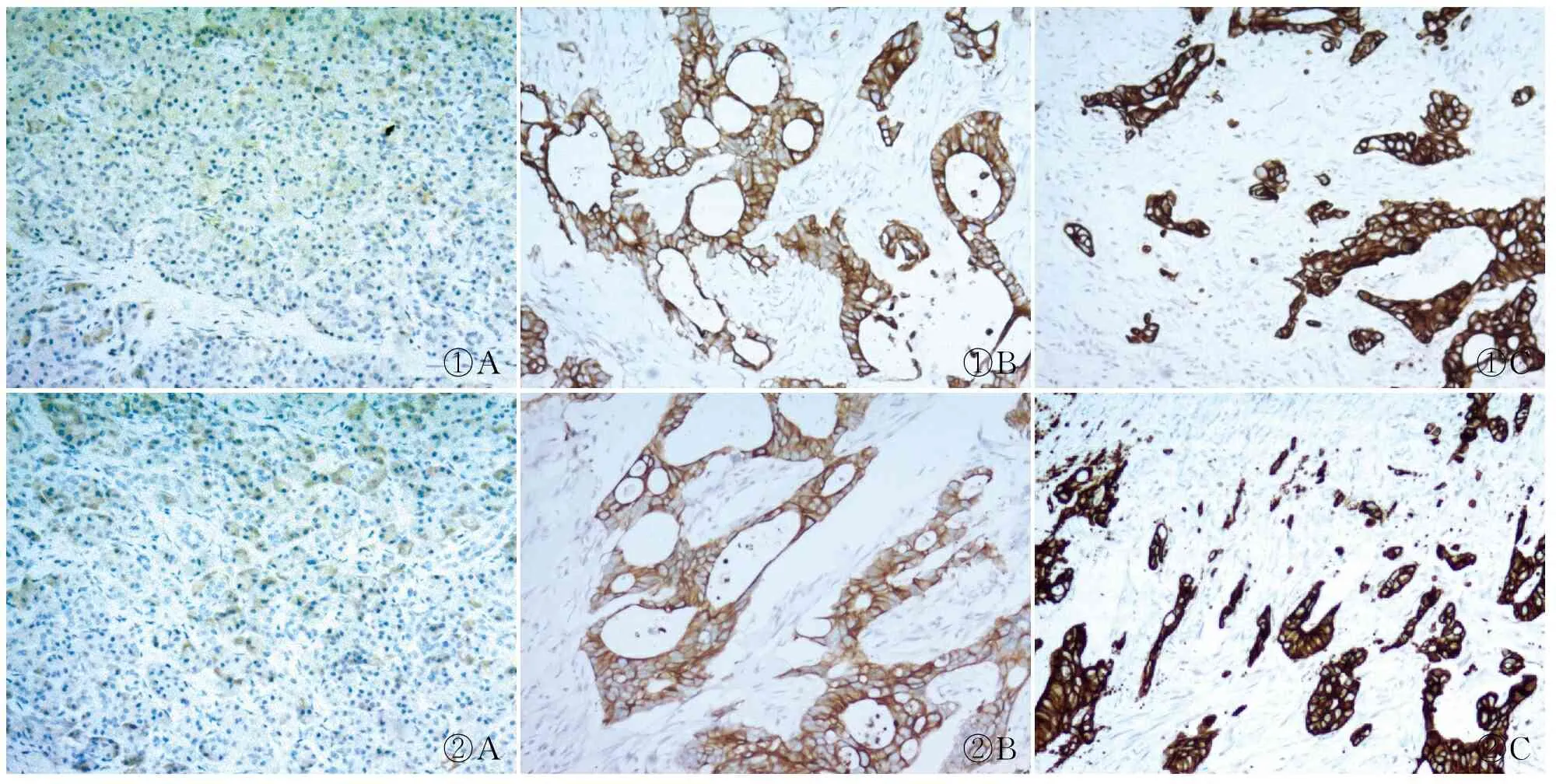
①A①B①C②A②B②C
图1 CHK1在癌旁正常胰腺(A)、高分化胰腺导管腺癌(B)和低分化胰腺导管腺癌(C)中的表达,EnVision法 图2 RAD51在癌旁正常胰腺(A)、高分化胰腺导管腺癌(B)和低分化胰腺导管腺癌中(C)的表达,EnVision法

表1 免疫组化法检测CHK1及RAD51蛋白在胰腺导管腺癌及癌旁正常胰腺组织中的表达[n(%)]
2.2 Western blot法检测CHK1及RAD51蛋白表达 Western blot法结果显示:CHK1及RAD51在胰腺导管腺癌组织中的表达高于癌旁正常胰腺组织(P<0.05,表2,图3)。

表2 Western blot法检测CHK1及RAD51蛋白在胰腺导管腺癌及癌旁正常胰腺组织中的表达
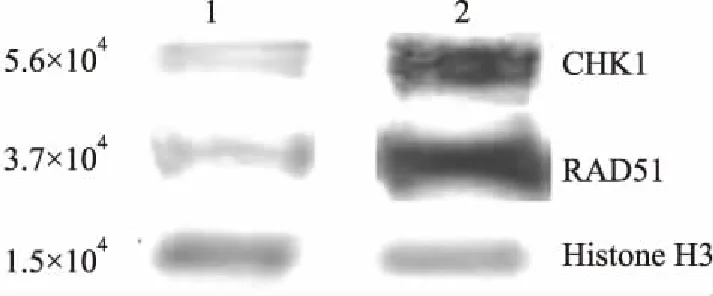
图3 Western blot法检测CHK1及RAD51蛋白在胰腺导管腺癌及癌旁正常胰腺组织中的表达:1.癌旁正常胰腺;2.胰腺导管腺癌
2.3 CHK1及RAD51蛋白表达与胰腺导管腺癌临床病理特征的关系 统计结果显示:CHK1及RAD51蛋白表达与胰腺导管腺癌病理分化程度、淋巴结转移及肿瘤分期相关(P<0.05)。CHK1及RAD51蛋白在中+低分化胰腺导管腺癌组中的表达高于高分化组;CHK1及RAD51蛋白在有淋巴结转移胰腺导管腺癌组中的表达高于无淋巴结转移组;CHK1及RAD51蛋白在Ⅲ+Ⅳ期胰腺导管腺癌组中的表达高于Ⅰ+Ⅱ期组(表3)。
2.4 CHK1和RAD51蛋白在胰腺导管腺癌中表达的相关性 经Spearman相关分析,胰腺导管腺癌组织中CHK1和RAD51蛋白表达呈正相关(r=0.514 3,P<0.05)。
3 讨论
胰腺导管腺癌是胰腺癌最常见的病理类型,发生于胰腺导管上皮细胞。胰腺癌发病隐匿,诊治困难,是恶性度较高预后最差的恶性肿瘤之一[4]。胰腺癌的病因复杂,胆道系统疾病或基因突变可能是胰腺癌发生的基础因素。有研究结果显示,分子生物或基因调控的变化是胰腺癌发生、发展的另一重要因素[5]。分子蛋白的改变,导致癌细胞的生物学改变,影响癌细胞的周期调控及基因修复,增强其基因不稳定性,从而增加肿瘤易感性,促进肿瘤的生成和转移[6]。本组实验分析RAD51和CHK1蛋白表达与胰腺导管腺癌的发生、发展的关系,能够为胰腺癌的早期筛查及预后评估提供新的标志物,探讨胰腺癌的发病机制,为胰腺癌的治疗寻找新的方法和途径。
CHK1是一种细胞检验点转导因子,可以对各种因素导致的DNA损伤进行修复,其异常表达会造成周期检测点不能修复机体DNA的损伤,引起肿瘤的发生、发展[7]。研究表明,CHK1与肿瘤的多药耐药性、肿瘤的侵袭转移密切相关,在肿瘤中表达升高[8-9]。RAD51蛋白是一种参与同源重组修复的DNA双链断裂修复蛋白[10]。然而,RAD51蛋白升高会增加姐妹染色体的交换及同源重组,从而增加遗传的差异和基因的不稳定,加速瘤细胞增殖,造成瘤细胞分化成熟障碍及肿瘤的发生、发展[3]。RAD51蛋白的一些氨基酸突变也会灭活该基因,引起肿瘤的发生[11]。

表3 CHK1及RAD51表达与胰腺导管腺癌临床病理特征的关系
CHK1和RAD51蛋白在胰腺导管腺癌组织中的表达高于癌旁正常胰腺组织(P<0.05)。CHK1及RAD51蛋白表达与胰腺导管腺癌病理分化程度、淋巴结转移及肿瘤分期相关(P<0.05)。CHK1及RAD51蛋白在中+低分化胰腺导管腺癌组中的表达高于高分化组;CHK1及RAD51蛋白在淋巴结转移胰腺导管腺癌组中的表达高于无淋巴结转移组;CHK1及RAD51蛋白在Ⅲ+Ⅳ期胰腺导管腺癌组中的表达高于Ⅰ+Ⅱ期组。随着胰腺导管腺癌的进展,CHK1和RAD51蛋白表达升高,且CHK1和RAD51蛋白表达呈正相关,提示CHK1和RAD51蛋白可能共同促进胰腺导管腺癌的发生、发展。随着肿瘤的进展,恶性程度的增高,CHK1和RAD51蛋白表达升高。在有淋巴结转移和临床分期高的胰腺导管腺癌中,CHK1和RAD51蛋白表达均增强,提示CHK1和RAD51蛋白可能促进胰腺导管腺癌的淋巴结转移,促使胰腺导管腺癌的生长加速,提高胰腺导管腺癌的临床分期,临床分期高和有淋巴结转移的胰腺导管腺癌患者预后较差。由此推测,CHK1和RAD51蛋白可能与胰腺导管腺癌的发生、发展有一定的关系,CHK1和RAD51蛋白可能是胰腺导管腺癌分级分期的重要标志,两者能够作为胰腺导管腺癌患者预后评价的参考指标,这与作者先前研究的CHK1和RAD51在食管、胃结合部癌的研究结果相同[12-13]。
有研究结果表明,CHK1和RAD51蛋白在肿瘤细胞内表达升高,瘤细胞基因组不稳定性增加,因此CHK1和RAD51蛋白升高的肿瘤患者,肿瘤细胞对化疗及放疗不敏感[11,14]。以CHK1和RAD51为靶点,基因治疗技术和蛋白质组学相结合,能够使瘤细胞对放、化疗的敏感性增强,是治疗肿瘤的新途径[11,14]。因此,CHK1和RAD51蛋白有可能成为治疗胰腺导管腺癌的新靶点。
CHK1及RAD51蛋白表达与胰腺导管腺癌病理分化程度、淋巴结转移及肿瘤分期相关。随着胰腺导管腺癌的进展,CHK1和RAD51蛋白表达升高。研究结果说明:CHK1和RAD51蛋白可能与胰腺导管腺癌的发生、发展有一定的关系。CHK1和RAD51蛋白对胰腺癌的发生、发展及预后有重要的临床意义,其可能成为临床上胰腺导管腺癌的早期筛查及预后的新标志物。如果深入探究CHK1和RAD51蛋白在胰腺导管腺癌中的表达,CHK1和RAD51蛋白有可能成为治疗胰腺导管腺癌的新靶点,给胰腺导管腺癌的治疗带来新途径。

