冷冻与石蜡肾活检标本中PLA2R1表达的临床诊断意义比较
刘琼茹,廖悦华,轩慧杰,郑明珠,李荣岗,郑 焱,周 伟,张 鑫,
肾病综合征是临床常见的慢性肾病,严重影响患者的健康及生活[1]。有研究显示,肾病活检中前5位的病变类型:IgA肾病(IgA nephropathy, IgA-N)占28.1%、特发性/原发性膜性肾病(idiopathic/primary membranous nephropathy, IMN)占23.4%、微小病变肾病(minimal change disease, MCD)占17.1%、继发性膜性肾病(secondary membranous nephropathy, SMN)占10.8%和局灶性节段性肾小球硬化(focal/segmental glomerulosclerosis, FSGS)占5.5%[2]。临床诊断中部分SMN的原发病情隐匿,与IMN的临床表现较难鉴别,但两者治疗策略和预后不同[3],因此开发有效稳定的新鉴别诊断策略有重要的临床意义。现已明确,IMN患者足细胞表面表达磷脂酶A2受体1(phospholipase A2 receptor 1, PLA2R1)及体内的抗PLA2R1抗体的增多是导致IMN的重要发病机制之一[4],但PLA2R1在肾病活检组织中的表达报道较少,检测方法也尚未统一。因此,本文收集1 000例肾病活检石蜡组织和215例冷冻组织,采用免疫组化法及免疫荧光技术检测PLA2R1的表达,比较两种方法的优劣,并分析PLA2R1在全类型肾病活检组织中的表达。
1 材料与方法
1.1 标本 收集2013年1月~2019年2月江门市中心医院行肾脏活检的患者标本及临床资料,临床表现以肾病综合征为主,有明确肾脏病理诊断。根据文献报道[2]将本组1 000例肾病患者分为6大类:IMN、SMN、IgA-N、MCD、FSGS和其他。在1 000例肾活检标本中,其中2018年5月~2019年2月的215例患者同时有冷冻标本和石蜡标本;2013年1月~2018年4月的785例患者只有石蜡标本。
1.2 材料 磷酸盐缓冲液(PBS)、胃蛋白酶消化液、柠檬酸盐修复液(pH 6.0)、乙二胺四乙酸(EDTA)修复液(pH 8.0)、三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA)修复液(pH 9.5)及抗体稀释液,购自北京中杉金桥公司;抗PLA2R1的兔多克隆抗体,购自美国Sigma Aldrich公司;偶联荧光染料Alexa Fluor 488的羊抗兔二抗,购自美国Cell Signal Technology公司;含4′,6-二脒基-2-苯基吲哚(DAPI)的抗荧光猝灭封片液,购自上海碧云天公司;免疫组化DAB染色系统,购自美国Ventana公司;ULTRA全自动免疫组化染色仪,购自美国Bench Mark公司。
1.3 方法
1.3.1 冷冻标本的免疫荧光染色 冷冻的肾脏穿刺活检标本经4 μm厚切片,丙酮中-20 ℃固定10 min;含0.5% Tween-20的磷酸盐缓冲液含吐温(PBST)浸洗后PLA2R1抗体工作液(1 ∶800)4 ℃孵育过夜;PBST浸洗后二抗工作液(1 ∶1 000)避光37 ℃孵育30 min;PBST浸洗后DAPI抗荧光猝灭封片液封固,荧光显微镜观察,细胞核染料DAPI为蓝光通道,针对PLA2R1的免疫荧光显色染料Alexa Fluor 488为绿光通道。
判读标准[5]:肾小球发出荧光判为目标荧光,肾小管等间质组织着色为背景荧光:(1)高倍镜下肾小球与背景显示同等的弱亮度为(-);(2)高倍镜下肾小球比背景更为明亮,但未见细颗粒荧光物为(-/+);(3)高倍镜下肾小球有细颗粒荧光物,但背景依然有可识别的亮度为(+);(4)高倍镜下见肾小球有粗颗粒荧光物,而几乎不见背景信号为();(5)高倍镜下仅见耀眼的肾小球部信号,有弥漫性荧光物聚集为()。其中,将(-~-/+)定义为阴性,将(+~/)定义为阳性。
1.3.2 石蜡标本的免疫组化染色 石蜡包埋的肾脏穿刺活检标本2 μm厚切片,烤片、脱蜡、水化。滴加胃蛋白酶消化液,37 ℃孵育20 min,修复结束后洗净切片,置全自动免疫组化染色机中,按流程完成抗体的孵育及DAB的显色过程,关键参数:一抗(1 ∶800稀释)37 ℃孵育44 min、二抗37 ℃孵育32 min、DAB室温显色8 min。显色完成后,洗净、复染核、脱水、封固,镜下观察。在预实验中,选取100例石蜡组织标本(IMN选40例,其余病理类型各12例),进行4种修复条件及2种切片厚度(2 μm或4 μm)的比较。胃蛋白酶消化修复条件:滴加胃蛋白酶消化液,37 ℃孵育20 min;柠檬酸盐、EDTA及Tris-EDTA修复液的修复条件:高压锅水浴高压热处理10 min。
判读标准[5]:肾小球呈棕黄色或棕黑色为目标着色,且要求全片80%肾小球的阳性形态一致,肾小管等间质组织着色为背景着色,且仅允许背景呈淡黄色。在单个肾小球中:(1)未着色或淡黄色着色区域>90%为(-);(2)有棕黄色的细丝状或细颗粒状着色,但着色区域未超过50%为(-/+);(3)>50%的区域呈棕黄色的细丝状或细颗粒状着色,或有棕黑色粗颗粒样着色,但着色区域未超过30%为(+);(4)有棕黑色粗颗粒样着色,着色区域超过30%,但未呈弥散分布为();(5)肾小球区域弥散分布棕黑色粗颗粒样着色为();并将(-~-/+)定义为阴性,将(+~/)定义为阳性。
1.4 统计学分析 计数资料用频数表示,用Excel 2010及GraphPad Prism 5.0软件处理数据,各组间频数数据统计使用χ2检验或Fisher精确检验,检验水平α=0.05。其中,灵敏度为检测指标的真阳性例数占该病理分类总人数的百分率,即正确判断为非该病理分类的百分率;误诊率为检测指标的假阳性例数占非该病理分类总人数的百分率,即错误判断为该病理分类的百分率。
2 结果
2.1 肾病综合征患者的临床病理特征 分析冷冻标本的免疫荧光染色和石蜡标本的免疫组化染色的患者性别、年龄、病理分类及临床分期的关系,结果显示两组差异均无统计学意义(P>0.05,表1)。

表1 肾病综合征患者的临床病理特征[n(%)]
IMN.特发性/原发性膜性肾病;SMN.继发性膜性肾病;MCD.微小病变肾病;FSGS.局灶性节段性肾小球硬化;IgA-N.IgA肾病
2.2 免疫组化检测石蜡标本的PLA2R1表达条件优化 比较4种修复方法对PLA2R1的石蜡标本的免疫组化染色影响,镜下观察发现胃酶消化修复的染色效果最好:目标着色部位的颜色和颗粒粗细均匀,背景着色低。进一步比较2 μm切片和4 μm切片对PLA2R1石蜡标本的免疫组化染色,预实验结果显示,2 μm切片能降低PLA2R1在非IMN类病理组织的阳性率(16.7%),但对IMN阳性率的影响较小(77.5%),故后续实验选择2 μm切片加胃酶消化修复,用于本组1 000例石蜡标本的免疫组化染色。
2.3 两种染色方法中PLA2R1表达比较 PLA2R1在冷冻标本的免疫荧光染色实验中总阳性率为19.1%;在石蜡标本的免疫组化染色实验中为32.9%,两组在各项指标的分布差异均有统计学意义(P<0.05,表2)。
2.4 PLA2R1表达与肾病综合征临床病理特征的关系 冷冻标本的免疫荧光染色和石蜡标本的免疫组化染色中PLA2R1的阳性与病理分类相关,均在IMN中高表达,但两者表达差异有统计学意义(P<0.05,表3)。在IMN中,冷冻标本的免疫荧光染色阳性率为72.0%,石蜡标本的免疫组化染色为79.8%;但石蜡标本的免疫组化染色在非IMN的阳性率约为20%,高于冷冻标本的免疫荧光染色在非IMN类型的阳性率约为5%(表3,图1)。此外,冷冻标本的免疫荧光染色判断IMN患者的敏感度为72.0%,误诊率为3.0%;石蜡标本的免疫组化染色判断IMN患者的敏感度为79.8%,误诊率为19.4%。
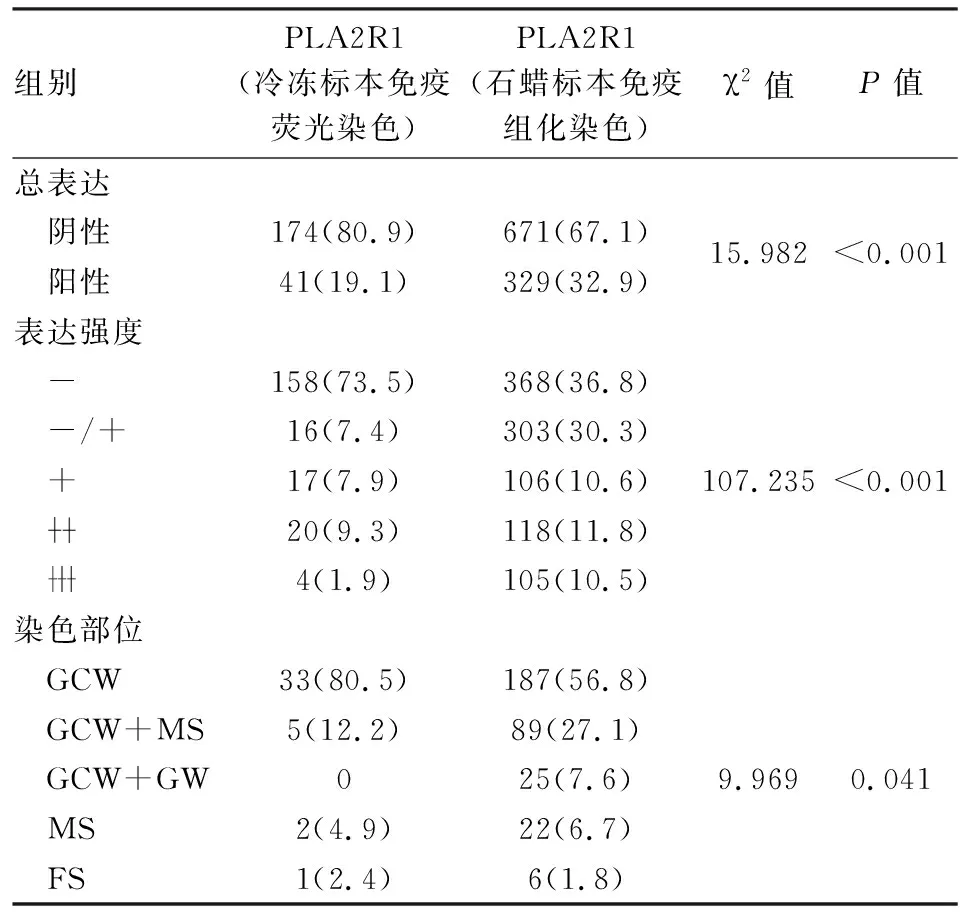
表2 两种染色方法中PLA2R1表达比较[n(%)]
GCW.肾小球毛细血管壁;MS.系膜区;GW.肾小球壁;FS.硬化灶

表3 两种方法检测PLA2R1表达与肾病综合征患者临床病理特征的关系[n(%)]
IMN.特发性/原发性膜性肾病;SMN.继发性膜性肾病;MCD.微小病变肾病;FSGS.局灶性节段性肾小球硬化;IgA-N.IgA肾病

ABCDEFG
图1 PLA2R1在不同病理类型中的染色:A.特发性/原发性膜性肾病冷冻标本的免疫荧光染色;B.特发性/原发性膜性肾病石蜡标本的免疫组化染色;C.继发性膜性肾病石蜡标本的免疫组化染色;D.微小病变肾病石蜡标本的免疫组化染色;E.局灶性节段性肾小球硬化石蜡标本的免疫组化染色;F.IgA肾病石蜡标本的免疫组化染色;G.其他肾病石蜡标本的免疫组化染色
3 讨论
本组经冷冻标本的免疫荧光染色法检测PLA2R1在IMN中的阳性率为72.0%,非IMN阳性率为3.0%;综合国内外文献报道,一般认为PLA2R1在IMN类患者肾活检组织中的阳性率为50%~100%,在非IMN类则小于10%[5-9],本组中冷冻标本的免疫荧光染色结果与之相似。文献报道冷冻标本的免疫荧光染色、石蜡标本的免疫组化染色和石蜡标本的免疫荧光染色三种方法,均可用于检测肾组织中PLA2R1表达,而切片厚度和修复条件影响其染色结果[5-9];经预实验的参数优化,本组在薄切片(2 μm)及胃酶修复石蜡标本的免疫组化染色条件下,PLA2R1在IMN中的阳性率为79.8%,在非IMN中的阳性率为19.4%,与文献报道接近。PLA2R1在IMN中石蜡标本的免疫组化染色敏感度稍高于冷冻标本的免疫荧光染色(72.0%和79.8%),但石蜡标本的免疫组化染色误诊率远高于冷冻标本的免疫荧光染色(19.4%和3.0%),表明修复过程可能增加PLA2R1的假阳性率,冷冻标本的诊断价值可能高于石蜡标本。
Pan等[10]报道在IMN中体外培养的人足细胞表达PLA2R1,且血清中IB组分泌磷脂酶A2(sPLA2 IB)通过激活PLA2R1增加足细胞中花生四烯酸含量,进而引起凋亡。有文献报道[11],人足细胞PLA2R1胞外段能与Annexin A2及S100A10结合,进一步组成巨大分子量的复合物,参与跨膜信号的传导,而抗PLA2R1抗体能破坏复合物的相互作用。利用人类蛋白质图谱数据库(http://www.proteinatlas.org/ENSG00000153246-PLA2R1/tissue)记录PLA2R1的免疫组化染色图像,能明确观察PLA2R1在6例正常人的肾小球组织中呈强阳性。
综上所述,本实验推测PLA2R1有可能在肾小球细胞中表达,并与Annexin A2等细胞膜蛋白形成巨型复合物,产生抗原决定簇的遮蔽作用。未经抗原修复的冷冻标本的免疫荧光染色中,大部分非IMN组织无法检测到PLA2R1,而部分IMN患者因存在抗PLA2R1抗体,破坏PLA2R1复合物结构,使PLA2R1抗原决定簇暴露而被检测到。然而,石蜡标本的免疫组化染色的抗原修复过程,能使巨型复合物中PLA2R1的抗原决定簇直接暴露,故大部分肾小球均能检测出PLA2R1的表达。
虽然冷冻标本的免疫荧光染色检测肾活检组织中PLA2R1的表达具有临床诊断意义,但手工免疫荧光染色的操作流程依然粗糙,结果判读也易被环境影响,所以本组致力于石蜡标本的免疫组化染色检测PLA2R1的可行性分析,希望后续研究结果能对肾脏临床病理技术的发展提供帮助。

