柴油水溶性成分胁迫下菲律宾蛤仔溶酶体生物标志物的应答
翁幼竹,薄 军,郑榕辉,张玉生,洪福坤,谢 晴,方 超,蒋雨露
(自然资源部第三海洋研究所,福建 厦门361005)
生物标志物是发生在分子、细胞、个体等不同生物水平上因受环境污染物影响而异常化的信号指标,表示生物体是否暴露于污染物中,或者暴露的生物效应。由于生物在分子、细胞和个体水平上的应答领先于生物群体、群落以及生态系统水平上的变化,因此生物标记物的改变被认为是环境质量评估中的早期预警工具。
溶酶体(Lysosome)是真核细胞内重要的细胞器,含有多种水解酶,用于分解细胞内的物质(自噬)或细胞外吸收的物质(异噬)[1]。在双壳类软体动物中,消化腺消化细胞中溶酶体含量尤其丰富,其大小比哺乳动物细胞中的溶酶体大得多[2]。
近年来研究表明,双壳类软体动物溶酶体能够富集很多环境污染物,包括重金属和有机化学物质(石油衍生碳氢化合物、工业污染物、杀虫剂等),使溶酶体膜通透性增加,破坏溶酶体质子泵的功能,酸性水解酶类进入到细胞质中,导致溶酶体肿胀,这在实验室研究[1-4]和现场研究[4-7]得以证明。溶酶体这种形态结构上的改变是与溶酶体膜稳定性降低和溶酶体酶活性增加有关,可作为细胞损伤的生物指标。国外学者以溶酶体形态和功能的完整性为突破口,建立了以地中海贻贝(Mytilusgalloprovincialis),无论原位的还是移植的,作为哨兵生物的一系列溶酶体生物标志物,在世界范围内用于监测环境污染对水生生态系统健康的毒性影响[8-9]。通过对海洋中软体动物、鱼类、甲壳动物和环节动物等多种门类进行实验研究,现已筛选出溶酶体中性红保留时间(Neutral Red Retention Time, NRRT)、溶酶体酸性磷酸酶(Acid Phosphatase, ACP)活性、溶酶体膜稳定性(Lysosomal Membrane Stability, LMS)作为海洋环境污染监测的生物标志物[10]。
中性红保留时间测定是检测环境污染物引起细胞溶酶体膜通透性变化的技术,依据健康的溶酶体比受干扰的溶酶体保留中性红染料的时间更长这一事实;而溶酶体损伤可导致染料泄漏到胞浆中,因此中性红在活血细胞溶酶体中的保留时间长短提供了一个可靠的机体健康指标。由于双壳类软体动物能够生物富集和浓缩其环境中的异源物质,因而采用双壳类NRRT测定已经作为监测污染影响的一般准则。同时NRRT测定操作简单、成本较低,是一种简化污染物暴露周期的敏感指标,非常适用于现场的环境监测评估[11-14]和实验室中污染物的毒性作用及其环境风险评估研究[15-16]。
酸性磷酸酶是溶酶体内最常见的一种标志酶。ACP组织化学检测已用于评价鱼类肝细胞[17-18]和贻贝消化细胞[19-20]溶酶体膜功能完整性。同样,ACP的释放通常被认为是环境和生物体中污染物存在的生物指标,且该方法简单、反应敏感和低成本,通过生化测定鱼肝[17-18,21]、贝类消化腺[22]的ACP活性成为污染监测的重要工具。
溶酶体膜稳定性测定,是基于溶酶体标记酶之一,N-乙酰-β-氨基己糖苷酶(N-acetyl-β-hexosaminidase,Hex)的组织化学证明来衡量,通过检测溶酶体对反应底物的渗透性来确定溶酶体膜的不稳定性程度,用去稳定性时间(Labilization Period,LP)长短来评估溶酶体膜稳定性,LP越短则表明溶酶体膜越不稳定,损伤越严重[23-24]。LMS测定已列入国家海洋生态系统监测规划中[8-9],被广泛地应用于海区水质监测和评估研究[12,19-20,25-29]和实验室污染物暴露的毒理学研究[7,19,22,27]。
国内开展利用溶酶体生物标志物评估水生环境污染的研究报道还极少。仅见个别采用NRRT测定,针对苯并(a)芘或重金属对贝类血细胞的毒性损伤开展室内暴露研究[30-31]。多数研究则报道了实验室条件下,多种水生动物(鱼、虾蟹、贝类)对重金属[32-33]或有毒化合物[34-36]暴露的ACP活性应答反应。
菲律宾蛤仔(Ruditapesphilippinarum)是一种广泛分布于我国沿海滩涂区域的底栖经济双壳贝类,其成体移动性不大,活动范围有限,容易暴露于各种海洋污染物中并加以生物富集。在生态毒理学研究中作为生物指示种,大量地用于评价特定的重金属和有机物的毒性以及实地污染监测[37-39]。菲律宾蛤仔已被列为我国“贻贝监测计划”的监测生物之一[40]。然而,溶酶体生物标志物在菲律宾蛤仔中的应用和验证研究还很少,仅见利用菲律宾蛤仔NRRT在实验室中评估盐度变化对其健康状况和渗透调节的影响[41]以及测试咖啡因、布洛芬、卡马西平、诺比星4种常用药物在海水环境中的污染毒性[42],还用于对海域沉积物质量进行现场监测和评估[43-44]。
本研究以0号(0#)柴油水溶性成分(Water Soluble Fraction, WSF)为污染物,通过检测菲律宾蛤仔中NRRT、ACP、LMS3种溶酶体相关的生物标志物对油污染胁迫应答的剂量-效应关系和时间-效应关系,研究探讨溶酶体生物标志物在菲律宾蛤仔的应用,为筛选菲律宾蛤仔溶酶体生物标志物提供重要的参考依据,为海洋环境污染的生物监测提供更多的生物标志物技术手段。
1 材料与方法
1.1 实验动物
实验用菲律宾蛤仔购自厦门市翔安区苗场。将批量菲律宾蛤仔带回实验室,挑选出壳长接近,壳体完整,活力强的个体,在实验室先暂养7 d,以适应实验室环境。暂养期间及时挑出死亡个体,每2天定时全量更换海水1次,不间断充气。待暂养结束后,选取活力强的个体进行柴油暴露实验。
1.2 主要试剂和仪器
Naphthol AS-BI N-acetyl-β-D-glucosaminide (Sigma, N4006),Dimethyl Sulfoxide (Sigma, 41640),Polypep®Low Viscosity (Sigma, P5115),Fast Violet B Salt (Sigma, F1631)均购自美国Sigma公司。蛋白质定量测试盒、酸性磷酸酶(ACP)测定试剂盒均购自南京建成生物工程研究所。Neutral red和HEPES购自BBI生命科学有限公司。
仪器包括F6/F10超细匀浆机(德国Fluko公司)、Biofuge fresco台式高速冷冻离心机(德国Heraeus公司)、PB-10精密酸度计(德国Sartorius公司)、CM1850 UV冰冻切片机(德国Leika公司)、XS205DU型十万分之一天平(瑞士Mettler Toledo公司)、Direct-Q3纯水/超纯水一体机(美国Millipore公司)、Eclipse 90i全自动科研级显微镜(日本Nikon公司)、UV-7504紫外可见分光光度计(上海欣茂仪器有限公司)、DKZ-2电热恒温震荡水槽(上海精宏实验设备有限公司)、XHF-DY高速分散器(宁波新芝生物科技股份有限公司)。
1.3 剂量-效应实验
①柴油WSF制备:将0号柴油与天然过滤海水按体积比1∶9混合后,用电动磁力搅拌器不间断搅拌24 h,然后油水混合液倒入分液漏斗中,静置4 h后移出下层水相,即为0号柴油水溶性成分(WSF)母液,4 ℃避光保存备用。采用水质石油类测定的标准荧光光度法,测得柴油WSF母液中总石油烃的浓度为47.9 mg/L。②不同剂量暴露实验:实验在72 cm×38 cm×40 cm的加盖玻璃水族箱中进行。根据国家《海水水质标准》[45]中划分的四类水质中对石油类检出值的规定(第一、二类≤0.05,第三类≤0.30,第四类≤0.50,单位mg/L),设置本实验中暴露组的柴油WSF浓度,即第一次实验浓度范围为0.1~0.5 mg/L,第二次实验浓度范围为0.2~1.6 mg/L。同时以不加柴油WSF为对照组。各暴露组和对照组均设2个平行。每个水族箱加入天然过滤海水40 L(水温21.0±0.5 ℃,盐度26),随机放入40只菲律宾蛤仔,连续充气,不投饵。每2天全量换水1次,暴露组重新加入相同浓度的柴油WSF。暴露5 d后取样,每组随机取24只蛤仔,测量壳长(3.6~4.3 cm)和壳高(2.4~2.8 cm)后,解剖小心分离出鳃丝和内脏团组织,滤纸吸干多余水分,称重,然后放入塑料离心管中,立即投入液氮速冻。待所有样品收集完毕,转入-75 ℃超低温冰箱冷冻保存,用于ACP活性测定和LMS测定。另外,每组随机取6只蛤仔,抽取血淋巴立即进行NRRT测定。
1.4 时间-效应实验
① 柴油WSF制备:将0号柴油与人工海水按体积比1∶9混合后,用高速分散器以14 000 r/min高速运行2 min,然后油水混合液倒入分液漏斗中,静置15 h后移出下层水相,即为0号柴油水溶性成分(WSF)母液,母液置棕色瓶中于4 ℃避光保存备用。人工海水采用海水晶(中盐工程技术研究院有限公司产品)配制而得,盐度为23。采用水质石油类测定的标准荧光光度法,测得柴油WSF母液中总石油烃的浓度为30.6 mg/L。② 不同时间暴露实验:设置添加柴油WSF为0.8 mg/L的暴露组和不加柴油的对照组,每组设2个平行组。分别于暴露实验的第0、1、3、7、11天取样。实验容器、动物数量、海水量、取样数量及动物处理方式同“1.3”。
1.5 溶酶体生物标志物测定
1.5.1 NRRT测定 先用洁净的毛巾吸干菲律宾蛤仔壳上的海水,然后用坚固的解剖刀或开壳钳将菲律宾蛤仔紧闭的壳轻轻撬开后,用2 mL一次性无菌注射器(配针0.6深蓝色)从菲律宾蛤仔的后闭壳肌与内脏团之间插入围心腔,从中抽取0.3~0.5 mL血淋巴。抽取血淋巴后将针头拔弃,推出血淋巴入装有等量体积贝类生理盐水的塑料离心管中(冰水预冷),稀释混合均匀。滴加40 μL血淋巴-生理盐水混合液于预先涂有多聚赖氨酸的载玻片上,载玻片置潮湿孵育盒中,避光放置15 min,以使血细胞粘附在载玻片上。取出载玻片,倾斜载玻片去除多余的液体后,滴加40 μL中性红工作液于载玻片的血细胞薄层上,再避光放置15 min,以使血细胞溶酶体被染红。取出载玻片,在显微镜下观察,间隔15 min或30 min检查载玻片,记录从第一次镜检开始到出现50%血细胞溶酶体内中性红渗出到胞质中的时间即为NRRT。研究在180 min内完成。每次显微镜观察后,将载玻片立即放回孵育盒中。中性红NRRT值越小,表明血细胞的溶酶体受损越严重。
1.5.2 ACP活性测定 将鳃和内脏团解冻后准确称重,剪碎放入预冷的匀浆管中,按质量(g)∶体积(mL)=1∶9的比例,加入9倍体积预冷的生理盐水,在冰水浴中用超细匀浆机10 000~15 000 r/min匀浆30 s,然后用台式高速冷冻离心机以4 500 r/min (4 ℃)离心15 min,静置后取上清液即为鳃和内脏团的酶提取液。将该液用生理盐水适当稀释,按照试剂盒操作说明书进行蛋白含量和酸性磷酸酶活性的测定。
1.5.3 LMS测定 内脏团样品从超低温冰箱取出后,截留腹面含消化腺的组织,OCT包埋,做冰冻切片(10 mm)。切片先经HE染色,找到并确定消化腺的部位后,再做连续冰冻切片。每个样品的连续冰冻切片以0、 3、 5、 10、 15、 20、 30、 40、 50、60 min的间隔,依次放入0.1 mol/L 柠檬酸盐缓冲液(pH=4.5,含2.5%NaCl)中,于37 ℃恒温振荡孵育,进行酸去稳定处理。然后切片转到底物溶液(20 mg的Naphthol AS-BI N-acetyl-β-D-glucosaminide溶解于1 mL Dimethyl sulfoxide中,再用0.1 mol/L柠檬酸盐缓冲液 (pH=4.5,含2.5% NaCl和3.0 g的Polypep®Low Viscosity作为稳定剂)配制到50 mL)于37 ℃恒温振荡孵育20 min,以显示Hex酶活性。接着在3% NaCl溶液中于37 ℃恒温震荡轻洗5 min之后,转移到染色液(0.1 mol/L磷酸盐缓冲液(pH=7.4),含有1 mg/mL的Fast Violet B Salt)室温孵育10 min。切片在流动的自来水中轻轻漂洗5 min,在Baker’s甲醛钙溶液中固定10 min,蒸馏水漂洗,用Kaiser’s甘油明胶封片。在显微镜下观察,联机使用NIS-Elements D3.1显微图像处理软件,以确定Hex最大阳性反应的切片,其所对应的酸去稳定处理时间即为样品的LP值。用褐鲳鲉(Sebastiscusmarmoratus)的肝切片作为阳性对照片同步反应。
1.6 测定数据统计和分析
应用PASW Statistics 18软件进行统计分析。每组统计6只个体,数据结果用平均数±标准差(Mean±SD)表示;用T检验分析组间的统计学差异,以p<0.05表示差异显著,p<0.01表示差异非常显著。
2 结果与讨论
2.1 0号柴油胁迫下菲律宾蛤仔血细胞溶酶体NRRT的应答
2.1.1 中性红染色后血细胞的形态观察结果 光学显微镜下观察显示,滴加中性红染液后,菲律宾蛤仔血细胞溶酶体能很快地吸收、保持和积累中性红染料,细胞内出现大量红色颗粒点[图1(a)]。随着污染暴露时间的延长,血细胞溶酶体中性红保持力逐步降低,镜检显示溶酶体中的中性红染料逐渐渗出到胞液中,直到将整个细胞染成深红色[图1(b)]。
2.1.2 剂量-效应实验 不同浓度柴油WSF暴露的菲律宾蛤仔血细胞NRRT值见图2(a)所示,对照组的血细胞NRRT均值为132 min,随着柴油WSF浓度从0.1 mg/L增加到0.5 mg/L,3个浓度的暴露组血细胞NRRT值(96、 78、 68 min)分别比对照组减少27.3%、40.9%、48.5% (p<0.05或p<0.01)。图2(b)为第二次浓度实验的菲律宾蛤仔,对照组血细胞NRRT均值为104 min,除了0.2 mg/L暴露组(96 min)外,0.4、0.8、1.6 mg/L暴露组的NRRT值(72~80 min)比对照组明显减少23.1%~30.8%(p<0.05),但是这3个暴露组之间不存在显著差异。

图1 菲律宾蛤仔血细胞的中性红染色结果Fig.1 Neutral red-stained hemocytes of the clam Ruditapes philippinarum a.中性红保持在溶酶体中(粗箭头,×400),b.中性红渗出到整个胞质(细箭头,×400)。

图2 不同浓度柴油WSF胁迫5 d的菲律宾蛤仔血细胞中性红保留时间Fig.2 Dose response of NRRT in hemocyte lysosomes of the clams to diesel oil WSF for 5 days “*”、“**”表示暴露组与对照组之间差异显著(p<0.05)或非常显著(p<0.01)。
中性红保留时间(NRRT)是用于指示血细胞溶酶体膜稳定性的指标。采用原位笼养菲律宾蛤在冬季和夏季对污水排放海域的海洋沉积物质量进行NRRT测定,显示血淋巴细胞溶酶体膜稳定性与城市污水排放程度密切相关[43]。本研究中柴油WSF暴露5 d的各浓度组NRRT值均比对照组有明显低的NRRT值(p<0.05),说明菲律宾蛤仔血细胞NRRT指标能灵敏地检测到水体中低浓度污染的存在。
参照其他作者设定的菲律宾蛤仔健康标准[42-43]的规定:NRRT值≥80 min视为健康蛤,NRRT值在80~45 min时,有应激但有补偿,如果NRRT值≤45 min,为强应激状态。本研究中,柴油WSF暴露5 d后的各浓度组与对照组的NRRT值处于68~132 min之间,可见本研究设置的海水柴油WSF浓度为菲律宾蛤仔的机体耐受范围之内。本实验中第二次实验设计在柴油WSF浓度大于0.5 mg/L后的NRRT值与浓度递增没有发现剂量依赖关系,因此更加广泛的污染物浓度范围试验需要做进一步研究。
2.1.3 时间-效应实验 菲律宾蛤仔暴露在含有0.8 mg/L柴油WSF的人工海水中11 d,血淋巴NRRT测定的中性红保留时间随污染暴露时间的变化关系如图3所示。在整个11 d的暴露实验期间,暴露组的NRRT值始终低于对照组,且无论对照组还是暴露组的NRRT值都呈随时间延长而降低的趋势。对照组菲律宾蛤仔NRRT值在暴露期间为 132~90 min。实验初始菲律宾蛤仔NRRT值为132 min,在暴露第1、3天,暴露组NRRT值迅速下降比同期的对照组NRRT值分别低16.0%、25.0%,差异显著(p<0.05);在暴露第7天,对照组和暴露组NRRT值分别比实验初始0天降低了31.8%(p<0.05)和39.4%(p<0.01),但对照组与暴露组之间已不存在显著差异;之后到第11天,对照组和暴露组的NRRT值维持接近平稳的水平。

图3 柴油WSF胁迫下菲律宾蛤仔血细胞中性红保留 时间的变化Fig.3 Time response of NRRT in hemocyte lysosomes of the clams to diesel oil WSF “*”表示同一取样时间点上暴露组与对照组之间差异显著 (p<0.05),b和c 表示同一组蛤仔在不同取样时间点上与实 验初始的差异为显著(p<0.05)或非常显著(p<0.01)。
本研究柴油污染的时间-效应实验显示,在实验初期,暴露组的NRRT值就低于对照组,并在第1、3天与对照组差异显著,证实了溶酶体NRRT指标对环境条件的快速变化的敏感性,是生物监测研究中敏感的应激指标[3,6,25]。随着时间的延长,对照组在第7天的NRRT值也下降,可能是由于暂养和暴露实验期间一直不设投饵,因此对照组菲律宾蛤仔自身的机体生理机能发生变化,免疫力下降,表现为血细胞溶酶体膜稳定性NRRT值的减少。这一结果与在太平洋牡蛎(Crassostreagigas)的饥饿实验相符合[46]。事实上,饥饿是贝类集约化养殖系统中的经常遇到的一个压力源。
NRRT指标通常是作为综合性胁迫的评估指标应用在现场监测中,还需要考虑食物质量的季节性变动[47]、繁殖周期[43]以及海水盐度和温度[48]等因素的有争议性影响,用来评估水体和沉积物的污染状况。
2.2 0号柴油暴露对菲律宾蛤仔鳃和内脏团ACP活性的影响
2.2.1 剂量-效应实验 菲律宾蛤仔经不同浓度柴油WSF污染暴露5 d后,暴露组和对照组的鳃与内脏团ACP活性测定结果如图4所示。图中可见,两次浓度实验的暴露组菲律宾蛤仔的鳃ACP活性与对照组之间均没有显著差异。内脏团ACP活性高于鳃,除了0.5 mg/L暴露组比对照组ACP活性高较多之外(p>0.05),其余浓度暴露组与对照组ACP活性均无显著差异。
菲律宾蛤仔营底栖滤食性生活,移动范围小,长期接触水体和沉积物中的污染物,因而被众多研究者选择作为生态毒理学研究的污染指示种。菲律宾蛤仔对环境中的柴油有较强的富集能力,其内脏团是累积污染物的主要位点,鳃组织是大量过滤海水,不断地与水体中污染物接触的部位。许多研究采用生物化学指标来量化环境污染物对水生生物的有害效应,其中ACP活性就是评估生物体中化学物质毒性应激的常用指标之一。本研究选择了鳃和内脏团作为靶器官来测定ACP活性对柴油WSF污染的应答。
本研究中柴油WSF污染5 d的菲律宾蛤仔各暴露组(0.1~1.6 mg/L)与对照组的鳃和内脏团ACP活性均不存在显著差异,这可能与ACP的特性有关。溶酶体酶具有潜伏性,细胞能量或代谢需求的改变以及接触有毒物质都会导致溶酶体膜的渗透性发生变化[2]。本实验中柴油WSF暴露5 d的菲律宾蛤仔各浓度组的鳃和内脏团的ACP活性与对照组差异不显著,可能机体其他方面的胁迫影响(比如5 d未投饵)而产生的细胞能量需求刺激了ACP活性的释放,从而抵消了污染诱导的ACP活性变化。
2.2.2 时间-效应实验 菲律宾蛤仔鳃和内脏团ACP活性随着暴露的时间变化见图5所示。暴露组鳃的ACP活性呈现先逐步升高到第7天达最大值,之后迅速下降在第11天为最小值,从第3天到第11天均与对照组的差异非常显著(p<0.01);而对照组鳃的ACP活性在实验期间变化不显著,先随着时间缓慢减少,再恢复到原有水平。对于内脏团,暴露组的内脏团ACP活性与鳃的应答模式相似,都是逐步升高到第7天达到最大值,然后再下降,从第7天到第11天均与对照组差异显著(p<0.05),而对照组内脏团ACP活性呈不规则锯齿形波动模式。可见菲律宾蛤仔鳃和内脏团ACP活性能在污染达1周起能指示污染物的胁迫效应。

图4 不同浓度柴油WSF胁迫5 d对菲律宾蛤仔鳃和内脏团ACP活性的影响Fig.4 Dose response of ACP activities from gill and viscera of the clams to diesel oil WSF for 5 days 纵坐标的单位U/g中的g指的是蛋白的质量,下同。

图5 柴油WSF胁迫下菲律宾蛤仔鳃和内脏ACP活性 随时间的变化Fig.5 Time response of ACP activities from gill and viscera of the clams to diesel oil WSF “*”和“**”表示同一取样时间点上暴露组与对照组之间 差异显著(p<0.05)或非常显著(p<0.01)。
本研究中,暴露于柴油WSF达11 d期间的菲律宾蛤仔鳃与内脏团的ACP活性都是呈现先逐步升高到第7天左右达到最大值,然后再下降的趋势。ACP是一种水解溶酶体酶,在应激诱导的组织/细胞损伤过程中由溶酶体释放。它是一种诱导性酶,当受到毒性影响时,它的活性会上升,并且这种酶开始抵消毒性作用。随后,由于部分或全部接触了毒素,或由于细胞受损,酶的活性开始下降[49]。这种变化趋势在重金属镉暴露下几种贝类的鳃和消化腺ACP活性也有类似反应模式[33,49]。而三丁基锡对文蛤(Meretrixmeretrix)鳃的作用则是先抑制后诱导的不同反应模式[34]。
ACP活性变化模式不仅依赖于污染物自身的性质,而且与靶器官的形态生理作用有关。本研究发现菲律宾蛤仔的鳃ACP活性在暴露第3天就受到强烈诱导比对照组明显高而且呈持续状态到第7天,而暴露组内脏团的ACP活性的诱导不仅比鳃晚,且对照组内脏团ACP活性的变化呈波动状态,不如鳃ACP活性诱导的指示清晰。这是因为在滤食性贝类,分支的细鳃表面增大了与流水中有毒物质的接触,从而更容易激发鳃ACP的高度表达变化。而内脏团接触有毒物质的途径间接且耗时,形成比鳃延迟的中毒反应,加上贝类内脏团中复杂的器官组成可能使ACP活性受到影响而容易波动。
2.3 0号柴油胁迫下菲律宾蛤仔消化腺LMS测定
2.3.1 不同浓度柴油WSF暴露的菲律宾蛤仔消化腺LMS测定 菲律宾蛤仔个体小,其内部器官包括消化系统、循环系统、排泄系统、生殖系统和神经系统等统称为内脏团,凭肉眼无法解剖分离。消化腺位于内脏团的腹面近壳顶处,用HE染色法确定了消化腺的位置(图6)。从图中可见,暴露于柴油WSF 5 d 后,与对照组[图6(a)]相比较,0.8 mg/L组[图6(b)]的菲律宾蛤仔消化腺的腺管腔显著扩大,腺管上皮细胞膨胀且细胞界限变模糊,证明了柴油WSF暴露对菲律宾蛤仔消化腺细胞的损伤效应。
对柴油WSF暴露实验的菲律宾蛤仔暴露组与对照组消化腺冰冻切片进行了LMS测定,试图通过溶酶体标志酶N-乙酰-β-氨基己糖苷酶的酶组织化学反应,以样品连续切片中出现最大的酶染色反应强度的切片的酸去稳定时间LP值的大小,来反映样品消化腺溶酶体膜受损程度。然而LMS测定结果发现,褐鲳鲉对照片为阳性反应[图7(a)],而不同浓度柴油WSF暴露的实验组和对照组菲律宾蛤仔的消化腺切片则均为阴性反应[图7(b)],因而无法获得LP值。

图6 柴油WSF暴露5 d后菲律宾蛤仔消化腺的病理性改变Fig.6 Pathological changes of digestive glands of the clams exposed to diesel oil WSF for 5 days a. 对照组(×200),b. 0.8 mg/L组(×200); tl—腺管腔,et—腺管上皮。
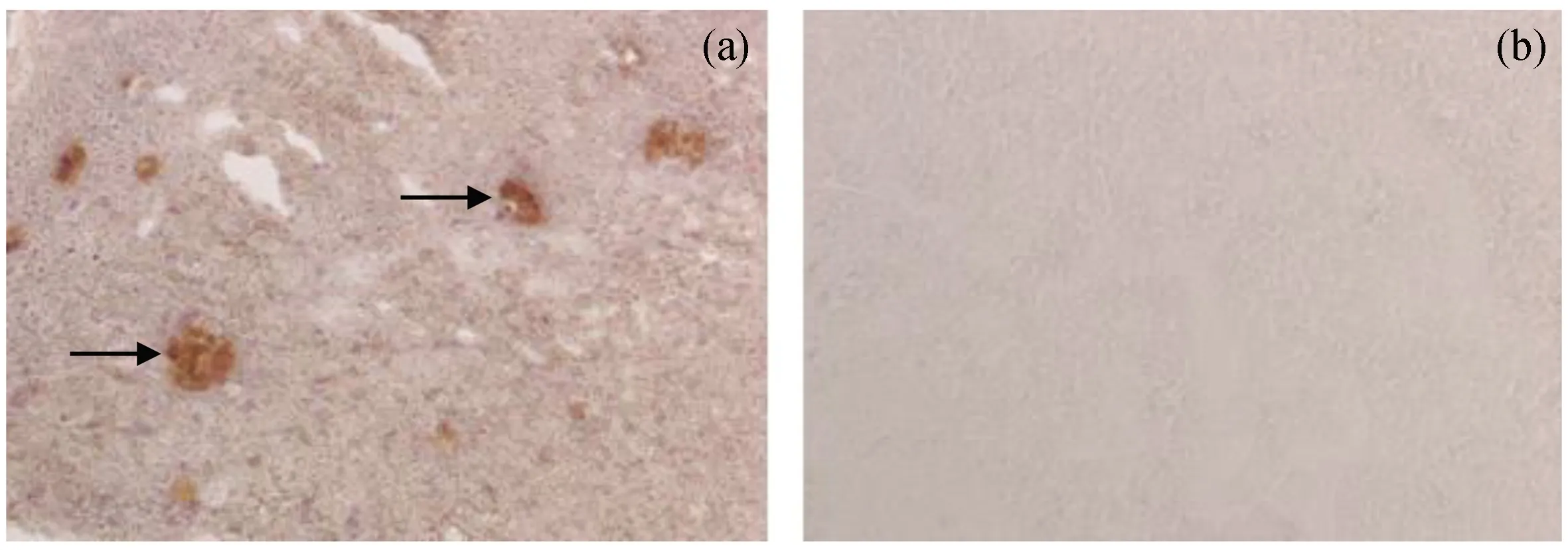
图7 LMS测定的Hex组织化学染色结果Fig.7 Hex histochemistry staining results of LMS test a. 褐鲳鲉肝脏切片对Hex显阳性反应(箭头,×100),b. 菲律宾蛤仔消化腺为免疫阴性反应(×100)。
2.3.2 柴油WSF暴露不同时长的菲律宾蛤内脏团消化腺LMS测定 与不同浓度柴油WSF暴露实验相似,时间-效应实验中的暴露组和对照组菲律宾蛤仔也对Hex呈酶组织化学阴性反应。
2.3.3 菲律宾蛤仔消化腺LMS测定及可适性 贝类消化腺是食物消化、吸收和污染解毒代谢的主要器官。关于污染物对菲律宾蛤仔消化腺的组织病理学研究极少。杀虫剂溴氰菊酯可导致菲律宾蛤仔消化盲囊上皮细胞膨胀,出现包涵体样结构,且杀虫剂的浓度与菲律宾蛤仔的组织细胞损伤程度呈正相关[50]。盐度15骤降胁迫6 d可使菲律宾蛤仔消化腺泡腔显著扩大[51],与本研究观察到柴油WSF为0.8 mg/L组就诱导菲律宾蛤仔消化腺组织出现病理变化相一致。
虽然有大量国外文献[7,12,19-20,22,25-26,29]报道在地中海贻贝以及更早期研究的紫贻贝(Mytilusedulis)[23-24,27]的消化腺,还有一些鱼类,如鳕(Gadusmorhua)的肝脏[52]、舌牙鲈(Dicentrarchuslabrax)[53]的肾脏,采用LMS测定程序通过在连续冰冻切片上显示溶酶体标志酶N-乙酰-β-氨基己糖苷酶(Hex)阳性反应物的基础上,用显微图像分析软件确定产生最大的酶阳性反应强度的切片,从而得出指示溶酶体膜稳定性的LP值。迄今还未见在其他双壳贝类上LMS测定的报道。
本实验中未能在柴油WSF暴露实验的菲律宾蛤仔对照组和暴露组的消化腺冰冻切片上显示Hex组织化学阳性反应,而用褐鲳鲉肝脏切片同步进行LMS测定均能显示Hex组织化学阳性反应。为避免生物的季节性生理条件差异的影响,我们还在其他季节从市场购买菲律宾蛤仔在室内进行Hex的组织化学检测,但依然为阴性反应。我们在之前完成的课题研究中曾发现,在同样的实验室原油污染暴露条件下,褐鲳鲉野生鱼与养殖鱼对LMS测定的反应截然不同,野生的褐鲳鲉肝脏能对Hex产生强的酶组织化学染色反应,而检测了数十尾养殖的褐鲳鲉肝脏则无一例发生染色反应,均为阴性。本研究所使用的菲律宾蛤仔均购自人工养殖场,是否菲律宾蛤仔也存在类似的野生群体与养殖群体对Hex的酶组织化学反应敏感性差异,或者该动物本身就不存在Hex酶组织化学反应,还有待于将来进一步研究和验证。
3 结论
溶酶体完整性已被广泛应用于监测自然环境中污染等胁迫的存在。本研究采用室内暴露实验体系,将菲律宾蛤仔暴露于添加0号柴油可溶性成分的海水中,通过检测菲律宾蛤仔血细胞NRRT指标,能够敏感指示污染胁迫的存在;检测菲律宾蛤仔鳃和内脏团的ACP活性也能显示对污染存在不同程度的应答。总之,菲律宾蛤仔这两类溶酶体生物指标均可作为潜在生物标志物在未来海洋污染生物效应监测中加以应用。

