菲律宾蛤仔垦区三联人工育苗技术
肖友翔,巫旗生,祁剑飞,郑雅友,曾志南*,林光忠,宁 岳,郭 香
(1.福建省水产研究所,福建 厦门 361013; 2.福清东龙湾花蛤小镇投资实业有限公司,福建 福清 350300)
菲律宾蛤仔(Ruditapesphilippinarum),属软体动物门,双壳纲,帘蛤目,帘蛤科,蛤仔属(Ruditapes),为我国四大海水养殖贝类之一[1],养殖方式简单、周期短、投资少、效益高。随着菲律宾蛤仔养殖面积不断扩大,其苗种需求量日益增加。福建是我国菲律宾蛤仔苗种主要的生产和供应基地,约占全国苗种产量的90%以上[2],其育苗方式包括垦区大水面人工育苗[3]、池塘人工育苗[4-6]和工厂化人工育苗[7-10],苗种除满足福建省外已远销山东、辽宁、浙江、广西、广东等地。
垦区人工育苗即在沿海适合菲律宾蛤仔养殖的滩涂上围垦出一口面积几百上千亩的垦区进行人工育苗,是池塘人工育苗面积的几十倍,水体环境因素更加不可控,育苗难度显著增加。早在上世纪70年代,福建沿海就开展了菲律宾蛤仔池塘人工育苗,至今已有40多年。本世纪初,随着垦区人工育苗技术的突破,菲律宾蛤仔苗种实现了规模化生产,但该种育苗方式存在饵料生物培养稳定性差、育苗成活率偏低、育苗产量不稳定等问题。自2014年开始,针对菲律宾蛤仔育苗生产上存在的问题,在福清东壁岛围垦区开展菲律宾蛤仔垦区三联人工育苗试验,优化了育苗技术,旨在为菲律宾蛤仔苗种产业的进一步发展提供技术参考。
1 材料与方法
1.1 材料
1.1.1 垦区设施 菲律宾蛤仔育苗在福清东壁岛围垦区进行,围垦区分为A、B、C三口(图1)。其中,A垦区面积为400 hm2,B垦区面积为200 hm2,用于苗种培育;C垦区面积为66.67 hm2,用于生物饵料培育。A、B垦区分别设有闸门21孔,C垦区设有闸门7孔,每孔闸门宽度为3 m左右,进出水便利。A和B垦区之间设有5孔闸门,A和C垦区之间设有4孔闸门,B和C垦区之间设有3孔闸门。
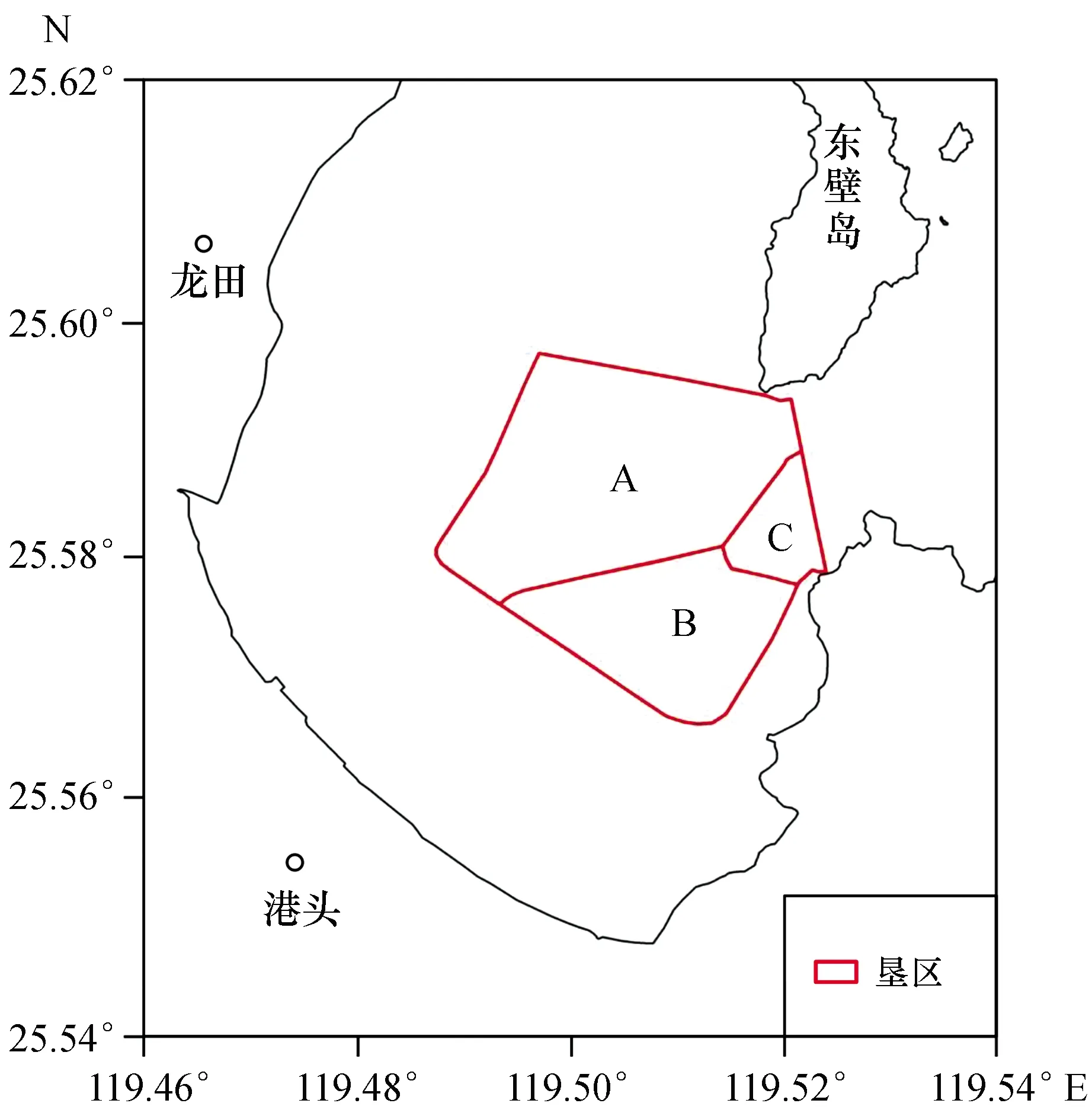
图1 菲律宾蛤仔育苗垦区分布Fig.1 Map of diked tidal flats for Malina clam breeding
1.1.2 亲贝来源 所用亲贝来自福建连江和广东饶平菲律宾蛤仔滩涂养殖区,挑选性腺饱满、规格均一、无损伤的个体作为亲贝,规格为(154.17±19.28)粒/kg。
1.2 方法
1.2.1 垦区清整 2017年5—6月对垦区进行清淤、曝晒,曝晒时间为20~30 d。采用推土机清除育苗池底的黑臭淤泥贝壳,并用松耕机进行松耕,促进底泥有机质分解。用水泵配合运沙船,以直径为0.8 m的PVC硬管向垦区内均匀填入海沙约5 cm,用于填补机械洗苗所抽走的海沙。抽沙后,浸池冲洗,平整池底。在垦区进水时水流能到达的区域规划亲贝区,结合GPS定位,分为多块长方形区域,总面积占育苗垦区面积的7%~9%,放置浮漂作为标记,以便投放亲贝。投放亲贝前15~20 d,每公顷用750 kg生石灰消毒,经孔径为1 cm的聚乙烯锥形网过滤进水,进水量以淹没池底为准,2 d后排干池水,再进水,反复冲洗3次。
1.2.2 生物饵料培育 投放亲贝前8~10 d,3个垦区均经孔径为1 cm的聚乙烯锥形网过滤进水70 cm(整个垦区的水位高度,下同),三个垦区分别以2.0、1.0 mg/dm3(施肥后垦区水体浓度,下同)的肥料浓度施用尿素和复合肥培养饵料生物。逢晴天,A、B垦区分别以1.0、0.5 mg/dm3的肥料浓度施用尿素和复合肥,C垦区则分别以2.0、1.0 mg/dm3的肥料浓度施用尿素和复合肥。育苗期间,打开C垦区闸门,将肥水流入A、B垦区。待A、B、C垦区水位相同时,关闭闸门,C垦区重新蓄水、施肥、培藻。
1.2.3 亲贝投放和催产 2017年9月上旬陆续从连江购入性腺成熟的菲律宾蛤仔共1 670 t,在垦区岸边干露4 h后均匀投放于亲贝区,亲贝投放量为平均2 775 kg/hm2。在投放亲贝后的下一个涨潮期,利用涨潮的水位差进水,保持亲贝区的水流速度为30~50 cm/s,以流水刺激催产。
1.2.4 洗卵、孵化 菲律宾蛤仔卵子是沉性卵,在卵子尚未孵化前,通过调节排水闸上层的闸板,排掉表层多余的精液和排泄物(10~15 cm),以保持良好的水质环境。
1.2.5 浮游幼虫培育 待A、B垦区菲律宾蛤仔受精卵发育至D型幼虫后,每天经孔径为1 cm的聚乙烯锥形网过滤进水10 cm左右,每2~3 d,A、B垦区分别以0.50~1.00、0.25~0.50 mg/dm3的肥料浓度施用尿素和复合肥培养饵料生物,施肥量根据每天水质状况而定,保持水体呈黄绿色或淡茶色,透明度为30~50 cm。如非特殊情况,在培育浮游幼虫期间只进水不排水,避免幼虫流失。通过A、B两垦区间闸门可利用水位差调节两垦区幼虫密度。C垦区每天经孔径为1 cm的聚乙烯锥形网过滤进水10~15 cm,保持水位高于A、B垦区,每1~2 d分别以2.0~3.0、0.5~1.0 mg/dm3的肥料浓度施用碳酸氢铵和碳酸二氢钾,施肥量视天气、水色而定。阴雨天以10 mg/dm3的浓度施用生石灰,保持pH相对稳定。水色变清时,排去部分老水,适当加大进水量和施肥量。视A、B垦区饵料生物情况,不定期向A、B垦区排入肥水,补充生物饵料。在水温为28~31 ℃、盐度为30~31的条件下,D形幼虫经7~9 d的培育,变态为初期稚贝。
1.2.6 稚贝培育 A、B垦区菲律宾蛤仔初期稚贝每天进排水为10~15 cm,前期借助分块闸板只换表层水,几天之后从换表层水转为换底层水。随着稚贝生长,其活动能力增强,摄饵量增加,可加大换水量以补充天然饵料生物,此时应更换使用孔径为1.5 cm的聚乙烯锥形网过滤进水,换水量依每天水质状况而变化,A、B垦区每2~3 d在换水后分别以1.0~2.0、0.5~1.0 mg/dm3的肥料浓度施用尿素和复合肥;每4~5 d在换水后以2 mg/dm3的浓度施用发酵鱼糜。稚贝变态后,逐渐降低水位,平均水深保持在0.6~0.8 m,以利于底栖硅藻的生长。C垦区前期每天经孔径为1.5 cm的聚乙烯锥形网过滤进水5~10 cm,保持水位高于A、B垦区30 cm左右。每1~2 d分别以1.0~2.0、0.5~1.0 mg/dm3的肥料浓度施用尿素和复合肥;每4~5 d分别以2.0~3.0、0.5~1.0 mg/dm3的肥料浓度施用碳酸氢铵和碳酸二氢钾。C垦区每4~5 d向A、B垦区轮流排入肥水。初期稚贝经过50~60 d培育,壳长可达1.5~4.0 mm,此时贝壳出现各种颜色和不同形状花纹,为砂粒苗,采用专用船只进行机械采收。
1.2.7 敌害防控 育苗期间敌害生物主要为条浒苔(Enteromorphaclathrata)、巢沙蚕(Diopatraamboinensis)、球栉水母(Pleurobranchiaglobosa)、虾类、蟹类、鲷科鱼类等。治理浒苔一般以预防为主,一旦发现少量浒苔或池水透明度过高,则从C垦区引入肥水,降低透明度,同时适当提高水位,增加施肥量。若浒苔大量繁殖,须配合机械船快速打捞、清除。利用人工撒网配合排水捕捞鱼、虾、蟹。在背风处以手抄网捕捞球栉水母。巢沙蚕的幼虫具有较强趋光性,可用灯光照射诱捕,以80目聚乙烯网捞出。
1.2.8 日常管理 每天定时测定垦区海水温度、盐度、pH、透明度和溶解氧,每3 d测定垦区海水活性磷酸盐、氨氮和观察计浮游植物种类和数量。定期取样测定底质有机碳质量分数和硫化物含量。水质指标采样和测定,浮游植物采样和计数,底质指标采样、存储和测定按照《海洋监测规范》[11-13]进行。定期取样观察幼虫、稚贝的生长和摄食情况,计数幼虫、稚贝数量。
2 结果与讨论
2.1 环境生态因子
2.1.1 水质指标 2017年9月至2018年1月,A、B垦区育苗期间的水质指标见表1。水温随着时间推移逐渐降低,盐度、pH、溶解氧相对稳定,氨氮、亚硝酸盐、活性磷酸盐逐渐升高。

表1 育苗期间水质指标Tab.1 Water quality indexes during seed breeding
2.1.2 浮游植物 2017年9—12月菲律宾蛤仔育苗生产期间,A、B、C垦区的浮游植物密度变化情况见图2。垦区浮游植物主要为硅藻,如柔弱拟菱形藻(Pseudo-nitzschiadelicatissima)、旋链角毛藻(Chaetoceroscurvisetus)、丹麦细柱藻(Leptocylindrusdanicus)、拟旋链角毛藻(Chaetocerospseudocurvisetus)、日本星杆藻(Asterionellajaponica)、菱形海线藻(Thalassionemanitzschioides)、中肋骨条藻(Skeletonemacostatum)等。随着水温的降低及育苗生产的开展,浮游植物密度均呈下降趋势。9月份浮游植物密度最高,A、B、C垦区分别为2.492 3×106、2.009 4×106、4.240 6×106ind./dm3;12月份浮游植物密度最低,A、B、C垦区分别为0.005 8×106、0.005 2×106、0.012 7×106ind./dm3。

图2 2017年垦区浮游植物密度的变化Fig.2 Density changes of phytoplankton in different flats in 2017
2.1.3 底质状况 菲律宾蛤仔育苗垦区含沙量为75%~90%,其中A、B垦区育苗期间的有机碳和硫化物指标见表2。有机碳和硫化物检测结果显示,A、B垦区育苗期间的有机碳质量分数和硫化物含量逐渐升高。A、B垦区的有机物分别从0.17%、0.14%上升到0.34%、0.32%,硫化物从0.63、0.70 mg/kg上升到3.67、3.67 mg/kg。
2.2 亲贝投放及产卵
育苗期间菲律宾蛤仔亲贝共出现4次大规模产卵(表3)。其中,2017年10月22日(末次排放)亲贝精卵排放率和受精卵数量最高,A垦区分别达84.0%、35 618亿粒,B垦区分别达72.0%、13 407亿粒;2017年9月5日—7日(首次排放)亲贝精卵排放率和受精卵数量低,A垦区分别为34.5%、5 023亿粒,B垦区分别为32.0%、2 201亿粒。第四批次产卵的孵化率最高,其中A垦区为68.54%,B垦区为67.17%;第三批次产卵的孵化率最低,其中A垦区为45.00%,B垦区为46.43%。

表2 育苗期间有机碳和硫化物指标Tab.2 Indexes of organic carbon and sulfide during seed breeding
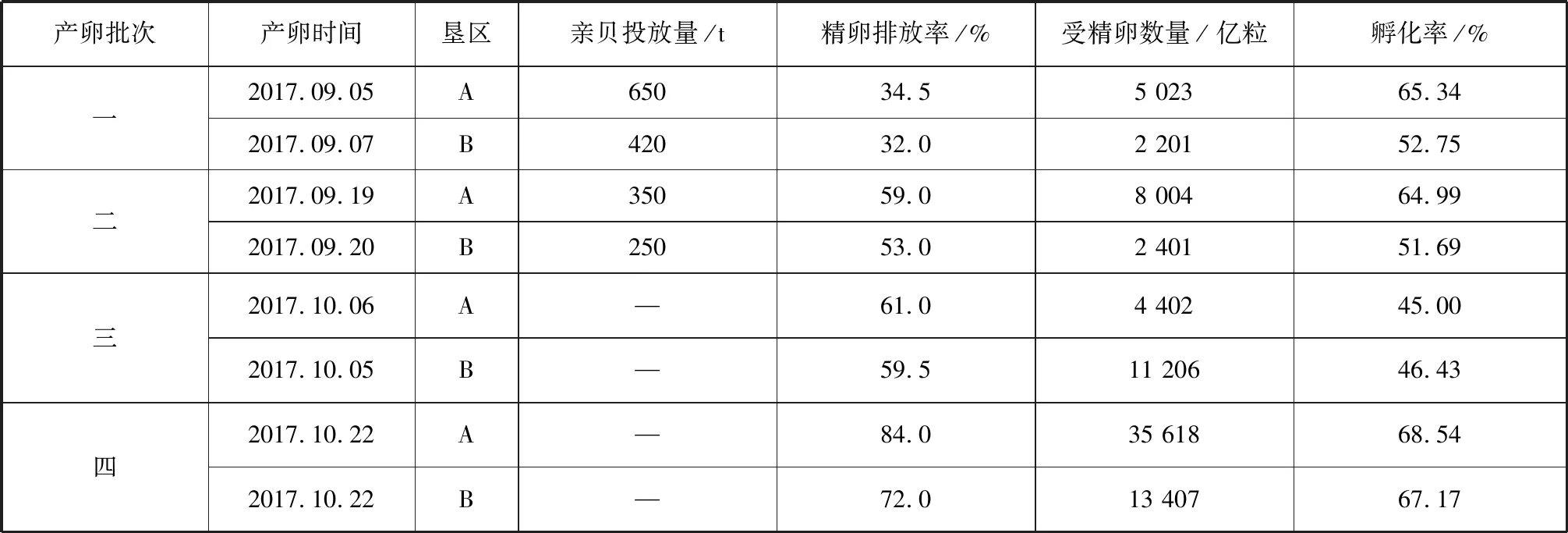
表3 菲律宾蛤仔亲贝投放及产卵情况Tab.3 Numbers of parent clam delivery and spawning eggs
注:第三、四批次精卵是由第一、二批次投放的亲贝所排放。
2.3 浮游幼虫生长及变态
4个产卵批次的菲律宾蛤仔浮游幼虫生长速度见图3。A、B垦区均为第三产卵批次的浮游幼虫生长速度最快,分别为7.13、7.14 μm/d;第四产卵批次的浮游幼虫生长速度最慢分别为4.73、4.94 μm/d。
菲律宾蛤仔稚贝密度、数量及变态率见表4,其中第三产卵批次因变态期间遭遇台风,几乎全部死亡。第四产卵批次的稚贝密度最高,A、B垦区稚贝密度分别为16.88、13.62万粒/m2,稚贝数量分别为6 752、2 724亿粒;垦区B的第二产卵批次稚贝密度和数量最低,分别为2.58万粒/m2、516亿粒。第一产卵批次的变态率最高,为59.67%;第四产卵批次的变态率最低,为28.37%。
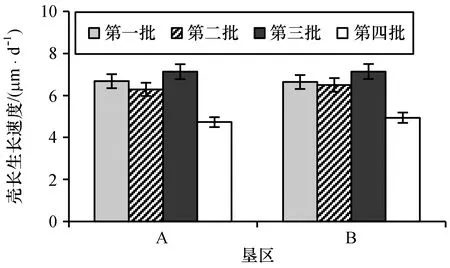
图3 不同产卵批次的菲律宾蛤仔浮游幼虫生长速度Fig.3 Growth rate of planktonic larvae in different spawning batches
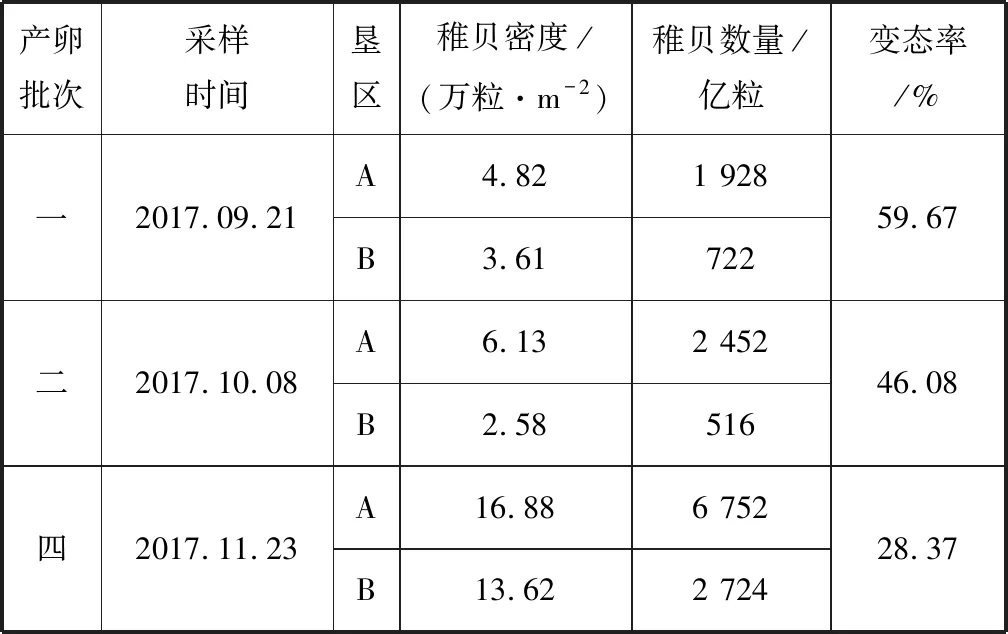
表4 菲律宾蛤仔稚贝密度、数量及变态率Tab.4 Density,quantity and metamorphosis rate of Malina clam juveniles
注:第三产卵批次遭遇台风,几乎全部死亡,未进行统计。
2.4 稚贝生长及成活率
3个产卵批次的菲律宾蛤仔稚贝壳长生长速度见图4。垦区A、B均为第一产卵批次的稚贝壳长生长速度最快,壳长生长速度分别为22.01、25.10 μm/d;垦区A、B均为第四产卵批次的稚贝壳长生长速度最慢,其壳长生长速度分别为7.08、7.11 μm/d。

图4 不同产卵批次的菲律宾蛤仔稚贝壳长生长速度Fig.4 Growth rates of Malina clam juveniles in different spawning batches
菲律宾蛤仔砂粒苗密度、数量及成活率见表5。2018年1月5日取样计数,垦区A砂粒苗平均密度为13.32万粒/m2,数量为5 328亿粒;垦区B砂粒苗平均密度为11.26万粒/m2,数量为2 252亿粒。A、B两垦区砂粒苗合计为7 580亿粒,成活率为50.23%。
2.5 讨论
2.5.1 环境生态因子对菲律宾蛤仔垦区育苗的影响 环境生态因子不但影响菲律宾蛤仔幼虫、稚贝的代谢,而且影响其饵料生物的生长与繁殖,从而间接影响了幼虫、稚贝的生长和存活。本研究显示,随着育苗时间的推移,垦区A、B中氨氮(0.12~0.27 mg/dm3)、亚硝酸盐(0.007 5~0.024 0 mg/dm3)及活性磷酸盐(0.005 0~0.016 5 mg/dm3)含量逐渐增加。张凯等(2015)对菲律宾蛤仔混养研究[14]及张磊等(2015)对菲律宾蛤仔养殖池塘环境研究[15]结果表明,养殖池塘中氨氮、亚硝酸盐、活性磷酸盐均显著高于本研究,这可能与养殖池塘中投喂饲料及养殖对象排泄物较多有关。
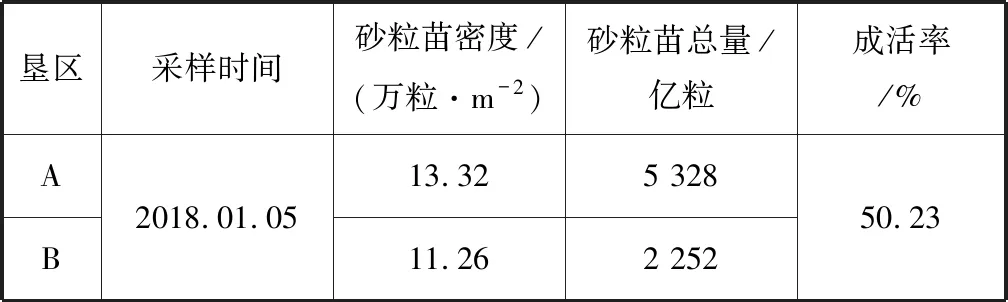
表5 菲律宾蛤仔砂粒苗密度、数量及成活率Tab.5 Density,quantity and survival rate of grain-size Malina clam juveniles
菲律宾蛤仔垦区育苗的饵料生物浮游植物营养盐来源主要依靠人工施加尿素、复合肥、过磷酸钙等,施肥量根据藻色及天气情况来确定。本研究中浮游植物密度随着水温的降低及育苗生产的开展呈下降趋势,其中垦区C浮游植物密度明显高于垦区A、B。徐晓津等(2010)对不同月份菲律宾蛤仔养殖池塘中浮游植物变化的研究表明,受气温、天气、营养盐等复杂因素的影响,浮游植物细胞丰度波动很大[16]。
育苗垦区环境中有机碳和硫化物不但会影响垦区海水环境质量,对垦区菲律宾蛤仔幼虫和稚贝造成直接危害,同时还是导致垦区育苗环境老化的主要因素[17]。本研究中,垦区A、B的有机碳质量分数在育苗期间变化范围分别为0.17%~0.34%、0.14%~0.32%,与刺参(Apostichopusjaponicus)养殖池塘有机碳质量分数(0.28%~0.37%)[18]相一致,低于中国对虾(Fenneropenaeuschinensis)与罗非鱼(Tilapia)混养池塘有机碳质量分数(0.40%~1.48%)[19];垦区A、B的硫化物的含量在育苗期间变化范围分别为0.63~3.67、0.70~3.67 mg/kg,显著低于虾贝混养池塘硫化物含量(143.26~372.45 mg/kg)[20]。因此,每年5—6月对育苗垦区进行清淤、曝晒,对于垦区育苗环境的优化、老化育苗区域的生态修复以及菲律宾蛤仔的育苗模式等方面都具有重要的生产意义。
2.5.2 三垦区互联对菲律宾蛤仔育苗的影响 在菲律宾蛤仔土池或垦区育苗生产中,一般采用单口土池或围垦区同时进行培养肥水和人工育苗生产[5-6]。本研究中的三口垦区A、B、C是由一口万亩围垦区分割而成,其中垦区A、B作为育苗池,垦区C作为饵料池;共培育出菲律宾蛤仔砂粒苗7 580亿粒,对比常规垦区育苗产量提高150%以上,其三垦区互联的育苗方式起到了关键作用。首先,苗种培育过程中垦区A、B两池池水可以进行部分交换,从而可以合理有效地调控浮游幼虫及饵料生物密度。其次,垦区C在育苗过程中,通过施加高浓度营养盐,培育天然生物饵料,保持较高的饵料密度。垦区C的高密度生物饵料不定时排入垦区A、B,并在垦区A、B通过适当施肥,保证育苗垦区藻类供给,满足幼虫和稚贝的饵料需求。三垦区互联能有效保持育苗垦区生物饵料浓度和水质指标处于较为理想的范围之内,避免应急性地大量施肥和大量投放人工辅助饵料而造成浪费和水质恶化,节约了育苗成本,降低育苗风险。
2.5.3 幼虫和稚贝培育 菲律宾蛤仔垦区育苗生产成功与否,关键在于浮游幼虫和稚贝的培育。本研究结果表明,温度对浮游幼虫尤其是稚贝生长影响显著;随着水温降低,浮游幼虫壳长生长速度从6.64~6.68 μm/d降至4.73~4.94 μm/d,稚贝壳长生长速度从22.01~25.10 μm/d降至7.08~7.11 μm/d。同时,培育密度对浮游幼虫和稚贝生长也存在一定影响;垦区A的浮游幼虫和稚贝密度(4.82~16.88、13.32万粒/m2)均高于垦区B(3.61~13.62、11.26万粒/m2),但垦区A浮游幼虫和稚贝壳长生长速度(4.73~7.13、7.08~22.01 μm/d)均低于垦区B(4.94~7.14、7.11~25.10 μm/d)。闫喜武(2005)对莆田的菲律宾蛤仔群体进行室内工厂化人工育苗结果显示,浮游幼虫和稚贝的壳长生长速度分别为9.79~12.47、11.5~60.1 μm/d[21],均高于本研究结果,这与不同育苗方法及饵料生物有关。刘忠颖等(2004)对菲律宾蛤仔苗种土池和滩涂培育效果进行比较,认为饵料生物是影响稚贝培育效果的主要原因[22]。因此,菲律宾蛤仔垦区育苗过程中,除水温外,需控制幼虫和稚贝的培育密度、饵料生物密度以及氨氮等水质指标,以确保育苗的成功。
3 结论
2017—2018年,在福清东壁岛垦区开展了菲律宾蛤仔垦区三联人工育苗技术研究,优化了育苗技术工艺,共培育砂粒苗7 580亿粒,育苗成活率达50.23%。采用垦区三联方法可保障菲律宾蛤仔苗种的生物饵料供给,苗种产量比常规垦区方法提高了150%以上,其三垦区互联的育苗方式起到了关键作用。

