蚯蚓提取物对家蚕中肠氧化损伤、总抗氧化能力及抗氧化酶含量的影响
徐麒麟, 齐桂兰, 蒋易龙, 倪 奎, 陈亚迎, 刘瀚扬,朱佳文, 吴永胜,*
(1. 成都市农林科学院畜牧研究所, 成都 611130; 2. 四川农业大学动物科技学院, 成都 611130;3. 乐至县蚕桑局, 四川乐至 641500)
家蚕Bombyxmori作为鳞翅目(Lepidoptera)昆虫的代表,是仅次于果蝇的模式昆虫,具有繁殖率高、遗传资源丰富、遗传背景清楚等优点,是遗传学、细胞生物学、基因组学研究不可多得的宝贵资源(贾漫丽等, 2018; 李娜等, 2018)。与哺乳动物不同,昆虫缺乏复杂的免疫球蛋白,而是通过体液免疫和细胞免疫抵御外源病原微生物侵染,体液免疫应答主要包括产生抗菌肽、溶菌酶和黑化反应,细胞免疫应答包括吞噬作用、结节形成和包囊作用等过程(唐芬芬等, 2017)。在病原体侵染或外界环境变化的条件下,生物体活性氧代谢容易失衡,过多的活性氧易造成氧化应激并最终诱导细胞凋亡。家蚕在长期的进化过程中,为避免氧化损伤,形成了一整套高效的抗氧化酶防御系统以维持机体的氧化还原平衡,包括过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)等(袁红霞等, 2014)。
蚯蚓,俗称地龙,由于其丰富的营养成分和显著的临床疾病治疗效果在传统中医中广泛应用。近些年,蚯蚓及其提取物越来越受到关注,蚯蚓提取液富含多种氨基酸、蚓激酶、活性抗菌肽等功效成分,具有促生长、解热、镇痛、抗炎、抑菌、抗衰老和抗癌等多种功效(Omaretal., 2012; Yangetal., 2016; Luoetal., 2018)。本实验室前期研究发现饮水中添加稀释300倍的蚯蚓提取液可以提高伊莎学佛黑鸡育成期的体液免疫水平(李娟等, 2018),饲料中添加蚯蚓提取物(earthworm extract, EE)可以降低乳酸脱氢酶(lactate dehydrogenase, LDH)水平进而提高成华猪的抗氧化能力(徐麒麟等, 2019)。饲粮中添加蚯蚓提取物可以提高小鼠血清中超氧化物歧化酶活性和总抗氧化能力(total antioxidant capacity, T-AOC)(刘瀚扬等, 2019)。覃明和等(1988)研究发现,蚯蚓提取物可促进家蚕生长,缩短家蚕发育龄期,提高蚕茧和蚕丝质量,提高产卵量。然而目前尚未见蚯蚓提取物对家蚕抗氧化酶活性的影响研究报道。因此,本实验探究蚯蚓提取液对家蚕中肠氧化损伤、总抗氧化能力、抗氧化酶含量的影响,旨在筛选最适蚯蚓提取液的稀释比例,并验证其生物学功能。
1 材料与方法
1.1 材料
1.1.1家蚕和蚯蚓提取液:供试家蚕品种西昌871×872,由四川省乐至县蚕桑局提供,新鲜桑叶常规饲养。实验用蚯蚓提取液原液由成都市农林科学院畜牧研究所研制,蚯蚓为人工饲养的赤子爱胜蚓Eiseniafoetida,蚯蚓提取液用蒸馏水混匀,经自融水解后制备,经检测分析,所制备的蚯蚓提取液原液密度1.048 g/mL,其中氨基酸总量(17种) 5.42%、游离氨基酸2.97%、SOD酶1.23 IU/mg、小肽6.95%(刘瀚扬等, 2019; 徐麒麟等, 2019)。
1.1.2主要试剂:家蚕丙二醛、乳酸脱氢酶、总抗氧化能力、过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶ELISA试剂盒购自北京奇松生物科技有限公司,动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司,反转录及荧光定量PCR试剂盒购自宝生物工程(大连)有限公司。
1.1.3主要仪器:高速冷冻离心机(Eppendorf)、酶标仪(Thermo Fisher Multiskan)、荧光定量PCR仪(Bio-Rad)。
1.2 蚯蚓提取液稀释及家蚕添食处理
本实验设计3个蚯蚓提取液稀释比例组EE1, EE2和EE3,原液稀释比例分别为50, 100和200倍,蚯蚓提取液用蒸馏水稀释。使用时按50 mL/kg比例喷洒新鲜桑叶,对照组(CK)则采用蒸馏水替代。
家蚕幼虫在室内温度25±1℃、相对湿度(RH) 75%的条件下采用新鲜桑叶(川南饲用桑)饲喂至5龄,选取发育整齐的5龄幼虫600头,随机分为4组(每组3个重复,每个重复区50头家蚕)。按50 mL/kg比例喷洒新鲜桑叶,稍晾干后给家蚕添食,对照组则用蒸馏水替代。每天添食3次(分别在6∶00, 13∶00和20∶00时),每区每次添食100 g桑叶,添食前将未食用完的桑叶清理干净,连续处理6 d,第7天随机选取10头家蚕,迅速解剖获取中肠,并置于-80℃冰箱保存备用。
1.3 氧化损伤及抗氧化指标检测
将1.2节中所获取的中肠组织用预冷的PBS缓冲液匀浆后6 000 r/min离心10 min,取上清液用于氧化损伤及抗氧化指标检测。按照试剂盒说明书操作检测中肠组织丙二醛、乳酸脱氢酶、过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶含量和总抗氧化能力。
设置标准品孔和样品孔,标准品孔加入不同浓度的标准品50 μL,样品孔先加入待测样品10 μL,再加入40 μL样品稀释液,标准品孔和样品孔加入辣根过氧化物酶(HRP)标记的抗体100 μL,用封板膜封住反应孔后37℃恒温箱孵育60 min。孵育完成后弃掉液体,加入洗涤液洗涤后每孔加入底物A, B各50 μL,37℃避光孵育15 min,孵育完成后每孔加入50 μL的终止液,15 min内检测各孔的0D450值。根据标准样品的OD450构建标准曲线,通过样品的OD450值计算待测样品相关指标的含量。
1.4 总RNA提取与反转录
按照天根动物组织总RNA提取试剂盒操作说明书提取1.2节所采集的家蚕幼虫中肠组织总RNA。参照反转录试剂盒说明书将组织总RNA反转录成cDNA模板。反应体系(20 μL): 9.0 μL RNase Free dH2O, 1.0 μL Oligo dT Primer, 1.0 μL Random 6 mers, 4.0 μL 5×PrimeScript Buffer, 1.0 μL PrimeScript RT Enzyme Mix I和4.0 μL中肠组织总RNA。反应条件: 37℃ 15 min, 85℃ 5 s, 4℃ 5 min,反应完成后将cDNA模板置于-20℃冰箱保存备用。
1.5 实时荧光定量PCR
根据NCBI数据库中家蚕抗氧化酶基因Cat(GenBank登录号: NM_001043447.1)、Sod(GenBank登录号: NM_001043619.1)和GSH-Px(GenBank登录号: NM_001046639.1)编码区序列,采用Primer Premier 6和Oligo 7软件设计定量引物并委托北京六合华大基因科技股份有限公司合成,引物信息如下表1所示。
荧光定量PCR采用TB GreenTMPremix Ex TaqTMII (Tli RNaseH Plus)试剂盒(TaKaRa, 大连)。以家蚕β-actin(GenBank登录号: 49644.1)为内参基因,采用实时荧光定量PCR检测各组中肠组织中抗氧化酶关键基因Cat,Sod和GSH-Px的相对表达量。反应体系(20 μL): SYBR Green 10.0 μL, 上、下游引物(10 μmol/L)各0.4 μL, cDNA模板1.0 μL, RNase Free dH2O 8.2 μL。反应条件: 95℃预变性3 min; 95℃变性10 s, 59(61.4)℃退火30 s, 72℃延伸30 s, 39个循环;95℃ 10 s,然后以0.5℃/10 s的速率从65℃缓慢升温至95℃,绘制溶解曲线,每个样品3个重复。

表1 实验所用引物Table 1 Primers used in the experiment
1.6 数据分析
实验数据采用SAS 9.2统计分析软件进行统计,结果用平均值±标准差(means±SD)表示,使用t检验分析显著性,P<0.05表示差异显著。荧光定量采用2-△△Ct法处理数据,用β-actin作为内参基因,以对照组中肠组织中基因表达量为1,计算Cat,Sod和GSH-Px基因的相对表达量,所有实验结果均采用GraphPad Prism6 软件作图。
2 结果
2.1 蚯蚓提取液对家蚕5龄幼虫中肠抗氧化产物丙二醛和乳酸脱氢酶含量的影响
如图1(A)所示,家蚕5龄幼虫食用了蚯蚓提取液稀释液处理的桑叶后,50, 100和200倍3个蚯蚓提取液原液稀释组中肠组织氧化损伤产物MDA含量与对照组相比差异不显著(P>0.05)。
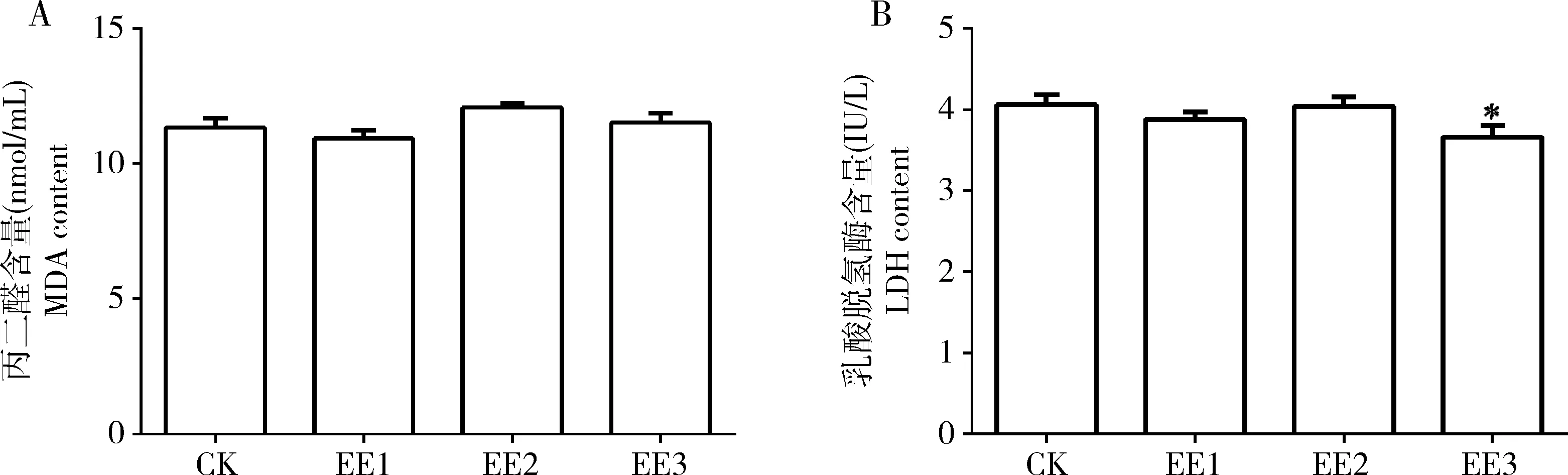
图1 蚯蚓提取液对家蚕5龄幼虫中肠丙二醛(A)和乳酸脱氢酶(B)含量的影响Fig. 1 Effect of earthworm extract solution on the contents of malondialdehyde (MDA) (A) and lactate dehydrogenase (LDH) (B) in the midgut of the 5th instar larvae of Bombyx moriCK: 对照组(蒸馏水)Control group (distilled water); EE1: 50倍蚯蚓提取液原液稀释组Treatment group with 50-fold dilution of the original earthworm extract solution; EE2: 100倍蚯蚓提取液原液稀释组Treatment group with 100-fold dilution of the original earthworm extract solution; EE3: 200倍蚯蚓提取液原液稀释组Treatment group with 200-fold dilution of the original earthworm extract solution. 图中数据为平均值±标准差(n=3);柱上星号表示对照组和蚯蚓提取液处理组间差异显著(P<0.05, t检验)。Data in the figure are means±SD (n=3). Asterisk above bars indicates significant difference between the control group and the earthworm extract solution treatment groups (P<0.05, t-test). 下图同The same for the following figures.
如图1(B)所示,家蚕5龄幼虫食用了蚯蚓提取液稀释液处理的桑叶后,中肠组织氧化损伤产物LDH含量有所下降。其中,200倍蚯蚓提取液原液稀释组中肠组织中LDH含量与对照组相比显著降低了9.85%(P<0.05),而50和100倍稀释组LDH含量与对照组差异不显著(P>0.05)。
2.2 蚯蚓提取液对家蚕5龄幼虫中肠总抗氧化能力的影响
总抗氧化能力是由各种抗氧化物质和抗氧化酶构成,其数值的高低与机体清除自由基的能力呈正相关。如图2所示,家蚕5龄幼虫食用了蚯蚓提取液稀释液处理的桑叶后,50, 100和200倍蚯蚓提取液原液稀释组中肠组织中总抗氧化能力与对照组相比差异不显著(P>0.05)。
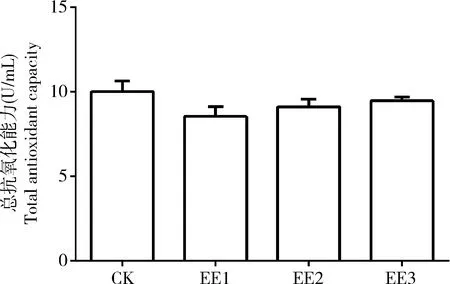
图2 蚯蚓提取液对家蚕5龄幼虫中肠总抗氧化能力的影响Fig. 2 Effect of earthworm extract solution on the total antioxidant capacity in the midgut of the 5th instar larvae of Bombyx mori
2.3 蚯蚓提取液对家蚕5龄幼虫中肠抗氧化酶基因表达的影响
如图3所示,家蚕5龄幼虫食用了蚯蚓提取液稀释液处理的桑叶后,中肠组织中抗氧化酶关键基因的相对表达量均有上调。其中,100倍蚯蚓提取液原液稀释组中肠中Cat和GSH-Px的表达量分别是对照组的1.84(图3: A)和1.39倍(P<0.05)(图3: C), 50, 100和200倍蚯蚓提取液原液稀释组中Sod的表达量分别是对照组的1.58, 2.06和1.61倍(P<0.05)(图3: B)。
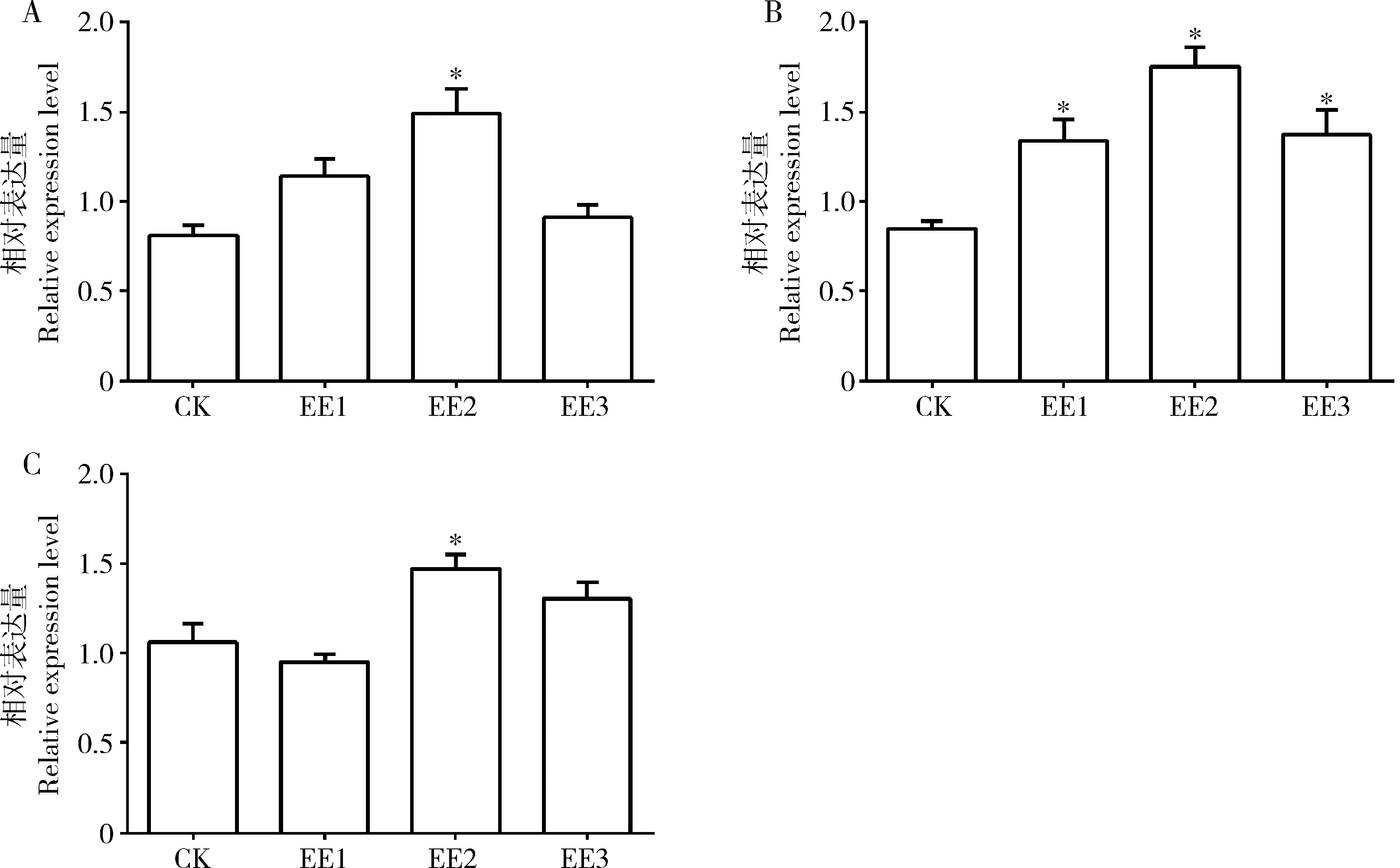
图3 蚯蚓提取液对家蚕5龄幼虫中肠抗氧化酶基因表达的影响Fig. 3 Effect of earthworm extract solution on the expression of antioxidant enzyme genes in the midgut of the 5th instar larvae of Bombyx moriA: Cat; B: Sod; C: GSH-Px. 以actin基因为内参。The actin gene was used as the internal reference.
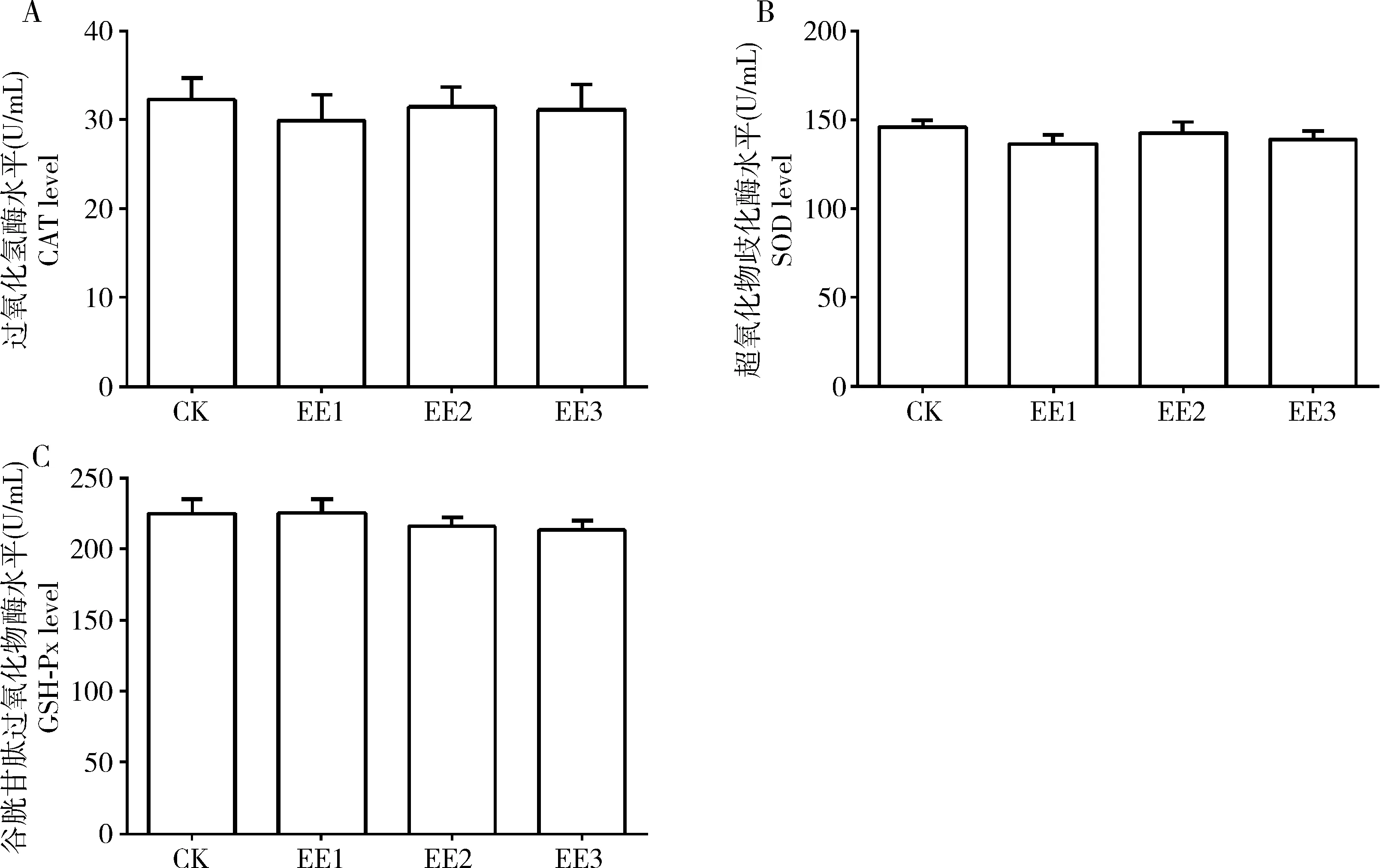
图4 蚯蚓提取液对家蚕5龄幼虫中肠抗氧化酶含量的影响Fig. 4 Effect of earthworm extract solution on the contents of antioxidant enzyme in the midgut of the 5th instar larvae of Bombyx moriA: 过氧化氢酶Catalase; B: 超氧化物歧化酶Superoxide dismutase; C: 谷胱甘肽过氧化物酶Glutathione peroxidase.
2.4 蚯蚓提取液对家蚕5龄幼虫中肠抗氧化酶含量的影响
如图4所示,家蚕5龄幼虫食用了蚯蚓提取液稀释液处理的桑叶后,50, 100和200倍蚯蚓提取液原液稀释组中肠组织中CAT, SOD和GSH-Px的含量与对照组相比均没有显著差异(P>0.05)。
3 讨论
抗氧化防御系统是昆虫抗逆机制的一个重要组成部分,它能够避免或减轻由外源性污染物或不利条件下导致的氧化损伤,保证机体正常生命活动的进行(刘井兰等, 2006)。蚯蚓提取液富含多种氨基酸、微量元素、抗氧化酶及抗菌肽等活性物质,具有促生长、抗菌、提高机体抗氧化及免疫功能等作用(谢大识等, 2008)。本实验研究发现,蚯蚓提取液可降低乳酸脱氢酶含量,提高抗氧化酶关键基因的表达。
丙二醛含量是膜脂质过氧化终产物,丙二醛含量间接反应了机体内活性氧自由基水平和细胞的损伤程度(戴金妹等, 2015)。丙二醛含量升高可使生物膜的多不饱和脂肪酸发生氧化反应,并且通过脂氢过氧化物的分解产物引起细胞损伤,导致细胞膜构型、结构和通透性改变进而诱导氧化应激(米智等, 2013)。肖龙云等(2010)研究发现, 5龄幼虫期氟化物中毒家蚕体内氧自由基上升,脂质过氧化物作用增强,其表现为氟化物中毒组血淋巴中丙二醛水平比正常组高83.77%。袁红霞等(2014)研究发现镉胁迫可造成5龄家蚕幼虫脂肪体中丙二醛水平升高并导致其氧化损伤。吴宿慧等(2015)研究发现决明子可以降低家蚕血淋巴中丙二醛水平并提高机体抗氧化能力。周亿金和李文平(2009)研究发现蚯蚓提取液可降低小鼠血液和肝脏中丙二醛水平。而本实验研究发现家蚕食用蚯蚓提取液处理的桑叶后,中肠组织中丙二醛含量没有显著变化(图1),表明在上述剂量下蚯蚓提取液不是通过影响丙二醛的含量进而影响中肠组织脂质氧化损伤。
乳酸脱氢酶是一种细胞质氧化还原酶,在组织中广泛表达,主要作用是催化乳酸氧化为丙酮酸,在三羧酸循环过程中具有重要作用(Sifi and Soltani, 2018),乳酸脱氢酶是机体病理损伤、炎症反应和氧化应激的标志,其水平常常用于细胞和组织毒理学领域和临床生物学诊断(Akilaetal., 2017)。Deng等(2019)研究发现,蚯蚓提取物可以显著降低小鼠肿瘤的大小,降低乳酸脱氢酶水平并促进肿瘤细胞凋亡。我们前期研究发现饲料中添加蚯蚓提取物可以降低乳酸脱氢酶水平进而提高成华猪的抗氧化能力(徐麒麟等, 2019)。本研究发现,与对照组相比,200倍蚯蚓提取液原液稀释组乳酸脱氢酶含量显著降低了9.85%(P<0.05)(图1),表明上述剂量下蚯蚓提取液可通过降低乳酸脱氢酶含量进而减轻家蚕中肠的脂质损伤。
总抗氧化能力反映了机体清除活性氧的能力。范涛等(2016)研究发现蚯蚓粉替代鱼粉对大鳞副泥鳅总肝胰脏总抗氧化能力没有影响。李荣妮等(2018)研究发现蚯蚓粪对罗非鱼血清中总抗氧化能力也没有影响。我们前期研究发现,饲粮中添加蚯蚓提取物可以提高小鼠血清中总抗氧化能力(刘瀚扬等, 2019),而本研究发现蚯蚓提取液处理后家蚕中肠组织中总抗氧化能力没有显著变化(图2),这与我们在成华猪上的研究结果(徐麒麟等, 2019)相一致,表明蚯蚓提取物对动物的总抗氧化能力的影响可能存在种属及组织差异。
蚯蚓提取液中富含丰富的过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶等抗氧化酶,越来越多的研究表明蚯蚓提取物可以提高机体抗氧化能力,其表现为促进抗氧化酶基因的表达和提高抗氧化酶水平。Omar等(2012)研究发现蚯蚓提取物可以提高过氧化氢酶和超氧化物歧化酶活性及谷胱甘肽含量而发挥抗氧化作用。Prakash等(2008)研究发现蚯蚓粉可上调大鼠肝脏过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶活性进而发挥保肝和抗氧化作用。周亿金和李文平(2009)研究发现蚯蚓提取物提高成年小鼠血液和肝脏组织中过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶活性。本研究发现100倍蚯蚓提取液原液稀释组中肠中Cat和GSH-PxmRNA表达量显著高于对照组(P<0.05),3个稀释组中Sod的mRNA表达量均显著高于对照组(P<0.05)(图3),但上述关键抗氧化酶的含量与对照组却没有差异(图4),一方面可能是由于检测方法灵敏度的原因,另一方面,抗氧化酶转录水平的提高也不一定会造成翻译水平的提高。
本研究结果表明,家蚕5龄幼虫添食蚯蚓提取物的桑叶可降低中肠组织中乳酸脱氢酶含量,促进过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶基因的表达。

