金丝桃素介导的光动力学疗法对K562细胞活性与自噬的影响
王德选,王万铁,郑绿珍,陈伟伟,杨青,庄捷秋,许益笑,
(1.温州医科大学附属第二医院育英儿童医院小儿肾内科,浙江温州325027;2.温州医科大学基础医学院病理生理教研室,浙江温州325035)
我国白血病年发病率为3~4/10万,且呈逐年增加趋势[1]。目前白血病治疗方式主要有化疗、药物靶向治疗、骨髓和干细胞移植等,取得了一定的治愈和缓解效果,但存在不同程度的化疗药物耐药及不良反应、移植配型困难、费用高昂等缺点。因此,在原有治疗基础上,探索一些安全有效的辅助治疗方法显得极为重要。
金丝桃素(hypericin)是植物贯叶连翘提取物的主要活性成分之一,临床上已作为抗病毒、抗抑郁药物应用多年,具有很高的药物安全性[2-3]。另外金丝桃素作为一种天然光敏剂,还具有低光照下毒性低和光依赖性抗肿瘤活性强的双重特点,可对较多实体肿瘤实施光动力学治疗作用[4]。金丝桃素容易被白细胞等有核血液细胞摄取,但封闭血管系统中流动的各种血细胞都无法直接照射,也限制了金丝桃素介导的光动力学疗法(hypericinmediated photodynamic therapy,Hyp-PDT)在血液系统疾病的应用。本课题组研制了倒置可调功率光动力学照射平台,通过体外循环实施Hyp-PDT(另文发表)并研究其相关机制。本研究主要探索Hyp-PDT对体外培养的K562细胞株的杀伤作用及对自噬通路的影响,希望为Hyp-PDT引入外周血白血病的治疗提供理论验证,改善白血病患者的健康。
1 材料和方法
1.1 材料 K562 细胞株购自上海生科院细胞资源中心;高纯度金丝桃素购自美国Sigma公司。CCK-8分析试剂盒购于日本Dojindo Laboratories;Beclin-1、LC3 及Akt兔多克隆抗体购自美国Cell Signal Technology公司;二抗为美国Jackson ImmunoResearch公司产品;培养基RPMI1640购自美国Gibco公司;胎牛血清购自杭州四季青公司。
1.2 细胞培养 含10%胎牛血清的1640培养液中添加100μg/mL链霉素和lOOU/mL青霉素,培养箱条件为5%CO2,37℃。根据实验设计,在超净台暗环境下进行细胞分组,细胞密度调整为约5×105个/mL。
1.3 光动力学干预及CCK-8 法测定细胞活性 将K562细胞悬液分为3组接种于96孔板:金丝桃素组培养液中含0.4μg/mL金丝桃素及DMSO助溶剂;正常细胞组培养液中添加等体积0.9%氯化钠溶液;DMSO组培养液中含有等体积DMSO。每孔含培养液100μL。避光孵育4h,用0.3mW/cm2的光强度(预实验获得的最佳光照强度)对样品照射4min。
10μLCCK-8溶液分别于光照前、光照后5min、4h、8h和16h不同时间点加入每孔培养液中(每个时间点5孔)。每个96孔板空白对照孔均加入等量CCK-8溶液、药物以及不含细胞的细胞培养液。继续避光孵育1h后测定每孔的吸光度值(OD值),酶标仪测定波长为450nm。
细胞活力=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%。A(加药):每孔含细胞、金丝桃素培养液的OD值。A(空白):每孔含金丝桃素培养液而无细胞的OD值。A(0加药):每孔含细胞及培养液,但无金丝桃素的OD值。
1.4 光动力学干预前后K562细胞形态及自噬体数量变化 在6cm培养皿中加入浓度为0.4μg/mL的金丝桃素培养液及K562细胞悬液,避光孵育4h,以主波为595nm波长的LED灯照射4min,细胞位置光强度为0.3mW/cm2。显微镜下观察照射前、照射后8h、照射后16h细胞形态学变化。另设未加金丝桃素的细胞作为对照(DMSO组)。
细胞分组及干预同上,在照射前、照射后8h收集细胞悬液,经1200r/min离心10min,弃上清液,细胞团与2.5%戊二醛液充分混匀固定,经过漂洗、块染、梯度脱水、包埋等常规步骤,制成厚度约80nm的切片,枸橼酸铅-30%醋酸铀双染色,透射电镜(JEM-l00CXII)下观察自噬体数量。
1.5 Western blot测定Hyp-PDT对K562细胞自噬相关蛋白的影响 细胞分组及干预同1.4。于光照前即刻,光照后4、8、16h离心收集细胞悬液,细胞裂解(RIPA液)后低温下15000r/min离心15min,取上清液待用。各组蛋白浓度配平后将样品与预热的6×Loading充分混匀,100℃水浴5min。每孔添加40μg蛋白样品后进行10%聚丙烯酰胺凝胶蛋白电泳,浓缩胶电压70mV,分离胶电压120mV。冰浴下恒流转膜(300mA)90min,依次一抗孵育4℃过夜(稀释浓度均为1:1000)、二抗室温孵育2h(稀释浓度1:12000),ECL显色。使用Bio-Rad显像仪收集图像,并用附带软件对目的条带进行量化分析。
1.6 统计学处理方法 采用SPSS22.0进行统计学分析。计量资料以表示,多组间比较采用单因素方差分析;多重比较,方差齐性采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 Hyp-PDT对K562细胞活性的影响 0.3mW/cm2光照强度下4min后,CCK-8法检测结果显示,正常细胞组、DMSO组光照前后细胞活性无明显变化,且2组间在同时间点细胞活性差异无统计学意义(均P>0.05),提示光照对K562细胞活性无明显影响。金丝桃素组光照后细胞活性随时间延长逐渐降低,与光照前比较,差异均有统计学意义(P <0.01),且与正常细胞组、DMSO组比,所有时间点的细胞活性均显著降低(均P<0.01),见表1。

表1 0.3mW/cm2光照强度下各组K562细胞活性比较(每组n=5,%)
2.2 Hyp-PDT对K562细胞形态的影响 DMSO组和金丝桃素组光照前细胞在相差显微镜下呈现为孤立性或者集落性分布的半透明球状细胞,边界清晰,折光性强(见图1A和1D)。Hyp-PDT干预后,细胞生长变慢,部分细胞不能贴壁生长,细胞的集落生长规律被破坏,可观察到大量细胞边界模糊,胞质空泡化,折光性显著下降,亦有部分细胞出现肿胀变性甚至溶解破裂(见图1B和1C)。

图1 相差显微镜观察Hyp-PDT对K562细胞形态学的影响(×400,箭头所示为空泡化及严重变形的K562细胞)
2.3 Hyp-PDT对K562细胞自噬小体的影响 电镜显示:在DMSO组及金丝桃素组照射前收集的K562细胞中可观察到具有典型的双层或多层膜结构,膜内包含细胞器或者胞浆成分的自噬体(见图2A和2C),DMSO组光照后8h胞浆内自噬体数量较前增多(见图2B),但金丝桃素组光照后8h自噬体几不可见(见图2D)。
2.4 Hyp-PDT对K562细胞自噬相关蛋白的影响 免疫印迹结果显示:与照射前比较,金丝桃素组照射后8h和16h的LC3蛋白表达量明显下降,DMSO组LC3蛋白含量则略有升高(P<0.05);金丝桃素组的Beclin-1蛋白在光照后16h时与DMSO组比较出现表达下调(P<0.01),同期p-Akt蛋白表达量也明显减少(P<0.05),但总Akt表达量在各时间点差异均无统计学意义(P>0.05)。见图3-4。
3 讨论
国内外近年来的研究表明Hyp-PDT对较多肿瘤细胞具有强大的杀伤作用,例如可诱导约94%的皮肤T细胞恶性淋巴瘤细胞进入凋亡状态[5]。本研究结果表明,在光强度为0.3mW/cm2条件下,Hyp-PDT可显著降低K562细胞的活性,且随培养时间的延长,部分细胞出现肿胀变性甚至溶解破裂,表明Hyp-PDT对白血病细胞也有强大的细胞毒性作用。
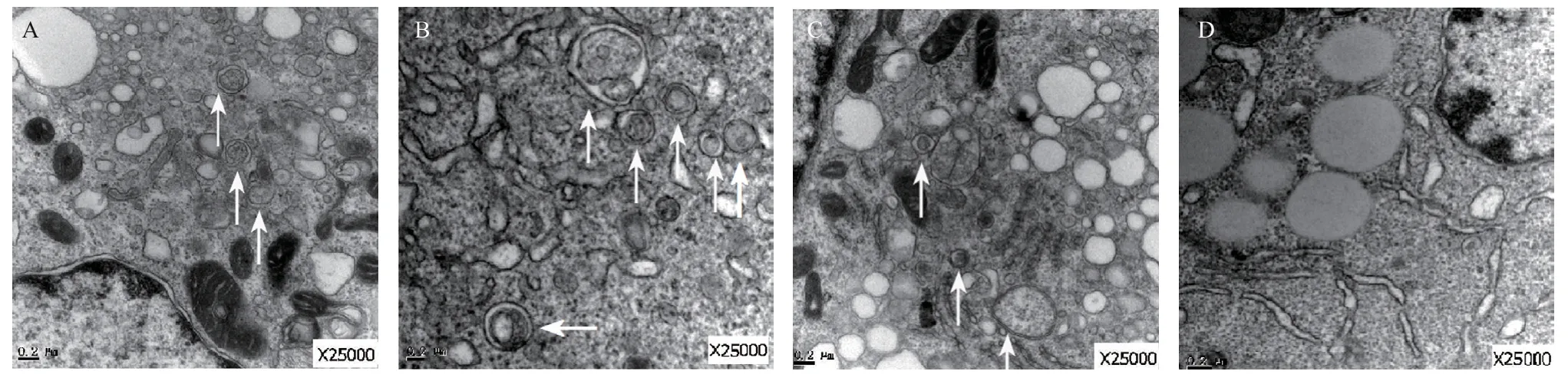
图2 电镜下K562细胞的自噬改变(箭头所示为自噬体)
适度的自噬有助于肿瘤细胞生存,减少发生凋亡的可能[6]。肿瘤细胞面临缺氧、药物作用等不利因素时,细胞质成分进入自噬途径降解为细胞可以重新利用的氨基酸等原料,有助于细胞存活;同时细胞内老化及受损的细胞器和无功能蛋白质可通过自噬途径清除,维持细胞DNA稳定性,避免发生凋亡,这是临床上抗癌治疗出现耐药性的原因之一[7]。但自噬过强会引起胞浆成分被大量降解,同时自噬溶酶体酶可剪切激活某些促凋亡因子,诱导细胞进入凋亡程序;而自噬受到过度抑制也会导致胞浆内容物清除障碍,引起肿瘤细胞死亡[7]。
急性白血病的相关研究表明,细胞内自噬可促进白血病细胞存活与增殖[8],由于包括白血病在内的肿瘤细胞常常存在自身凋亡机制失效,故肿瘤细胞较正常细胞更加依赖自噬的调节作用[9],提示抑制自噬可能有助于急性白血病的治疗。本研究观察到,K562细胞在培养过程中出现典型的自噬体,且在光照后增多,Westernblot结果显示,自噬相关LC3蛋白的表达量在光照后8h和16h也有所增加,证明白血病K562细胞中存在自噬现象,而增多的自噬体可能是白血病细胞应对营养供应减少、细胞器受损等情况出现的自身保护现象。
LC3 蛋白多表达在自噬体及与前自噬体膜上,为常见自噬体标志物,观察LC3蛋白表达水平变化可以间接确认自噬程度的情况[10]。另外自噬前体结构的重要自噬蛋白Beclin-1可介导自噬小泡的成熟,调节自噬活性,与肿瘤的发生和发展有关。文献报道Beclin-1 基因敲除后的小鼠细胞自噬减少,其肝癌、肺癌的发病率显著提升[11]。有报道提出光动力治疗产生的活性氧可以诱导自噬[9]。本研究发现,金丝桃素组在0.3mW/cm2光照射后8h和16h时的LC3蛋白表达显著减少,光照后16hBeclin-1表达量也出现下调。电镜下亦观察到光照后金丝桃素组的自噬体显著减少,自噬蛋白水平的变化与自噬体数量的变化相一致。以上结果提示实施Hyp-PDT可抑制白血病K562细胞的自噬。实验中检测到p-Akt蛋白表达的同步下降,则提示Hyp-PDT诱导的自噬改变可能与PI3K-Akt通路有关[12]。
综上所述,Hyp-PDT可能通过抑制Akt磷酸化,减少K562自噬,促进细胞死亡,起到杀伤白血病肿瘤细胞的作用。

