SCFAs对肠道免疫稳态及肿瘤发生发展的影响①
陶嫦立 刘功良
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广州 510006)
癌症通常被认为是获得性体细胞突变和环境因素的疾病。最近,肠道微生物群已经成为影响宿主病理生理学的环境因素。肠道微生物群是一个复杂的微生物生态系统,与其保持互利关系对人类健康至关重要[1]。肠道微生物群受多种因素的影响,包括遗传学、宿主生理学(宿主年龄、疾病、压力等)和环境因素如生活条件和药物的使用等。饮食越来越被认为是调节胃肠道微生物群组成和代谢功能的关键环境因素。研究证实补充特定的饮食成分如膳食纤维,是调节肠道微生物群的重要途径[2]。膳食纤维经过肠道微生物发酵产生的短链脂肪酸(short chain fatty acid,SCFAs)不仅是肠道微生物本身的重要能量来源,也是结肠上皮细胞的重要能量来源。此外,SCFAs还具有多种调节功能,包括对宿主生理和免疫的调节[3,4],并且也会影响肿瘤的发生发展以及治疗[5]。在这篇综述中,我们描述了肠道微生物群发酵膳食纤维所产生的代谢产物SCFAs在肠道免疫调节中的作用以及对肿瘤的产生、发展及治疗的影响。
1 SCFAs可由膳食纤维经肠道微生物群发酵产生
SCFAs是由既不被宿主消化也不被吸收的膳食纤维经胃肠道中的微生物发酵产生,包括乙酸盐,丙酸盐和丁酸盐,以及气体(H2和CO2);其浓度(可以是20~140 mmol/L)取决于肠内微生物群组成、肠转运时间、SCFAs的宿主-微生物群代谢流量以及宿主饮食中的纤维含量[6]。
在SCFAs中,丁酸盐是结肠细胞和肠细胞的关键能量来源。丙酸也可通过肠道葡萄糖异生(IGN)转化为葡萄糖而被局部利用或扩散入门静脉以作为肝糖异生的底物[7],剩下90%至99%的SCFAs被肠道吸收或被微生物群所利用。然而,少量SCFAs(主要是丙酸盐和乙酸盐)可到达血液循环,直接影响脂肪组织、脑和肝脏[8]。因此,SCFAs可影响胃肠道上皮细胞完整性,葡萄糖体内平衡,脂质代谢,食欲调节和免疫功能。
2 SCFAs调节肠道微生物群
肠道微生物对膳食纤维的发酵取决于纤维的生理生化性质和纤维剂量以及宿主肠道微生物群落组成情况。许多分类群中的数百种肠道微生物拥有碳水化合物的结合模块和一套广泛的酶,包括糖苷水解酶,糖基转移酶,多糖裂解酶和碳水化合物酯酶,可以使多种纤维水解[9]。因此,与缺乏膳食纤维的精制饮食相比,具有各种膳食纤维的饮食拥有更多样的肠道微生物群落[10]。
SCFAs被肠道吸收或被微生物群利用后,一方面可以促进有益微生物增殖,例如,果聚糖的摄入会导致丁酸盐浓度增加,然而发酵果聚糖的主要微生物双歧杆菌和乳酸杆菌并不直接产生丁酸盐,而是产生乳酸盐和乙酸盐,可能原因是,发酵果聚糖细菌产生的乳酸盐和乙酸盐以能源物质被许多其他微生物利用,包括细菌,蔷薇属和粪杆菌等,从而促进了这些细菌的增长及其代谢产物丁酸盐的增加。即肠道微生物通过利用其他微生物社区成员的代谢产物,间接刺激社区内其他微生物的增长[11]。因此,SCFAs通过这种交互共生的方式可以改变肠道内微生物群结构。另一方面SCFAs通过降低肠道pH 抑制大肠杆菌和沙门氏菌等病原微生物的生长、减少有毒发酵产物的形成,进而改善肠道微生物群结构[3]。例如正常人类结肠pH值介于5.5和7.5之间。 利用人粪便样品来模拟结肠的体外发酵实验显示,pH从6.5降低至5.5会显著改变微生物群落,这是由于酸性条件能更好地支持生产丁酸盐的厚壁菌如罗斯氏菌属(Roseburia spp)的生长,同时减少酸敏感型拟杆菌属的增殖[12]。
3 SCFAs调节宿主肠道免疫
肠道免疫系统必须始终保持对共生微生物的耐受性和对致病微生物的免疫力之间的微妙平衡。而SCFAs通过作用于肠道上皮细胞和免疫细胞影响炎症因子释放、免疫趋化反应、抑制免疫效应细胞增殖等参与肠道内免疫调节[1],影响了促炎和抗炎机制之间的平衡,在肠道抵御致病菌中起重要作用(图1)。
3.1SCFAs调节肠道上皮屏障功能 SCFAs以高浓度水平存在于肠腔中,除了作为结肠细胞的主要能量之外,SCFAs可诱导肠上皮细胞分泌抗菌肽、黏蛋白,促进肠上皮紧密连接以及促进B细胞分泌IgA至黏液层等作用维持肠道黏膜屏障的完整性[13]。有研究称[14],丁酸盐可增加LL-37和CAP-18等抗菌肽的表达和调节细胞因子(CCL20和IL-8)的产生来增强肠上皮细胞的一些免疫监视功能。另有研究显示[15],补充SCFAs上调了杯状细胞中黏蛋白基因的表达,从而分泌更多的黏液蛋白以保持黏膜免疫。另外,SCFAs可促进稳态下肠上皮细胞密连接蛋白的表达,有研究显示[16],长双歧杆菌菌株定殖肠道后产生高水平的乙酸盐,可以抗肠致病性大肠杆菌O157:H7的感染,表明SCFAs在感染期间或肠屏障破坏后可增强抗微生物反应,减少肠道微生物和肠道微生物代谢产物的转运。最近一项研究显示[17],SCFAs直接激活B细胞中的mTOR途径,导致葡萄糖摄取和糖酵解活性增加,最终导致B细胞分化为分泌抗体的浆细胞,诱导B细胞产生IgA。综上所述,SCFAs可通过增强肠道上皮细胞屏障功能来维持黏膜免疫。
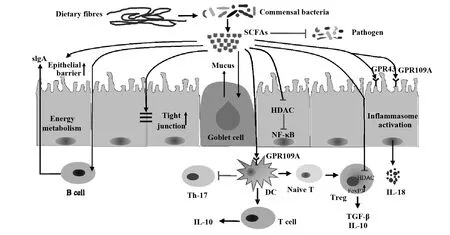
图1 SCFAs的产生及其在肠道中的免疫调节作用Fig.1 Generation of SCFAs and its immune-modulating effects in intestinal tract
3.2SCFAs与其受体GPCR相互作用介导肠道免疫 SCFAs的许多调节效应是通过与G 蛋白偶联受体(G protein-coupled receptor,GPCR)相互作用介导的。包括GPR43(也称为FFAR2 )、GPR41(也称为FFAR3 )、GPR109A(也称为HCAR2 )和Olfr78,其中GPR43、GPR41和GPR109A可差异表达于许多类型细胞表面,包括肠上皮细胞、巨噬细胞和树突状细胞等免疫细胞[18],参与肠道内分泌和免疫等功能的调节。有研究显示[19],SCFAs可与巨噬细胞或树突状细胞表达的GPR43和GPR109A相互作用,调节调节性T细胞(Treg)的增殖和功能。这是因为丁酸盐通过靶向GPR109A 信号通路促进了结肠巨噬细胞和树突状细胞的表达,一方面抑制炎症细胞Th17 的表达,另一方面诱导 Treg细胞和分泌IL-10的T细胞的分化,预防结肠炎和结肠癌的发生。最近有研究表明[20],高纤维饮食诱导小鼠肠上皮细胞上的GPR43和GPR109A的活化并激活NLRP3炎症小体,激活下游IL-18的生成,后者促进上皮修复和抑制结肠炎的发展。但是也有研究发现,在炎症初期SCFAs激活肠上皮细胞表面的GPR41和GPR43,进而激活丝裂原活化蛋白激酶的信号传导,促进趋化因子和细胞因子的快速产生,增强免疫应答[21]。这种保护性免疫反应帮助机体快速清除病原,缩短炎症反应时间。这些研究均表明,SCFAs与GPCRs相互作用在不同肠内免疫环境下对肠道免疫起双向调节作用,最终抑制炎症的发展,维持肠道稳态。
3.3SCFAs作为HDAC抑制剂介导肠道免疫 SCFAs可作为组蛋白去乙酰酶(HDAC)抑制剂,能促进耐受性及抗炎症细胞的分化和增殖,这对维持免疫稳态至关重要。由于肠内腔中细菌密度和发酵最高,致使肠腔中的结肠细胞处于高浓度的SCFAs中,特别是当丁酸盐浓度超过细胞的氧化代谢能力时,较高水平的丁酸盐在肠腔结肠细胞核中积累,通过充当HDAC抑制剂抑制了结肠细胞增殖。然而对于隐窝底部的结肠干细胞,由于丁酸盐向隐窝的扩散受到杯状细胞产生的黏液向上流动的阻碍,致使隐窝丁酸盐浓度较低,从而减轻了HDAC的抑制作用,促进了结肠干细胞增殖以维持体内平衡效应[22]。这些研究表明作为HDAC抑制剂的丁酸盐可以在细胞和特定的环境中诱导不同的效果。有研究显示丁酸盐通过HDAC抑制作用抑制固有层巨噬细胞中促炎细胞因子的产生以及抑制骨髓前体细胞向树突状细胞的分化[23],最终使肠道免疫系统对产生丁酸盐的有益细菌耐受。此外,有研究表明,SCFAs以HDAC依赖的方式影响Treg细胞群,一方面,在DC、IL-2和TGF-β存在时,丁酸盐介导的HDAC抑制作用可激活FOXP3的表达,促使幼稚T细胞分化为Treg细胞[24];另一方面,可增加FOXP3+Treg细胞的数量及其在稳态条件下的抑制功能。例如,有研究将小鼠置于高纤维或添加SCFAs的饮食中,结果显示SCFAs不仅抑制了结肠炎症,还通过HDAC抑制作用增强FOXP3+Treg细胞的活性来抑制过敏性气道疾病[25]。
4 SCFAs影响肿瘤的发生、发展
现在人们认识到各种类型的炎症会增加癌症发病率,如结肠炎、肥胖症、感染和自身免疫疾病,而丁酸盐和其他SCFAs抗肿瘤作用的研究在近年来非常活跃。早期体外细胞系数据提出SCFAs通过抑制HDAC活性,导致许多致癌信号通路失活,最终抑制肿瘤细胞的生长[23]。然而,现在越来越多的体内实验证据表明SCFAs的抑癌作用部分是由SCFAs受体介导的[26]。最近一项研究表明缺乏SCFAs受体GPR43的小鼠在启动适当的急性免疫反应以促进屏障免疫方面存在缺陷,并且在上皮损伤后发展成不受控制的慢性炎症反应。此外,经偶氮甲烷(AOM)处理10周后,GPR43缺陷小鼠的结肠相比于野生型(WT)小鼠的结肠有更多的息肉和更大的腺瘤。这些结果强调SCFAs与其受体GPR43的相互作用可以促进免疫屏障作用,抑制慢性炎症反应以及结肠癌的发展[19]。另一份最新报告发现TS4/APC基因突变的息肉病小鼠产丁酸盐细菌的数量减少,而在食物中添加了膳食纤维后,息肉病小鼠会增加产丁酸盐的细菌和丁酸盐的量,同时减少息肉的数量。这是由于丁酸盐的增加使得巨噬细胞和DC表面的 GPR109A被激活,从而导致这些细胞分化成Treg细胞和产生IL-10的T细胞,进而减少了结肠息肉以及预防了肿瘤的发生[27]。类似的现象在乳腺肿瘤中也被观察到[28],研究发现,在乳腺肿瘤中GPR109A 表达缺失,若异位表达GPR109A,可以降低乳腺肿瘤细胞内的cAMP 的浓度,增加肿瘤细胞的凋亡,减少肿瘤细胞的定植和生长。丁酸盐的另一种潜在抗肿瘤作用是,通过削弱ERK1/2和Akt炎症信号通路的磷酸化作用,抑制肿瘤细胞系体内和体外CCL2的产生。由于CCL2通过募集肿瘤相关巨噬细胞参与肿瘤的进展和转移,SCFAs可能会抑制这一过程[29]。最后,已经证明丁酸盐与DNA甲基转移酶抑制剂5-氮杂胞苷结合会减少乳腺癌干细胞的生长,这表明使用益生菌来富集产丁酸盐的微生物或增加膳食纤维消耗可能对某些类型的癌症有保护作用[30]。
然而在生物失调、胆汁淤积和炎症的情况下,大量丁酸盐的产生反而会创造一种促进肿瘤的微环境,Janssen等[31]报告称,给小鼠喂食瓜尔胶(一种由甘露糖[β1,4-连接]和半乳糖[α1,6-连接]组成的可溶性纤维)持续18周,可以保护小鼠免受饮食诱导的肥胖,但最终却导致了肝脏炎症和纤维化。Singh等[32]研究称,在给予缺失鞭毛蛋白受体TLR5并因此引起肠道微生物群严重失调的基因敲除小鼠(T5KO)喂食可溶性膳食纤维持续6个月后,结果导致约40%的T5KO小鼠引发黄疸性肝癌。这一发现与“丁酸悖论(butyrate paradox)”相一致,后者认为SCFAs促进或阻止细胞增殖的能力取决于细胞类型、时间和暴露量[33]。超过宿主可耐受阈值的SCFAs剂量已经显示会加重结肠炎症和肿瘤发生,诱发尿道炎和肾积水,并通过加剧肝脏脂肪生成和过度进食来促进肥胖[9,34-37]。因此如果肠道微生物群功能失调,摄入可溶性纤维可能对肝脏不利。总之,当考虑SCFAs对癌症的影响时,应该综合考虑其遗传背景,细胞能量学和环境背景(即细胞的炎症、干细胞样特征和宿主的饮食)等因素。
5 SCFAs间接影响肿瘤的治疗
越来越多证据表明,宿主微生物群影响肿瘤的干预效果并在预测患者的治疗反应中起重要作用。最近在德克萨斯大学MD Anderson癌症中心进行的一项队列研究中[38],从采用抗PD-1抗体治疗前后的112名转移性黑色素瘤患者中收集粪便样本,并分析肠道菌群的多样性和组成与临床反应之间的相关性,发现对治疗有积极响应的患者中微生物群的多样性远远高于无响应者,导致微生物群高度多样性的患者比中度或低度多样性的患者有更长的生存率(PFS)。肠道微生物组成及丰度的不同,可以促发不同的局部免疫应答,进而影响肿瘤的发生发展;同时,癌症治疗过程中,不同的治疗方法也可能改变肠道菌群的组成,而肠道菌群又会反过来影响各种疗法的效果。利用益生菌或益生元改变肠道菌群的组成可能是提高肿瘤疗效未来值得关注的方面。膳食纤维饮食可以影响肠道微生物群,进而通过改变肠道微生物种类控制肿瘤的可能性[18,27]。一项Ⅱ期临床试验表明[39],晚期肠癌患者在化疗的同时联合服用富含低聚果糖的菊粉能够增强化疗效果。最近一项研究结果表明[40],丁酸盐与化疗药物联合使用对大肠癌的治疗有重要作用:一方面,丁酸盐和伊立替康在三种癌细胞系中协同作用,并抑制异种移植模型中的肿瘤生长;另一方面,还发现丁酸盐能够降低伊立替康的毒性和发病率,并提高对伊立替康化疗的耐受性。
6 小结
高膳食纤维食物可维持肠道微生物的正常结构和代谢,其中代谢物SCFAs特别是丁酸盐在维持肠道内免疫环境稳定和肠道上皮细胞健康方面发挥着重要作用。SCFAs作为HDAC抑制剂和纤维发酵的产物,可以通过多种机制介导膳食纤维对肿瘤的保护作用。近年来,关于饮食因素、肠道微生物和代谢物之间相互作用越来越被认为对宿主生理特别是免疫功能以及肿瘤发生发展有着深远的影响。然而,许多未知的问题仍然存在,而更好地理解SCFAs在预防和治疗肿瘤时所诱导的分子机制和信号通路将有助于开发新的治疗手段来预防和治疗肿瘤。

