沉默GDF15基因表达对高糖诱导的肾小管上皮细胞凋亡和氧化应激的影响
郭海燕,邢志华,王丽丽,解菊芬
1)山西医科大学汾阳学院临床系内科学教研室 山西汾阳 032200 2)山西省汾阳医院内分泌科 山西汾阳 032200 3)山西省汾阳医院血液内科 山西汾阳 032200
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的主要微血管并发症,严重威胁患者生命健康。研究[1]显示,高糖可诱导肾小管上皮细胞凋亡和氧化损伤,这也是DN发生发展的机制之一。因此,抑制肾小管上皮细胞凋亡和氧化应激对于治疗DN或延缓DN发展具有重要意义。生长分化因子15(growth differentiation factor 15,GDF15)是一个分泌蛋白,属于转化生长因子β家族成员,参与心脑血管疾病、肿瘤等的发生发展[2-3]。有研究[4]显示,GDF15可能通过上调磷酸化的丝氨酸/苏氨酸蛋白激酶B的表达,拮抗过氧化氢(H2O2)诱导的内皮细胞凋亡。姚新丰[5]报道称,GDF15在DN患者血清中表达升高,诊断DN的敏感度为82.2%,特异度为70.2%,可作为诊断DN的生物学指标。但目前,GDF15基因对肾小管上皮细胞凋亡和氧化应激的影响还未知。本研究首先检测了DN患者肾组织中GDF15蛋白表达水平,然后以人肾小管上皮细胞HK-2为研究对象,探讨了沉默GDF15基因表达对高糖诱导的HK-2细胞凋亡和氧化应激的影响,以期为DN的分子靶向治疗提供一定的思路。
1 对象与方法
1.1研究对象选取2017年12月至2018年5月于山西省汾阳医院肾内科住院并行肾活检确诊的16例DN患者为研究对象,其中男5例,女11例,年龄39~67(53.5±5.9)岁。以同期16例手术治疗的肾癌患者的癌旁正常组织为对照,其中男9例,女7例,年龄42~69(56.3±7.5)岁。本研究经医院伦理委员会批准同意,患者自愿签署知情同意书。
1.2细胞和实验试剂人肾小管上皮细胞株HK-2(中国科学院上海细胞库),胎牛血清(FBS)和低糖DMEM培养基(美国Gibco公司),四甲基噻唑蓝(MTT)和胰蛋白酶(美国Sigma公司),Lipofectamine 2000试剂盒(美国Invitrogen公司),膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒、二喹啉甲酸(bicinchoninicacid,BCA)蛋白检测试剂盒和2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA)探针(上海碧云天生物技术有限公司),兔抗人Bcl-2、Bax和GDF15多克隆抗体(美国Santa Cruz公司),兔抗人Nrf2和血红素加氧酶-1(heme oxygenase-1,HO-1)多克隆抗体(美国Abcam公司),GDF15的小干扰RNA及乱序无义阴性序列(上海吉玛制药技术有限公司),活性氧簇(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(南京建成生物工程研究所)。
1.3实验方法
1.3.1 细胞培养 复苏HK-2细胞,加入含体积分数10%FBS的DMEM培养基,于2.5 cm2细胞培养瓶中,置于37 ℃、体积分数5 %CO2、97 %湿度的培养箱中培养。每2~3 d更换一次新鲜培养基。当细胞生长融合至80%左右时,吸弃培养基。加入PBS清洗细胞后,加入2.5 g/L胰蛋白酶溶液消化,传代培养。
1.3.2 细胞转染及效果评价 对数生长期的HK-2细胞接种于6孔细胞培养板中,每孔1×105个。当细胞融合至60%时,参照Lipofectamine 2000试剂盒操作说明,分别将GDF15的小干扰RNA(si-GDF15组)及乱序无义阴性序列(si-NC组)转染至HK-2细胞。转染12 h后,更换新鲜培养基,继续培养48 h,收集细胞。Western blot法检测两组细胞中GDF15蛋白水平,评价转染效果。
1.3.3 细胞分组及处理 将HK-2细胞接种于24孔细胞培养板中,每孔1×104个,分为对照组(细胞正常培养48 h)、高糖组(用含25 mmol/L[6]葡萄糖的DMEM培养基作用48 h)、si-GDF15+高糖组和si-NC+高糖组(转染si-GDF15和si-NC的细胞均用含25 mmol/L葡萄糖的DMEM培养基培养,转染后继续培养48 h)。每组均设9个复孔。
1.3.4 Western blot法检测各组组织和细胞中GDF15蛋白表达 细胞分组和处理同1.3.3。细胞培养结束后,吸弃培养基,胰蛋白酶消化收集细胞。RIPA蛋白裂解液提取组织和各组细胞中总蛋白,BCA法对蛋白进行定量。取适量蛋白,100 ℃煮沸5 min,变性后,每孔30 μg上样行PAGE电泳。电泳后,湿转至聚偏乙烯二氟膜,于50 g/L脱脂牛奶液中封闭2 h。加入GDF15抗体(按1∶600稀释),4 ℃孵育过夜。洗膜后,加入辣根过氧化酶标记的二抗(按1∶200稀释),37 ℃孵育1 h。洗膜后,加入ECL,避光显影,凝胶成像系统曝光拍照。以GAPDH为内参,用Image J软件分析蛋白条带灰度值。
1.3.5 流式细胞术检测各组细胞凋亡率 细胞分组和处理同1.3.3。PBS清洗细胞,加入适量2.5 g/L胰蛋白酶消化,收集细胞。取1.0×106个细胞,PBS清洗后,加入400 μL结合缓冲液轻轻吹打;加入10 μL Annexin V-FITC,避光孵育10 min;加入5 μL PI室温孵育5 min;再加入100 μL结合缓冲液,混匀后上流式细胞仪检测细胞凋亡。
1.3.6 各组细胞内ROS含量检测 细胞分组和处理同1.3.3。细胞培养结束后,按照ROS试剂盒说明书,吸弃培养基,加入按1∶500稀释后的DCFH-DA,37 ℃孵育40 min;用无血清培养基清洗细胞3次,胰蛋白酶消化,PBS清洗。PBS重悬细胞,用多功能酶标仪检测(激发波长488 nm,发射波长525 nm)ROS含量。
1.3.7 各组细胞内MDA、SOD和GSH-Px水平检测细胞分组和处理同1.3.3。细胞培养结束后,用胰蛋白酶消化,PBS清洗、收集。用细胞裂解液裂解细胞,保留上清液,分别参照MDA、SOD和GSH-Px试剂盒说明书检测上清中MDA、SOD和GSH-Px水平。
1.3.8 各组细胞中Bcl-2、Bax、Nrf2和HO-1蛋白表达的Western blot法检测 细胞分组和处理同1.3.3。检测方法同1.3.4。其中Bcl-2抗体按1∶400稀释,Bax抗体按1∶400稀释,Nrf2抗体按1∶600稀释,HO-1抗体按1∶600稀释。
1.4统计学处理采用Excel和PEMS 3.2进行数据分析。应用两独立样本t检验比较正常肾组织和DN患者肾组织中GDF15蛋白表达的差异,应用单因素方差分析和SNK-q检验比较各组细胞凋亡率、各组细胞中GDF15、Bcl-2、Bax、Nrf2和HO-1蛋白表达以及ROS含量、MDA、SOD和GSH-Px水平的差异。检验水准α=0.05。
2 结果
2.1正常肾组织和DN患者肾组织中GDF15蛋白表达的比较见图1。与正常肾组织(0.45±0.04)比较,DN患者肾组织(0.81±0.07)中GDF15蛋白表达水平升高(t=17.861,P<0.001)。

1:正常肾组织;2:DN患者肾组织
2.2高糖对HK-2细胞GDF15蛋白表达的影响见图2。与对照组(0.43±0.02)比较,高糖组HK-2细胞(0.87±0.05)中GDF15蛋白表达水平升高(t=24.512,P<0.001)。

1:对照组;2:高糖组
2.3GDF15小干扰RNA转染效果验证结果见图3。与si-NC组(0.45±0.05)比较,si-GDF15组(0.19±0.03)HK-2细胞中GDF15蛋白表达水平降低(t=13.377,P<0.001)。
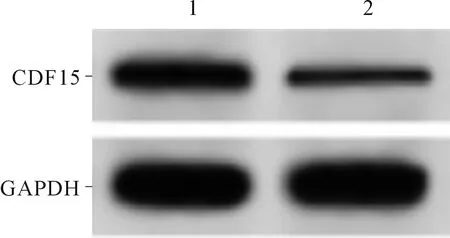
1:si-NC组;2:si-GDF15组
2.4沉默GDF15表达对高糖诱导的HK-2细胞凋亡的影响见图4。高糖组HK-2细胞凋亡率高于对照组(P<0.05)。si-GDF15+高糖组HK-2细胞凋亡率低于si-NC+高糖组(P<0.05)。高糖组与si-NC+高糖组细胞凋亡率比较差异无统计学意义(P>0.05)。
2.5沉默GDF15表达对高糖诱导的HK-2细胞氧化应激的影响见表1。由表1可知,与对照组比较,高糖组和si-NC+高糖组MDA和ROS水平升高(P<0.05),SOD和GSH-Px水平降低(P<0.05)。与si-NC+高糖组比较,si-GDF15+高糖组MDA和ROS水平降低(P<0.05),SOD和GSH-Px水平升高(P<0.05)。高糖组与si-NC+高糖组比较,各检测指标差异无统计学意义(P>0.05)。

1:对照组;2:高糖组;3:si-NC+高糖组;4:si-GDF15+高糖组。*:与对照组比较,P<0.05;#:与si-NC+高糖组比较,P<0.05
图4 沉默GDF15表达对高糖诱导的HK-2细胞凋亡率的影响
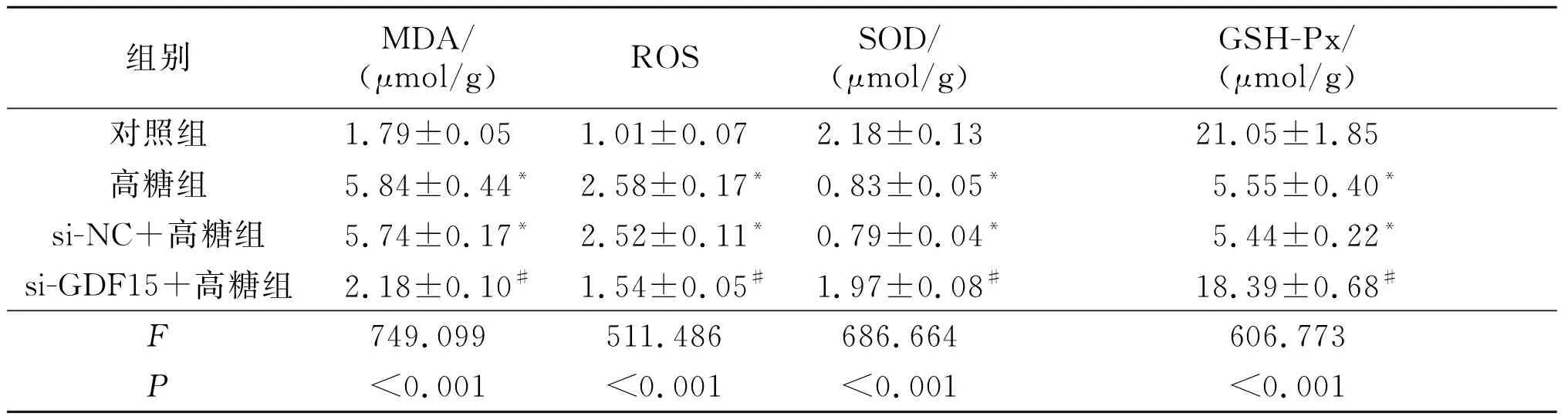
表1 各组HK-2细胞中MDA、ROS、SOD和GSH-Px水平的变化(n=9)
*:与对照组比较,P<0.05; #:与si-NC+高糖组比较,P<0.05
2.6沉默GDF15表达对高糖诱导的HK-2细胞凋亡相关蛋白表达的影响见图5和表2。高糖组和si-NC+高糖组HK-2细胞中Bax蛋白水平高于对照组(P<0.05),Bcl-2蛋白水平低于对照组(P<0.05)。si-GDF15+高糖组HK-2细胞中Bax蛋白水平低于si-NC+高糖组(P<0.05),Bcl-2蛋白水平高于si-NC+高糖组(P<0.05)。高糖组与si-NC+高糖组Bax和Bcl-2蛋白水平比较差异无统计学意义(P>0.05)。

1:对照组;2:高糖组;3:si-NC+高糖组;4:si-GDF15+高糖组

图5 沉默GDF15对高糖诱导的HK-2细胞中Bax和Bcl-2蛋白表达影响
*:与对照组比较,P<0.05; #:与si-NC+高糖组比较,P<0.05
2.7沉默GDF15表达对高糖诱导的HK-2细胞Nrf2/HO-1信号通路相关蛋白表达的影响见图6和表3。高糖组和si-NC+高糖组细胞质Nrf2蛋白水平低于对照组(P<0.05),HO-1和细胞核Nrf2蛋白水平高于对照组(P<0.05)。si-GDF15+高糖组HO-1和细胞核Nrf2蛋白水平高于si-NC+高糖组(P<0.05),细胞质Nrf2蛋白水平低于si-NC+高糖组(P<0.05)。高糖组与si-NC+高糖组HO-1和细胞核Nrf2蛋白水平比较,差异无统计学意义(P>0.05)。

1:对照组;2:高糖组;3:si-NC+高糖组;4:si-GDF15+高糖组
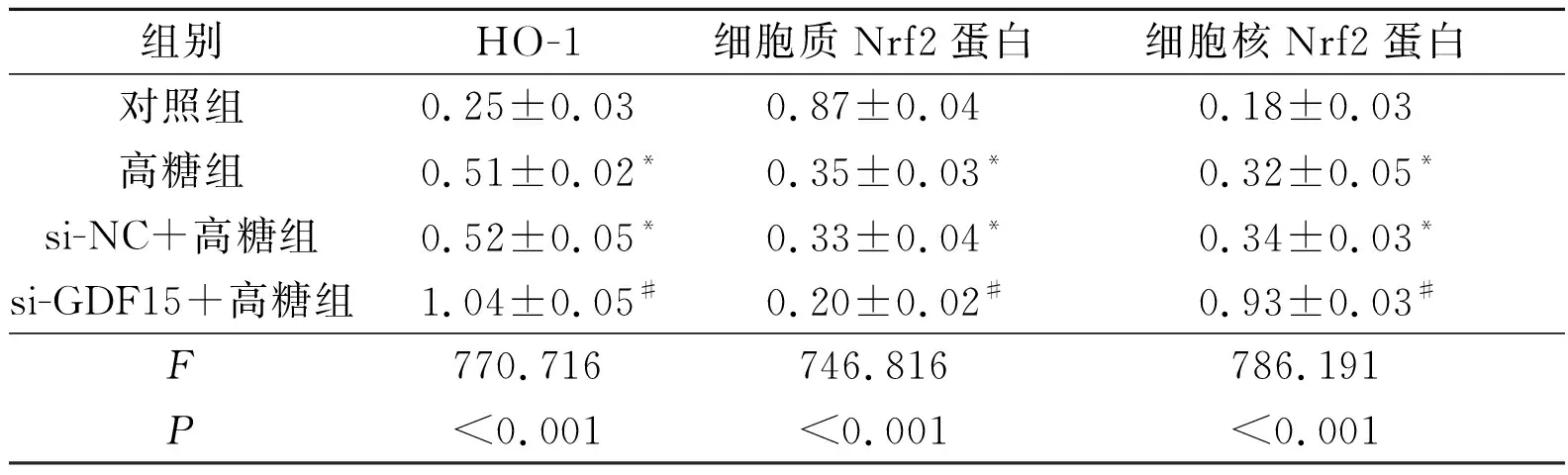
图6 沉默GDF15对高糖诱导的HK-2细胞Nrf2和HO-1蛋白表达的影响
*:与对照组比较,P<0.05; #:与si-NC+高糖组比较,P<0.05
3 讨论
随着人们饮食习惯的改变,糖尿病的发病率呈现增长的趋势,DN作为糖尿病的常见并发症被广泛关注。肾小管上皮细胞是肾脏的固有细胞之一,在葡萄糖、炎性因子、缺氧等因素诱导时会产生氧化应激和凋亡,最终导致肾小管间质纤维化,严重时导致肾功能衰竭[7]。因此,肾小管上皮细胞的凋亡和氧化应激与DN的发生发展密切相关。
GDF15是一种应激反应蛋白,参与调控细胞凋亡[8]。研究[9]显示,GDF15在DN患者血清中的水平明显高于单独糖尿病人群和健康人群,是影响DN的独立危险因素。目前,还未见GDF15影响肾小管上皮细胞凋亡和氧化应激的相关报道。本研究首先检测了DN患者肾组织中GDF15蛋白表达水平,结果显示,GDF15蛋白在DN患者肾组织中呈高表达,提示GDF15可能参与DN的发生发展。进一步使用高糖诱导人肾小管上皮细胞HK-2后,细胞中GDF15蛋白表达水平升高;通过转染GDF15小干扰RNA沉默GDF15表达后,高糖诱导的HK-2细胞凋亡率和Bax蛋白水平明显降低,Bcl-2蛋白水平明显升高,提示沉默GDF15基因表达可能通过调控Bax/Bcl-2蛋白表达抑制高糖诱导的HK-2细胞凋亡。
高糖环境下,肾小球细胞内氧化作用增强,抗氧化与氧化平衡被打破,细胞内产生大量ROS[10]。ROS进一步造成细胞膜脂质过氧化,损伤细胞膜。MDA是脂质过氧化产物之一,可间接反映脂质过氧化水平[11]。SOD是机体内重要的抗氧化酶,可清除氧自由基,保护机体免受氧化损伤。GSH-Px也是一种抗氧化酶,可与SOD协同作用,减少活性氧自由基的产生,防止脂质过氧化及其中间代谢产物对机体的损害,维持体内的氧化和抗氧化平衡[12]。本研究显示,高糖处理后HK-2细胞ROS和MDA水平升高,SOD和GSH-Px水平降低,说明高糖诱导HK-2细胞产生了氧化应激反应。沉默GDF15基因表达后,高糖诱导的HK-2细胞ROS和MDA水平降低,SOD和GSH-Px水平升高,提示沉默GDF15基因可减轻高糖诱导的HK-2细胞内氧化应激反应,保护细胞免受氧化损伤。
Nrf2/HO-1信号通路在细胞氧化应激和凋亡中发挥重要作用,是机体内重要的抗氧化信号通路[13]。正常生理条件下,Nrf2与其抑制蛋白Keap1在细胞质中形成复合物。当受到氧化应激刺激时,Nrf2磷酸化与Keap1发生解离,并转移至细胞核,进而启动HO-1基因的转录,发挥抗氧化作用,保护细胞免受氧化损伤[14]。本研究显示,沉默GDF15基因表达后,高糖诱导的HK-2细胞HO-1和细胞核Nrf2蛋白水平明显升高,细胞质Nrf2蛋白水平明显降低,提示沉默GDF15基因表达可激活Nrf2/HO-1信号通路,减轻高糖诱导的HK-2细胞氧化应激等损伤。
综上所述,高糖可促进人肾小管上皮细胞HK-2中GDF15表达,沉默GDF15基因表达可减少高糖诱导的HK-2细胞凋亡、减轻氧化应激,其可能通过激活Nrf2/HO-1信号通路,保护HK-2细胞免受损伤,为DN的靶向分子治疗提供了新思路。

