分层斑点追踪评估小鼠心衰模型左心室内、外膜下心肌力学改变*
王 冠,王 莹,阮 磊,吴晓芬,张存泰△
华中科技大学同济医学院附属同济医院 1综合科 2病理科,武汉 430030
心力衰竭(heart failure,HF)往往提示心血管疾病的最后阶段,死亡率及致残率高,为公共卫生系统带来了巨大负担[1]。小鼠作为心血管疾病常用模型,探讨其心衰模型的特点无疑为我们防治该疾病提供了可能。速度向量成像技术(velocity vector imaging,VVI)以斑点追踪为原理,通过逐帧扫描感兴趣区域心动周期内的位移,进而测算出运动速度、应变及应变率等指标,为探索心脏心肌力学改变提供了新方法[2]。本研究应用分层斑点追踪(layer specific-speckle tracking echocardiography,LS-STE)技术观察压力超负荷所致心衰小鼠左心室内、外膜下的心肌力学改变,及其与心肌纤维化的关系。
1 材料与方法
1.1 实验材料和分组
选择8周龄,体重18~24 g的雄性C57BL/6小鼠23只,随机分为手术组和假手术组,手术组13只小鼠,假手术组10只小鼠。上述动物均购于华中科技大学同济医学院实验动物中心,所有实验方案均经华中科技大学同济医院伦理委员会批准。
1.2 小鼠心衰模型的建立
依照经典文献[3],手术组小鼠通过戊巴比妥钠(80 mg/kg)腹腔麻醉,当小鼠完全麻醉后置于37℃恒温加热板上,随后在左胸第1肋间隙上行胸廓切开术,暴露主动脉弓,在小鼠无名动脉及左颈总动脉处放置28号针头,用7-0缝线结扎,随后快速拔走针头,造成主动脉狭窄,然后逐层关闭胸壁。假手术组除未用缝线结扎外其余手术步骤与手术组相同。
1.3 超声心动图采集数据
用3%异氟烷吸入诱导麻醉小鼠,待翻正反射消失后,维持异氟烷浓度1%~2%继续麻醉小鼠,使小鼠既能配合实验,同时心率在420次/min以上,以避免麻醉对心功能的抑制。小鼠麻醉后置于加热板上,维持体温为37℃,随后胸部脱毛,应用Vevo2100小动物超声仪及配备的MS-400探头(采样频率>30 MHz),B-mode和M-Mode下采集胸骨旁左室长轴切面及左室短轴切面图像,然后分别测量计算出左室后壁厚度(LVPWT)、左室舒张期末内直径(LVEDD)、左室收缩期末内直径(LVESD)、左室重量和左室短轴缩短率(FS)等指标。
选择心室内外膜边界清晰的左室短轴切面和长轴切面图像导入VevoStrain定量分析软件,手动描绘心室内外膜。描绘过程中越过乳头肌及肌小梁等结构。描绘结束后仪器自动将心室划分为固定节段,随后通过模式匹配,自动逐帧地追踪心动周期中各节段心室内外膜的形变和时程,进而测算出心室各个节段内外膜的应变、室壁最大达峰延迟时间(maximal opposite wall delay,MOWD)等指标(图1)。

A:分层斑点追踪在长轴切面测定内外膜各阶段应变及达峰时间;B:分层斑点追踪在短轴切面测定内外膜各阶段应变及达峰时间图1 分层斑点追踪应变成像Fig.1 Layer specific-speckle tracking strain echocardiography
1.4 统计学方法
2 结果
2.1 手术组心衰模型的建立
手术组13只小鼠明显表现出心衰特征,即昏睡、移动力减低、呼吸困难及水肿,其中2只小鼠在术后1周内死亡,1只在术后3周内死亡,术后第3周手术组存活10只,存活率为77%,假手术组的存活率为100%。3周后尸检结果和常规超声结果亦提示相比假手术组,手术组心脏重量和体重的比值(HW/BW)及肺脏重量和体重的比值(LW/BW)均明显增大,LVEDD、LVESD明显升高,LVPWT减低,FS明显下降,心室变薄(均P<0.05,图2、表1)。

图2 术后第3周小鼠心脏尸检结果Fig.2 Gross observation of hearts of mice three weeks after surgery
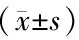
表1 各组术后第3周常规超声学参数比较Table 1 Comparison of conventional echocardiographic parameters three weeks after surgery
与假手术组比较,*P<0.05
2.2 手术组和假手术组间内外膜速度向量成像参数比较
相比假手术组,手术组的MOWD表现为明显延长;应变值也表现为内外膜纵向、环向应变及径向应变值显著低于假手术组(均P<0.05,表2,3)。
2.3 手术组和假手术组内外膜速度向量成像参数的梯度差异
假手术组及手术组在环向及纵向均表现为内膜应变大于外膜应变;假手术组及手术组在环向及纵向均表现为内膜MOWD小于外膜MOWD(均P<0.05,表2,3)。
2.4 速度向量成像参数与心肌纤维化的相关性
手术组纤维化面积占左室总面积(1.74±0.15)%,明显高于假手术组的(0.29±0.07)%,差异有统计学意义(P<0.05)。根据组织病理切片(图3)所测得的内外膜纵向和环向应变与心肌纤维化程度显著相关(r=-0.85,-0.81,-0.88,-0.86,P<0.05,图4)。
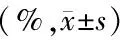
表2 比较术后第3周不同组之间及各组内的内、外膜下应变值Table 2 Comparison of endocardium and epicardium strain values between different groups and within each group three weeks after
与假手术组比较,*P<0.05;与内膜比较,#P<0.05

表3 比较术后第3周不同组之间及各组内的内、外膜达峰时间Table 3 Comparison of endocardium and epicardium maximal opposite wall delay between different groups and within each group three weeks after
与假手术组比较,*P<0.05;与内膜比较,#P<0.05
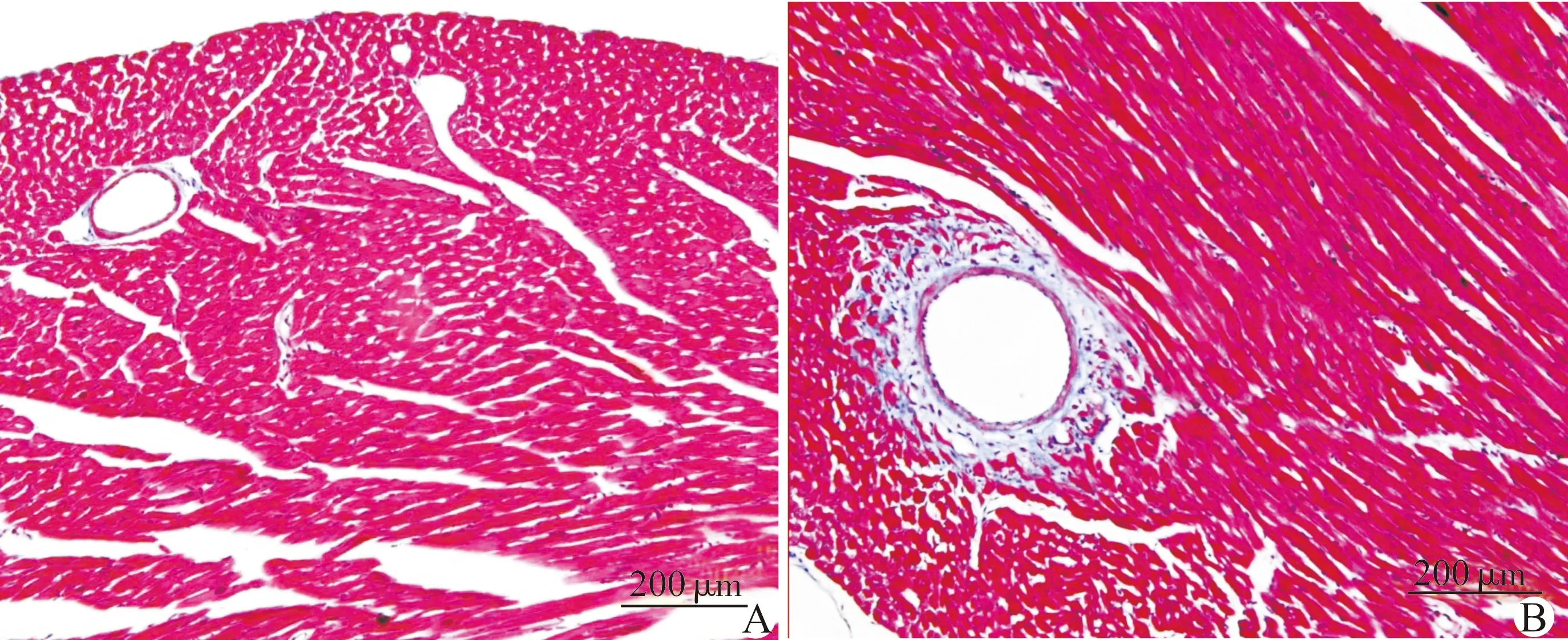
A:假手术组小鼠术后第3周心肌纤维化损伤;B:手术组小鼠术后第3周心肌纤维化损伤图3 术后第3周左室心肌纤维化(Masson-some染色法)Fig.3 Fibrotic lesion of left ventricle three weeks after surgery (Masson-some staining)
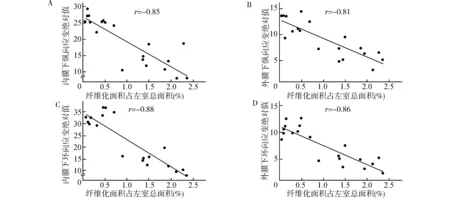
A:纤维化面积占左室总面积与内膜下纵向应变的相关性;B:纤维化面积占左室总面积与外膜下纵向应变的相关性;C:纤维化面积占左室总面积与内膜下环向应变的相关性;D:纤维化面积占左室总面积与外膜下环向应变的相关性图4 左室心肌纤维化程度与应变指标的相关性分析Fig.4 Correlation analysis between the fibrotic lesion of left ventricle and strain parameters
3 讨论
本文通过主动脉缩窄术复制压力后负荷增加所致的心力衰竭模型。术后1周,小鼠表现为精神差、移动力减低、昏睡等一系列症状。术后第3周,上述症状更为明显,常规M型超声提示心动周期中心室壁收缩明显减低。这无疑提示该模型可有效模拟病理状态下的心力衰竭。实际上既往多个研究也证实了上述造模方法的可靠性[4-5]。
研究表明心脏并不能看成是一个“合体”细胞。它的“泵”功能的实现包括内膜下右手螺旋形心肌、外膜下左手螺旋形心肌的纵向缩短以及中层心肌的环向增厚组成,这无疑提示心肌存在跨膜异质性,因此有必要分层研究心肌的力学特点[6-7]。我们的研究发现,无论是生理状态下还是病理状态下的小鼠,在纵向和环向均表现为内膜下应变明显高于外膜下应变。这与既往应用TDI技术或速度向量成像技术在人体的研究相符,说明对小鼠心肌分层行斑点追踪可有效评价心功能,小鼠模型可完美模拟人体心肌的力学特点,在小鼠模型得到的结果对临床有很好的借鉴意义[8-9]。我们发现小鼠心肌内膜应变高于外膜应变,内膜MOWD小于外膜MOWD。这是心室内外膜心肌力学差异性所致。具体来说,心动周期中心脏收缩主要以心内膜收缩为主导,外膜下心肌的收缩一方面依赖于心肌纤维本身,也一定程度依赖于内膜纤维等的牵拉效应,因此相比心外膜,心内膜形变更加显著,而达到最大形变程度所需时间较短[10]。其他课题组进一步分析内外膜单个心肌细胞收缩幅度也证明心内膜下单个心肌细胞收缩幅度更大,达峰更快,无疑从微观上证实了上述观点[11]。
随后我们发现心衰小鼠内外膜纵向、环向应变以及径向应变均低于对照组,这是由于小鼠心功能减低,收缩功能下降所致。而心衰小鼠内外膜MOWD表现为明显增大,提示各节段心肌的协同性减低,与心衰心肌凋亡坏死、心肌纤维化导致心肌排列杂乱无序、僵硬度增加有关。而Masson-some染色也证实心衰小鼠心肌中的胶原组织更多,提示纤维化程度更重,相关性分析则进一步证实分层速度向量成像所测指标与心肌纤维化密切相关。
综上,本研究表明心肌分层速度向量技术可评估小鼠生理及病理状态下的心肌力学特点,一方面为未来动物实验提供了参考值,也为探索心力衰竭机制提供了新的视角。该方法的局限性在于:①分层速度向量需较高的图像分辨率才能识别心肌内外膜,对超声设备要求较高,限制了其广泛应用;②该方法只能测定心肌二维平面内纵向、环向及径向运动,而心肌运动是三维过程,忽视了心肌二维平面外的运动。

