离子色谱-脉冲安培法同时测定食品中9种糖和糖醇的含量
(仙乐健康科技股份有限公司,广东汕头 515041)
糖类是食品中重要的功能组分,过高的糖分摄入不仅容易导致肥胖、龋齿、营养不良等问题,还会加速皮肤老化,同时还易诱发痛风、骨质疏松,增加罹患多种慢性疾病如高血压、糖尿病等疾病的风险[1-2]。世界卫生组织(WHO)于2015年发布了糖摄入量指南,建议在成人和儿童游离糖的摄入量应降至总能量摄入的10%以下[3-4]。近年来,随着生活水平和健康意识的不断提高,低糖、无糖食品越来越受到人们的认可和青睐。为了在减少糖的用量的基础上同时保持产品口感和风味,市面上许多无糖或低糖食品通常会添加麦芽糖醇、赤藓糖醇、木糖醇等糖醇类物质来替代蔗糖和淀粉糖(葡萄糖、麦芽糖等)。
低糖、无糖食品中糖类物质的检测普遍存在着含量低、样品基质复杂,且有大量的同分异构体和手性化合物同时存在的难题。因此,建立一种能同时分离、测定低糖、无糖食品中多种糖和糖醇类成分的检测方法意义重大。目前对于果糖、葡萄糖、乳糖、麦芽糖、蔗糖等常见单、双糖的检测方法主要有滴定法[5-6]、液相色谱-示差检测法(HPLC-RID)[7-9]、液相色谱-蒸发光散射检测法(HPLC-ELSD)[10-12]、液质联用法(LC-MS/MS)[13-15]、离子色谱法(IC)[16-18]等。滴定法操作步骤繁琐,前处理耗时较长,且结果误差较大,易受其他有色物质干扰。液相色谱-示差检测法灵敏度较低,检测器平衡时间长,基线噪声大且无法梯度洗脱。液相色谱-蒸发光散射检测法灵敏度较示差检测器略高,但仍难以达到无糖(糖含量≤0.5%)的检出限。液质联用法分析时间短,但与液相色谱法一样,均是采用氨基色谱柱进行分离,而市场上常见的氨基色谱柱均难以将麦芽糖醇与蔗糖、乳糖、麦芽糖完全分离开来。同时,由于许多常见的单糖和双糖都互为同分异构体(如葡萄糖和果糖、麦芽糖和乳糖等),产生的碎片离子大都相似,因此液质联用法也难以发挥其专属性高的优势。离子色谱法利用糖类物质在碱性条件下呈离子状态的特点,利用阴离子交换色谱柱进行分离,以氢氧化钠/醋酸钠为淋洗液梯度洗脱,能够完全分离常见的几种糖和糖醇;以安培检测器检测定量,灵敏度高,完全能够满足低糖甚至无糖产品中糖类成分的检测。
本文拟建立一种利用离子色谱-脉冲安培检测器同时分离、测定葡萄糖、果糖、蔗糖、麦芽糖、乳糖、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇的方法,该方法操作简便,专属性强,适用于低糖、无糖产品中糖类物质的检测。
1 材料与方法
1.1 材料与仪器
市售软糖1(无糖)、软糖2(低糖)、软糖3(低糖)、固体饮料1(低糖)、固体饮料2(低糖)、代餐粉(低糖)、能量棒(低糖) 均购自天猫旗舰店;葡萄糖、果糖、蔗糖、麦芽糖、乳糖标准品 中国食品药品检定研究院;赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇标准品,50%氢氧化钠溶液 美国Sigma公司;乙酸钠(HPLC级) 上海安谱实验科技股份有限公司。
ICS 5000+离子色谱仪(配四元梯度泵,脉冲安培检测器(金工作电极,Ag/AgCl参比电极),Chromenleon 7.2 SR5色谱工作站) 美国Thermo Fisher公司;CarboPac PA1保护柱(4 mm×50 mm),CarboPac PA1分析柱(4 mm×250 mm),On Guard RP净化柱(2.5 mL) 美国Thermo Fisher公司;XS205DU型分析天平 瑞士METTLER-TOLEDO公司;UNIVERSAL 320R型离心机 德国Hettich公司;DZKW-D-2型水浴锅 上海科恒实业发展有限公司;CASCADA I型超纯水机 美国PALL公司。
1.2 实验方法
1.2.1 标准溶液配制 精密称取葡萄糖、果糖、蔗糖、麦芽糖、乳糖、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇标准品各10 mg至100 mL容量瓶中,加水溶解并定容至刻度,摇匀,得到浓度为100 μg/mL的标准储备液(该溶液在4 ℃条件下可保存15 d)。精密吸取上述溶液适量,加水逐级稀释成浓度为0.1、0.5、1、5、10、50 μg/mL的溶液,作为标准系列工作液,溶液临用现配。
1.2.2 样品的处理及其溶液配制 取软糖样品和能量棒样品约30 g,冷冻粉碎,混合均匀后备用;取固体饮料和代餐粉样品5袋,混合均匀后备用。精密称取混合均匀的样品1 g,加水30 mL,于70 ℃水浴加热至完全溶解分散,取出,冷却至室温。用1 mol/L盐酸溶液调节样品溶液pH至1.7±0.1,放置约2 min后,再用1 mol/L氢氧化钠溶液调节样品溶液pH至4.5±0.1。将样品溶液转移至100 mL容量瓶中,加水定容至刻度,摇匀。离心,吸取1 mL上清液,加水稀释至10 mL。依次用8 mL甲醇和8 mL水活化RP净化柱,再将样品溶液依次通过0.22 μm水相滤膜和净化柱,弃去前面3倍柱体积洗脱液,收集后面洗脱液待测。
1.2.3 色谱条件 色谱柱:CarboPac PA1保护柱(4 mm×50 mm)、CarboPac PA1分析柱(4 mm×250 mm);柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL;检测器:脉冲安培检测器,Au工作电极,Ag/AgCl参比电极;淋洗液:淋洗液A为超纯水,淋洗液B为氢氧化钠溶液(200 mmol/L),淋洗液C为氢氧化钠(150 mmol/L)乙酸钠(500 mmol/L)混合溶液,梯度洗脱程序见表1。分别吸取标准溶液和样品溶液适量,按上述色谱条件进样分析,根据保留时间定性,标准曲线法定量。
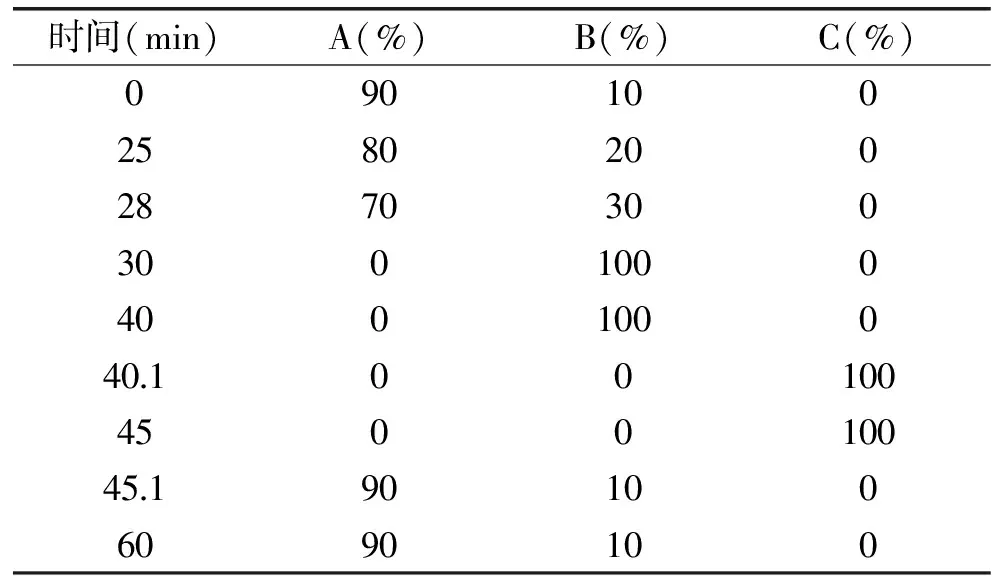
表1 梯度淋洗程序Table 1 The program of gradient elution
1.3 数据处理
色谱结果积分处理采用Thermo Chromenleon 7.2 SR5色谱工作站,并利用Excel软件进行数据统计及数据分析。
2 结果与讨论
2.1 实验条件的优化
2.1.1 离子色谱柱的选择 糖和糖醇为弱酸性物质,pKa值为12~14之间。在碱性条件下以阴离子形式存在于溶液中,可采用氢氧化钠/醋酸钠淋洗液系统,通过阴离子交换色谱柱对其进行分离[19-20]。试验考察了CarboPac PA1、CarboPac PA20及CarboPac MA1三款不同的色谱柱,色谱图见图1。
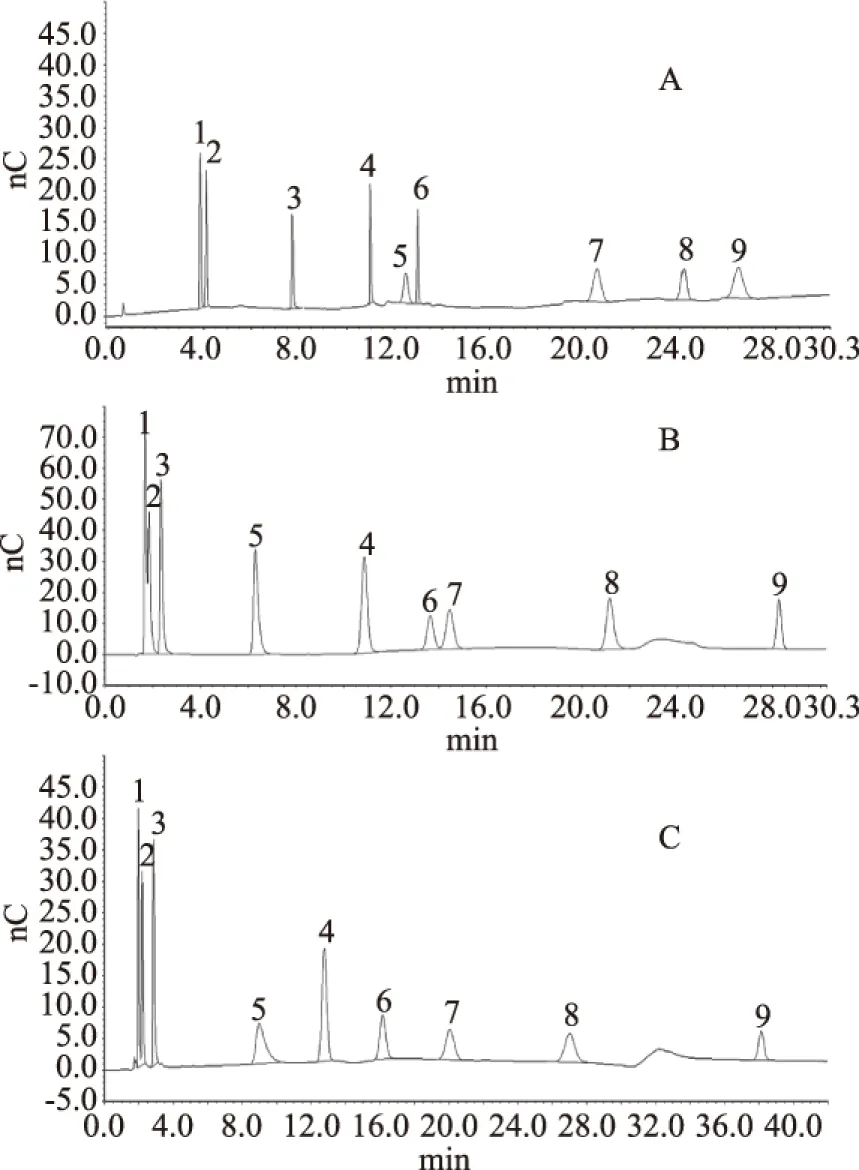
图1 不同色谱柱对应色谱图Fig.1 Chromatogram of different columns 注:A:MA1;B:PA20;C:PA1;1.赤藓糖醇;2.木糖醇;3.山梨糖醇;4.葡萄糖;5.麦芽糖醇;6.果糖;7.蔗糖;8.乳糖;9.麦芽糖。
其中,CarboPac MA1对糖和糖醇的保留较强,分离度良好,但运行时间较长,色谱峰峰宽较大,灵敏度相对较低。同时,如果淋洗液系统中含有醋酸钠,MA1色谱柱的平衡时间较长;如果不含醋酸钠,样品中的其它强保留的杂质成分(如低聚糖类)又难以从色谱柱上洗脱下来,随着样品分析次数的增加,基线不断抬高。CarboPac PA20分析速度快,灵敏度高,但对赤藓糖醇和木糖醇保留较弱,出峰过快导致无法完全分离。CarboPac PA1能够对9种糖和糖醇进行较好的分离,且保留时间适中,故采用PA1色谱柱作为本实验的分析柱。
2.1.2 样品前处理的优化 食品基质复杂,尤其是本次实验中检测的软糖、代餐粉和营养棒中,含有大量的明胶、果胶和蛋白质等物质,不仅会对目标色谱峰产生干扰,而且还容易对色谱柱及检测器造成损坏。因此,需在样品的前处理过程中增加除蛋白的步骤以减少干扰,保护色谱柱。常见的除蛋白的方法有盐析法[21]、有机试剂沉淀法[21-22]、沉淀剂法[23]、pH沉淀法[24-25]等。盐析法需加入大量盐类物质,上机前需对样品溶液进行脱盐处理,否则高浓度的盐易对色谱峰的峰形及保留时间造成影响。有机试剂沉淀法操作简单,沉淀蛋白的分辨能力高于盐析法,但考虑到部分离子色谱柱对有机试剂不耐受,故排除了有机试剂沉淀法。常用的蛋白沉淀剂有亚铁氰化钾-乙酸锌,沉淀效率高,但考虑到金属离子对离子色谱的不良影响,故不考虑沉淀剂法。最终采用调节pH的方式沉淀蛋白,沉淀效果较好且对离子色谱分析无影响。
同时,为了除去样品中的其他杂质,沉淀蛋白后的样品溶液还需通过净化柱进行进一步的纯化。常用的净化柱有On Guard A柱,On Guard Na柱,On Guard RP柱等。A柱主要用于去除样品溶液中的阴离子污染物并中和强酸;Na柱主要用于去除样品溶液中的金属离子;RP柱主要用于去除样品溶液中的疏水性物质及表面活性剂。考虑到样品中可能存在部分脂溶性物质,故样品溶液在上机测试之前还需依次通过0.22 μm微孔滤膜及On Guard RP柱以除去样品中的脂溶性杂质,避免污染色谱柱。软糖1(无糖)样品溶液色谱图见图2。
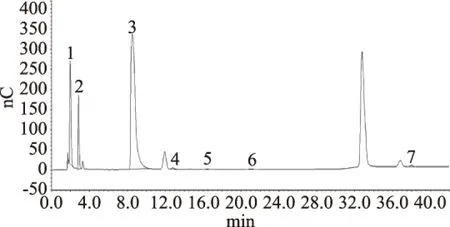
图2 样品溶液色谱图Fig.2 Chromatogram of sample solution注:1.赤藓糖醇;2.山梨糖醇;3.麦芽糖醇;4.葡萄糖;5.果糖;6.蔗糖;7.麦芽糖。
2.2 方法验证
2.2.1 标准曲线与定量限 将1.2.1项下的标准系列工作液按方法规定的色谱条件进样测试,以浓度(μg/mL)为横坐标X,以峰面积为纵坐标Y绘制标准曲线,并计算回归方程和相关系数。
对标准溶液进行逐级稀释,以信噪比为10时的溶液浓度作为定量限。结果表明,9种糖和糖醇在0.1~10 μg/mL范围内线性关系良好,各指标线性回归方程、相关系数、线性范围、定量限见表2。

表2 9个化合物的线性范围、回归方程、相关系数和定量限(S/N=10)Table 2 Linear ranges,regression equations,correlation coefficients and LOQs of the nine compounds(S/N=10)
2.2.2 方法重复性 取软糖1(无糖)样品,按1.2项下方法操作,平行制备6份样品溶液,按方法规定色谱条件进样分析,计算样品中9种糖和糖醇的含量及RSD值,结果见表3。结果表明,方法重复性良好,RSD值均小于3%。
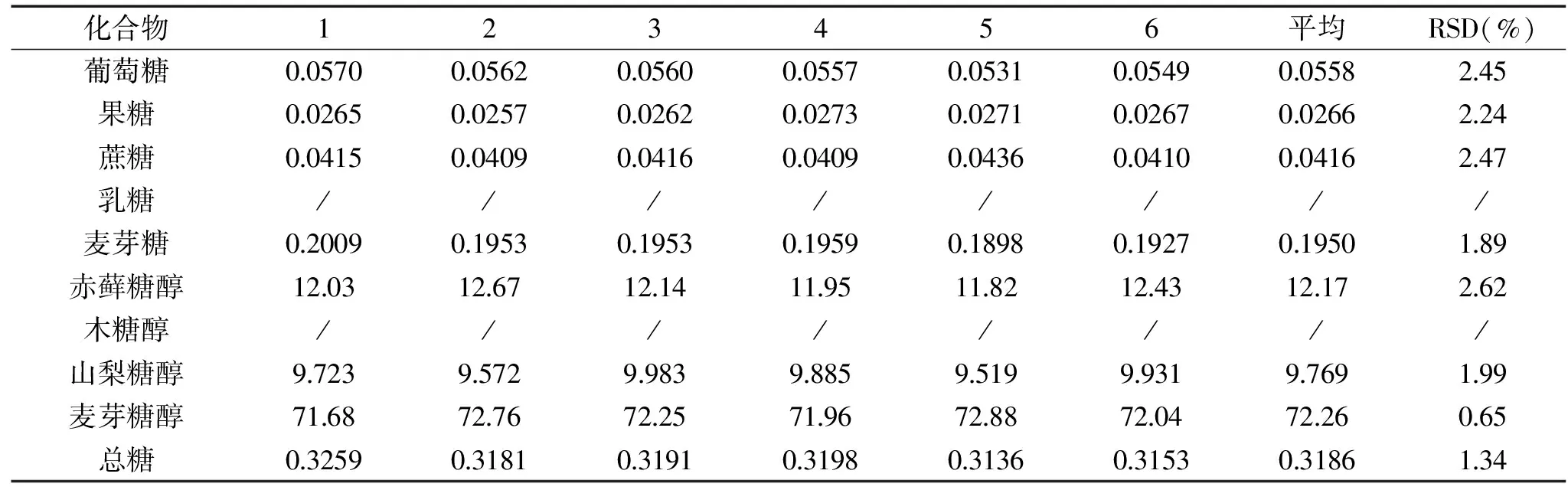
表3 重复性测定结果(n=6)Table 3 Repeatability test results(n=6)

表5 市售产品检测结果(%)Table 5 Test results of commercial products(%)
2.2.3 方法回收率 取已知含量的软糖1(无糖)样品9份,每份0.5 g,分成3组,每组平行3个样,分别加入低、中、高浓度的混合标准品溶液,按方法要求操作并测定,计算9种糖和糖醇的回收率,结果见表4。结果显示,9种糖和糖醇的回收率均在96.54%~103.71%之间,相对标准偏差在0.65%~2.53%之间,方法回收率良好,准确度较高。
2.3 市售样品检测
本次实验共收集了市售的3款无糖或低糖型软糖、3款低糖型粉剂及1款低糖型能量棒,按已建立的方法测定样品中糖和糖醇的含量,结果见表5。结果显示,本次试验收集的7款市售样品中,无糖样品的含糖量均低于0.5%,低糖样品的含糖量均低于5%,符合《GB 28050-2011 食品安全国家标准 预包装食品营养标签通则》中对无糖和低糖食品含糖量的规定[26]。其中,软糖中常添加的糖醇主要为麦芽糖醇和山梨糖醇;粉剂及营养棒中常添加的糖醇包括赤藓糖醇和麦芽糖醇。
3 结论
本文建立了梯度洗脱-离子色谱-脉冲安培检测方法同时测定葡萄糖、果糖、蔗糖、乳糖、麦芽糖、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇,并对样品的前处理及色谱柱的选择进行了考察和优化,使其可用于实际市售各个剂型样品的检测。结果表明,9种糖和糖醇在0.1~10 μg/mL范围内线性关系良好,定量限均小于0.1 μg/mL;样品重复性相对标准偏差为1.34%;加标回收率均在96.54%~103.71%之间,相对标准偏差0.65%~2.53%。该方法操作简便、重现性好、灵敏度高、定量限低,解决了实际检测中糖和糖醇分离不佳、响应较差的难题,可广泛应用于低糖、无糖食品中糖和糖醇的检测,具有较高的实际应用价值。

