谷氨酸钠和抗坏血酸协同处理藜麦萌发富集γ氨基丁酸工艺优化及胆酸盐吸附能力研究
,*
(1.青海大学农林科学院,青海省青藏高原农产品加工重点实验室,青海西宁 810016; 2.省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
藜麦(ChenopodiumquinoaWilld.)是一种原产于印第安地区的藜科藜属一年生双子叶假谷物,是印第安土著居民的主要食物之一[1]。藜麦有“粮食之母”、“营养黄金”等美称,距今已有5000~7000年的种植历史,目前在我国陕西、甘肃、山西、青海、四川、浙江、吉林等地区均有种植[2]。藜麦营养与活性成分包括淀粉、蛋白质、多糖、膳食纤维、脂肪、多酚、皂苷、矿物质(Mn、Fe、Mg、Ca等)、维生素(VB1、VB2、VC)等,其中蛋白质含量可达16.5%,氨基酸组成比例均衡,含有8种人体必需氨基酸,尤其赖氨酸(5.1%~6.4%)和蛋氨酸(0.4%~1.0%)含量明显高于一般谷物,具有极高的食用价值[3-4]。藜麦中富含的多酚、黄酮、不饱和脂肪酸、皂苷等植物活性成分表现出良好的抗氧化、抗肿瘤、抗菌、降血脂、降血压、降血糖等功效,使得藜麦成为健康功能食品开发的研究热点[5-7]。
萌发是高等植物生命活动中一个物质分解与合成代谢活跃的时期,在该过程中存在多种生理变化和形态变化[8]。萌发处理能改善种子的氨基酸含量与组成、提高蛋白质的消化特性和利用率、增加游离糖和酚类化合物含量、提高B族维生素含量、降低抗营养因子水平及改善食品的加工特性和感官品质[9-11]。谷物种子经过萌发后还可形成或富集γ-氨基丁酸(γ-aminobutyric acid,GABA)等活性成分,其对提高食品功能品质具有重要作用。四碳非蛋白氨基酸GABA作为种子萌发中关键活性物质之一,具有降血压、缓解疼痛、改善脑机能和抗焦虑等功效[12],而萌发谷物降血脂作用也可能与存在γ-氨基丁酸相关[13]。功效组分可通过吸附胆酸盐并将其排出体外来降低胆酸盐在肠循环中的积累,促进胆固醇代谢、降低血脂,从而改善机体健康[14]。
目前,杂粮及大宗谷物如糙米、红米、燕麦、青稞、藜麦、绿豆、玉米等的萌发及GABA富集已引起了研究人员的较多关注[9,11-13,15-17];其中有关藜麦萌发的研究相对较少,已有报道主要对藜麦萌发期营养与功能成分变化、GABA的富集及藜麦芽食品开发做了初步探讨[8,12,18-19]。研究表明,逆境胁迫(盐胁迫、酸胁迫、受热、受冷、低氧胁迫、CO2处理、金属离子处理等)可以激活谷氨酸脱羧酶(glutamatede carboxylase,GAD)和二胺氧化酶(diamine oxidase,DAO)酶活性以促使种子萌发富集GABA[12,20-22],其中酸胁迫是相对操作便捷、安全性高、富集效果好的处理方式之一;在存在GABA代谢关键底物谷氨酸等的条件下,种子对GABA的富集效果可进一步改善[22],这些经过胁迫富集氨基丁酸的作物种子对开发高GABA含量健康产品具有重要意义。王玉萍等[23]研究了发芽糙米在谷氨酸钠(MSG)和抗坏血酸(ASA)胁迫下富积GABA的工艺,结果显示优化条件下GABA富积量可达924.84 nmol/L,相比对照组提高了2.73倍。目前,有关藜麦在MSG和ASA协同处理下萌发富集GABA的研究尚无报道。
本研究以青藜2号藜麦为原料,采用MSG和ASA协同处理藜麦种子萌发富集GABA。通过单因素和正交试验对影响藜麦GABA含量的萌发温度、萌发时间、浸泡温度、浸泡时间等因素进行探讨,获得最佳工艺条件,在此基础上对萌发藜麦胆酸盐结合性能进行分析,以期为藜麦萌发及富GABA食品研究提供一定理论依据。
1 材料与方法
1.1 材料与仪器
藜麦(青藜2号) 由青海省农林科学院作物所提供,于阴凉干燥处存放,萌发后置于-18 ℃冰箱储存备用;GABA标准品(纯度≥98.0%) 北京索莱宝科技有限公司;牛磺胆酸钠(纯度≥97.0%)、甘氨胆酸钠(纯度≥98.0%) 上海源叶生物科技有限公司;糠醛、邻苯二甲醛(o-phthaldialdehyde,OPA) 分析纯,国药集团化学试剂有限公司;甲醇、乙腈 色谱级,天津富宇精细化工有限公司;次氯酸钠、乙酸钠、硼砂、硼酸 分析纯,天津市河东区红岩试剂厂;2-巯基乙醇、谷氨酸钠、抗坏血酸、浓硫酸 分析纯,上海广诺化学科技有限公司;试验中采用水 均为去离子水。
N4S紫外分光光度计 上海仪电分析仪器公司;AL204电子天平 梅特勒-托利多仪器(上海)公司;LRH-150生化培养箱 上海齐欣科学仪器公司;KQ-500DE数控超声波清洗器 昆山超声仪器有限公司;XL-10B扣压摇摆式小型粉碎机 天津华鑫仪器厂;DL-5M低速冷冻离心机 湖南长沙湘仪离心机仪器公司;LC-20/40D 3C液相色谱系统 日本岛津,配备PDA检测器和Shim-pack XR-ODS II(2.0 mm×75 mm)色谱柱。
1.2 实验方法
1.2.1 藜麦萌发处理 称取20 g藜麦筛选清理并用去离子水清洗后,用4%次氯酸钠溶液进行种子消毒,再次清洗2次后加入不同浓度的MSG和ASA于25 ℃浸泡12 h。准备铺有两层滤纸的培养皿并加入10 mL去离子水浸湿,将处理后的藜麦种子均匀铺在培养皿,放入25 ℃培养箱进行暗发芽,萌发期间每隔12 h均匀加入10 mL去离子水。萌发结束后,将藜麦种子预冻后冷冻干燥15 h,打粉过40目筛后待测。
1.2.2 GABA含量测定 参考郭晓蒙等[12]的方法并稍加修改。准确称取0.5 g萌发藜麦粉于50 mL离心管,以70%甲醇为提取溶剂按1∶20 (g/mL)料液比混合均匀后于50 ℃、500 W条件提取20 min,4000 r/min冷冻离心20 min分离上清液;取上清液200 μL于色谱瓶中,加入1 mLOPA衍生剂后充分振荡,静置5 min并用0.22 μm有机滤膜过滤后上机测定。色谱条件:流动相A为0.02 mmol/L乙酸钠,流动相B为乙腈,流速0.5 mL/min,柱温38 ℃,检测波长332 nm,上样量10 μL。梯度洗脱程序:0~10 min,0%~10% B;10~30 min,10%~80% B;30~40 min,80%~100% B。标准溶液梯度为0.00、0.10、0.20、0.30、0.40、0.50 mg/mL,试验重复3次,以色谱峰面积对浓度做标曲,实际样品GABA含量利用标曲方程计算。
1.2.3 单因素实验 称取20 g清理后的藜麦种子,分别以MSG(0.0、1.0、2.0、3.0、4.0 mg/mL)和ASA(0.0、2.0、4.0、6.0、8.0、10.0 mg/mL)浸泡后进行萌发试验,优选MSG和ASA浓度;浸泡温度25 ℃、浸泡时间12 h、萌发温度25 ℃、萌发时间48 h,根据“1.2.2”方法测定GABA含量。在最佳浓度下,配制MSG和ASA混合溶液浸泡处理藜麦并萌发;探讨浸泡时间(0、2、4、6、8、10、12 h)、浸泡温度(20、25、28、30、35 ℃)、萌发时间(0、12、24、36、48、60、72 h)及萌发温度(20、25、28、30、35 ℃)对藜麦胁迫富集GABA的影响,试验中各因素的固定条件为浸泡温度25 ℃、浸泡时间为12 h、萌发温度25 ℃、萌发时间48 h;对照组藜麦以去离子水处理萌发,其中浸泡时间探讨及优化工艺参数下验证组对照样浸泡时间为6 h,其他对照样处理条件均为上述单因素实验固定条件;GABA含量按照“1.2.2”测定。根据单因素实验,筛选主要影响因素的主要水平开展正交试验。
1.2.4 正交试验设计 通过L9(34)正交设计对藜麦MSG/ASA胁迫萌发富集GABA的工艺进行优化,根据试验情况选择浸泡时间(A)、浸泡温度(B)、萌发时间(C)和萌发温度(D)4个因素,各因素取3个水平,建立四因素三水平正交试验因素水平表,见表1。样品按“1.2.2”方法测定GABA含量,结合极差和方差分析对不同因素的影响及最优工艺进行分析,试验重复3次。
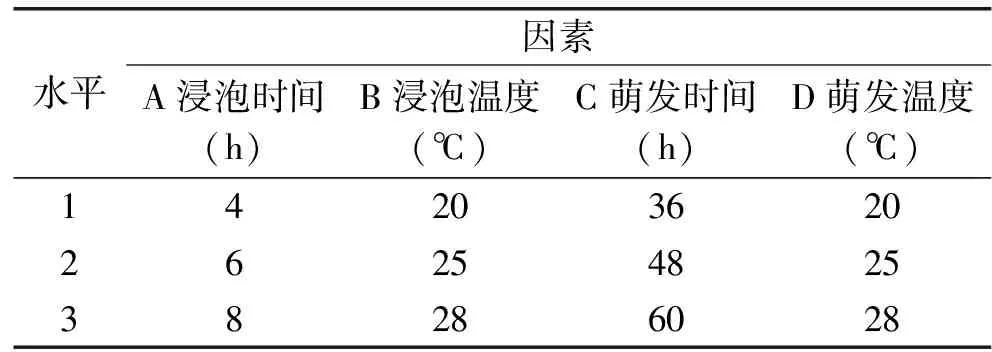
表1 藜麦萌发正交试验因素设计水平表Table 1 Factor and level of orthogonaldesign for quinoa germination
1.2.5 MSG和ASA胁迫萌发藜麦胆酸盐吸附能力分析 采用糠醛比色法[24-25]测定样品胆酸盐结合量。胆酸钠(牛磺胆酸钠和甘氨胆酸钠)标准溶液浓度为0、0.4、0.8、1.2、1.6、2.0 mg/mL。称取0.5 g不同处理藜麦粉(藜麦原粉表示为LMYF,去离子水萌发藜麦表示为WAMF,最优条件下胁迫萌发藜麦表示为XPMF),分别加入含有0.1 g胆酸钠的0.15 mol/L的NaCl溶液50 mL,混匀后于37 ℃恒温水浴中低速振荡吸附0、0.5、1.0、1.5、2.0、3.0 h,取出静置后准确吸取样液1.0 mL,3000 r/min离心5 min后取上清液待测。测定方法:取处理样液0.5 mL于10 mL带塞试管中,加入0.5 mL去离子水后,依次加入6.0 mL 45%的硫酸和1.0 mL 0.3%的糠醛,混匀后置于65 ℃恒温水浴中反应30 min,冷却至室温后于620 nm处测定吸光度值,绘制标准曲线,计算吸附前后胆酸钠浓度。胆酸钠吸附量按式(1)计算。
Q=(C0-2×C1)×50/m1
式(1)
式中:Q为藜麦粉对胆酸钠吸附量(mg/g);C0为吸附前溶液中胆酸钠的浓度,mg/mL;C1为吸附后溶液中胆酸钠的浓度,mg/mL;2为样品的稀释倍数;50为吸附试验中胆酸盐溶液体积,mL;m1为藜麦粉质量,g。
1.3 数据分析
所有试验重复3次,结果以平均值表示,图表采用Microsoft Excel绘制,正交试验结果采用PASW Statistics 18软件分析。
2 结果与分析
2.1 MSG和ASA最佳浓度的确定
MSG浓度对发芽藜麦GABA含量的影响如图1所示。由图1可知,随着MSG浓度的增大,藜麦中GABA含量先升高后趋于稳定。MSG浓度在0~2.0 mg/mL之间GABA含量有一定增加,MSG浓度2.0~4.0 mg/mL时,萌发藜麦中GABA含量无显著性差异(P>0.05),MSG浓度2.0 mg/mL时,富集GABA的水平最高,为1.043 mg/g,是对照组藜麦的1.46倍。萌发与GAD等酶的活性有关,而谷氨酸(Glu)是该代谢过程的关键底物,一般作物种子本身含有一定量的Glu,随着萌发过程进行,蛋白质发生分解产生新的Glu,这些Glu均为GABA生物合成的基础[23]。萌发初期种子内Glu含量较低,GAD被激活合成GABA能力有限,当浸泡处理种子吸收利用MSG后组织细胞内Glu含量上升,GABA合成能力增强,含量增加。然而,当内部组织Glu饱和后种子首先会利用内源Glu,加入MSG将不再促进酶促反应底物的富集[23]。因而,结合生产实际选择2.0 mg/mL MSG用于后续藜麦种子处理。

图1 MSG浓度对萌发藜麦GABA含量的影响Fig.1 Effect of MSG concentration onGABA content in germinated quinoa
ASA浓度对发芽藜麦GABA含量的影响如图2所示。由图2可知,不同浓度ASA对萌发藜麦中GABA含量的影响存在明显差异。ASA浓度在0~6.0 mg/mL之间变化时,藜麦中GABA含量呈现波动增加的趋势,当ASA浓度为6.0 mg/mL时达到最高水平1.069 mg/g,为对照组的1.44倍;当ASA浓度高于6.0 mg/mL时,GABA含量显著降低(P<0.05)。植物组织中GAD酶和转氨酶的最适pH分别为5.0~6.0和9.0,当加入适量酸增加H+可对种子萌发形成逆境,促进GABA积累,但是当酸浓度过高时可能会使藜麦种子pH偏低,抑制GAD等酶的活性,从而抑制了GABA的生成[26]。
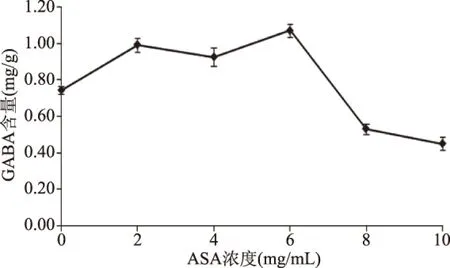
图2 ASA浓度对萌发藜麦GABA含量的影响Fig.2 Effect of ASA concentration onGABA content in germinated quinoa
综上所述,MSG浓度2 mg/mL和ASA浓度6 mg/mL为藜麦浸泡较优水平,因此后续试验中选择该浓度组合来配制工作液以浸泡处理藜麦。
2.2 浸泡时间与浸泡温度对藜麦GABA含量的影响
浸泡时间对发芽藜麦GABA含量的影响如图3所示。由图3可知,萌发藜麦中GABA含量随着浸泡时间的延长而先增大后减小,当浸泡时间为6 h时,GABA含量达到最大值1.577 mg/g,为对照样品的2.07倍,表明浸泡6 h富集GABA效果较好。浸泡0~6 h过程中,藜麦种子不断吸收MSG和ASA,为藜麦的萌发提供了底物储备,同时低氧浸泡环境中GAD等酶受H+激活影响活性增强,因此随着浸泡后萌发的进行,藜麦GABA含量水平明显提高。当浸泡时间大于6 h后,藜麦种子吸收过量的MSG和ASA,GABA含量出现一定的降低;一方面是可能随着浸泡时间的延长,溶液氧被大量消耗,种子发芽力降低[21];另一方面,浸泡使得种子软化度提高,在长时间低pH、低氧及过饱和环境下GAD及DAO等酶的催化活力损失,抑制了GABA的富集[12,27]。

图3 浸泡时间对萌发藜麦GABA含量的影响Fig.3 Effect of soaking time onGABA content in germinated quinoa
浸泡温度对发芽藜麦GABA含量的影响如图4所示。由图4可知,不同浸泡温度对萌发藜麦中GABA含量的影响存在明显差异。当浸泡温度在20~25 ℃之间时,藜麦GABA含量快速增加,25 ℃时达到最高水平1.335 mg/g,为20 ℃萌发藜麦的1.64倍,表明25 ℃浸泡有利于GABA富集;在该范围内随着温度逐渐升高,藜麦种子代谢较活跃、酶系活性增加,使得对MSG、ASA及Glu的富集利用加强,萌发藜麦GABA含量明显提高;当浸泡温度在25~35 ℃之间时,GABA含量迅速降低,30 ℃后减小较缓慢。当浸泡温度高于25 ℃后藜麦组织细胞膜控制H+进出的平衡态可能受到影响[23],胞内pH降低使GAD等酶活性降低,GABA代谢被抑制;浸泡温度高于30 ℃后酶活性降低,同时GABA也可能在较高温度下破坏,使得GABA含量下降[28]。
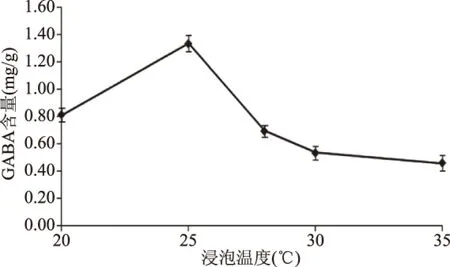
图4 浸泡温度对萌发藜麦GABA含量的影响Fig.4 Effect of soaking temperatureon GABA content in germinated quinoa
综上所述,浸泡时间选择为6 h,浸泡温度为25 ℃。
2.3 萌发时间与萌发温度对藜麦GABA含量的影响
萌发时间对发芽藜麦GABA含量的影响如图5所示。由图5可知,随着萌发时间的不断延长,藜麦GABA含量逐渐升高,48 h达到最大值1.313 mg/g,分别为藜麦种子(0.524 mg/g)和对照组GABA含量的2.50和1.84倍;当萌发时间大于48 h时,藜麦GABA含量呈下降趋势;除萌发24和36 h、60和72 h藜麦GABA含量分别无显著差异外(P>0.05),其余均存在显著性差异(P<0.05)。由上述可知,延长萌发时间并不能提高GABA富集量,在萌发超过48 h后藜麦种子中富集的GABA可能会在转氨酶的作用下形成琥珀酸半醛,造成GABA含量降低[29],因此萌发48 h有利于藜麦富集GABA。

图5 萌发时间对藜麦GABA含量的影响Fig.5 Effect of germination timeon GABA content in quinoa
萌发温度对发芽藜麦GABA含量的影响如图6所示。由图6可知,萌发温度对藜麦中GABA含量的影响存在显著性差异(P<0.05)。培养温度在20~25 ℃范围内,藜麦GABA含量快速增大,25~35 ℃范围内GABA含量显著减小(P<0.05),这可能是因为温度过高后种子酶活性降低及GABA转化代谢加快,使得GABA含量下降。萌发温度2 5 ℃时藜麦GABA含量为1.228 mg/g,约为20和35 ℃萌发藜麦的2.5和3倍,因此25 ℃对藜麦萌发富集GABA较有利。

图6 萌发温度对藜麦GABA含量的影响Fig.6 Effect of germination temperatureon GABA content in quinoa
2.4 藜麦胁迫萌发条件正交试验结果
藜麦胁迫萌发富集GABA的正交试验结果如表2所示。由表2可知,各因素影响的极差大小依次为RD>RC>RA>RB,表明4个探讨因素对GABA富集效果的影响大小程度依次为萌发温度、萌发时间、浸泡时间、浸泡温度,其中GABA含量最高的组合为A2B2C2D2,即浸泡时间6 h、浸泡温度25 ℃、萌发时间48 h、萌发温度为25 ℃,该优化条件下处理藜麦萌发后GABA富集量可达1.613 mg/g。

表2 藜麦萌发不同条件组合对GABA富集的影响Table 2 Effect of different combinations ofquinoa germination condition on GABA enrichment
正交试验方差分析结果如表3所示。由表3可知,萌发时间(C)和萌发温度(D)对藜麦富集GABA影响达到了极显著(P<0.01),浸泡时间(A)和浸泡温度(B)也存在显著影响(P<0.05),表明在以MSG和ASA协同处理藜麦萌发富集GABA过程中涉及到的4个影响因子均较为关键。由F值和P值可以看出,对GABA含量影响最大的为萌发温度,影响相对最小的为浸泡温度。
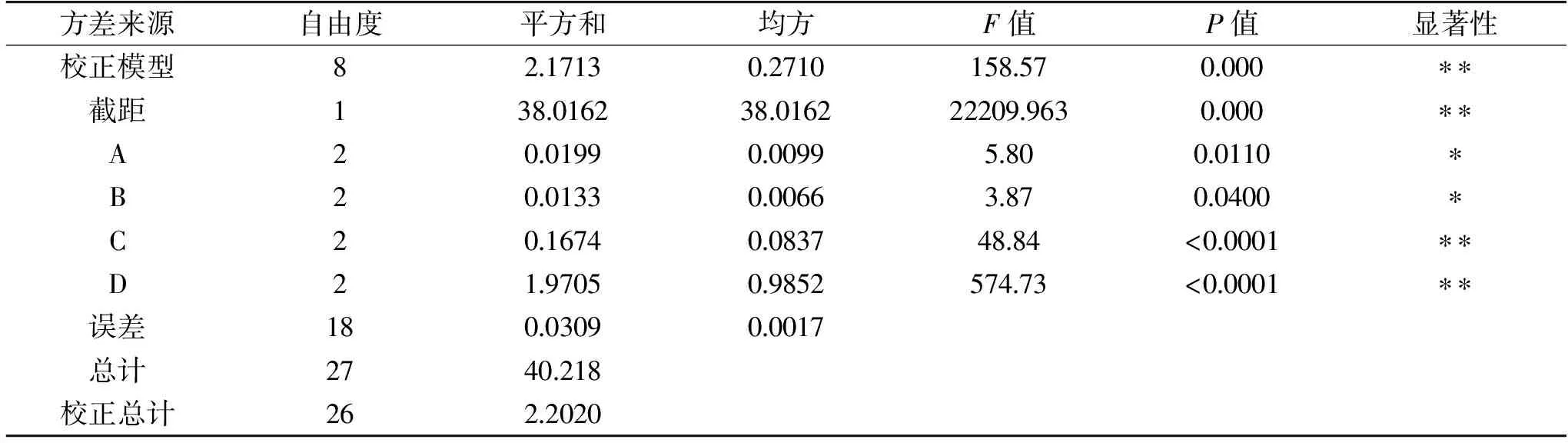
表3 方差分析表Table 3 Analysis of variance(ANVOA)
2.5 萌发藜麦胆酸盐结合能力分析
萌发前后藜麦对胆酸盐的结合性能如图7所示。由图7A可知,LMYF、WAMF和XPMF三种藜麦粉对牛磺胆酸钠的吸附量随吸附时间的延长而先增大后趋于稳定,吸附平衡时吸附量分别可达177.68、150.25和125.17 mg/g,结合牛磺胆酸钠的能力依次为未萌发的藜麦原粉LMYF>去离子水萌发的藜麦粉WAMF>胁迫萌发藜麦粉XPMF;由图7B可知,LMYF、WAMF和XPMF对甘氨胆酸钠的吸附量同样随吸附时间延长而先增大后趋于稳定,平衡吸附量分别为179.53、163.12和144.92 mg/g,结合能力仍以藜麦原粉最强;萌发前后及不同萌发方式下的藜麦总体均保持高的胆酸盐结合能力。胆酸盐是体内胆固醇分解后的两性大分子产物,机体通过吸附胆酸盐并排出体外可以达到降低体内胆固醇含量和降血脂的目的[14];报道表明GABA本身具有降血脂活性,然而本研究中萌发后藜麦全粉胆酸盐结合量降低,主要原因是萌发前后的藜麦全粉相比单一GABA物质组成更加复杂,而谷物降血脂活性还来自于其多糖、纤维、蛋白、抗性淀粉等[14,24,30-31],藜麦经过萌发后大分子多糖、蛋白、淀粉等部分发生代谢分解[7],进而可能使萌发粉相比原粉总的体外降脂能力下降。综上所述,胁迫条件下藜麦萌发活性加强,γ-氨基丁酸明显富集,而胆酸盐结合能力会出现一定降低。

图7 萌发前后藜麦粉对胆酸盐的吸附Fig.7 Adsorption of bile salts byquinoa flour before and after germination
3 结论
本研究采用单因素实验和正交试验,以GABA含量为指标,对藜麦在MSG和ASA协同胁迫下萌发富集GABA工艺进行了优化,并对萌发藜麦胆酸盐吸附能力进行了探讨。最适藜麦浸泡MSG和ASA浓度分别为2和6 mg/mL,优化富集工艺为浸泡时间6 h、浸泡温度25 ℃、萌发时间48 h、萌发温度25 ℃,最优条件下萌发藜麦GABA含量可达1.613 mg/g,分别为藜麦种子和对照组的3.07和2.26倍。萌发前后藜麦均具有较强的胆酸盐吸附能力,其中未萌发藜麦最强,萌发及胁迫萌发后藜麦胆酸盐结合量有所降低。本研究可为藜麦富集活性GABA组分及开发藜麦健康新产品提供一定的理论依据。

