阻塞性睡眠呼吸暂停低通气综合征患者心理状况研究
韩 冰,朱建勇
(1.锦州医科大学附属十堰市人民医院培养基地, 湖北 十堰 442000;2.十堰市人民医院 呼吸内科,湖北 十堰 442000)
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是指睡眠期间反复发生上气道阻塞并引起反复呼吸暂停、间歇缺氧和反复微觉醒等为特征,伴或不伴低通气的一种慢性睡眠呼吸疾患[1]。其发病率高,危害性大,对患者的身心健康都有很大危害,是一种潜在致死性疾病[2]。既往研究发现OSAHS可引起认知功能损害并导致精神心理异常[3-7],但这些研究多关注单一心理症状,对患者的整体心理状况缺少综合评估,对焦虑、抑郁症状与PSG客观指标之间相关性的研究较少。本研究采用SCL-90综合心理量表对OSAHS患者心理状况进行全方位评估,并探讨焦虑、抑郁症状与PSG监测指标之间的关系,以指导临床。
1 资料与方法
1.1病例选择 2018年3月至2019年12月十堰市人民医院呼吸科就诊的OSAHS患者200例,男145例,女55例;OSAHS的诊断符合中华医学会呼吸病学分会睡眠呼吸疾病学组制定的标准,并根据呼吸暂停低通气指数(AHI)分为轻度组(AHI:5~15次/h)46例(23%)、中度组(AHI:15~30次/h)57例(28.5%)及重度组(AHI:大于30次/h)97例(48.5%)。
1.2纳入及排除标准 纳入标准:①符合OSAHS诊断标准(2018年实践版)[8]的18~65岁患者;②研究开始前未行OSAHS特殊治疗者;③能配合量表评估及定期随访者;④患方或其监护人知情同意并签署同意书者。排除标准[9]:①研究开始前已接受过治疗;②有精神疾病病史或家族史;③患严重影响心理状况的其他疾病;④近5年内遭遇过重大家庭变故;⑤存在酗酒和精神药物滥用;⑥因视听力、交流理解能力和肢体活动障碍等无法配合问卷调查者;⑦存在除OSAHS之外的其他睡眠疾病和慢性阻塞性肺病者。
1.3收集基础资料 登记研究对象基本情况,包括:姓名、性别、年龄、文化程度、体重指数、既往病史(高血压、糖尿病、冠心病、甲状腺疾病、心律失常疾病等)。
1.4心理量表评估 采用SCL-90量表评估患者心理状况。SCL-90量表是自陈症状量表,共90个项目,代表9个因子:躯体化、强迫症状、人际关系敏感、抑郁、焦虑、敌对、恐怖、偏执及精神病性。每个项目分为五级:无=0分、轻度=1分、中度=2分、重度=3分、极重=4分,总分等于90项得分之和,因子均分=某一因子各项总分和/该因子项目数。心理障碍阳性判断是以量表总分〉160分或阳性项目数超过43项或任意因子分均超过2分为准[10]。量表在固定的精神科医师指导下完成,保证空项少于10%,否则作废。量表当场填写、当场收回。
1.5多导睡眠监测及评定 所有研究对象均于晚22:00至次日7:00在睡眠实验室应用美国伟康公司生产的多导睡眠监测仪(A1ice 5)进行监测,有效监测时间≥7 h,监测的项目包括脑电图、心电图、眼动电图、肌电图、口鼻气流、胸腹部呼吸运动、指端动脉血氧饱和度测定、鼾声、体位、肢体活动等,数据人工审核校正后,软件自动统计分析。检查前禁止服用茶叶、巧克力、可乐等含咖啡因物质或酒精性饮料。检查前一晚受试者应当保证充足的睡眠,同时向受试者详细说明操作流程以消除其紧张情绪。监测完成后由专业技术人员判读并撰写报告。
1.6观察指标 ①SCL-90量表各项目分数及样本均分(包括:躯体化、强迫症状、人际关系敏感、抑郁、焦虑、敌对、恐怖、偏执及精神病性9个项目),以及对应心理项目阳性的人数。②判读指标选择:选取呼吸暂停低通气指数(AHI)作为反映病情程度的指标;选取MAI作为睡眠片断化的指标;选取夜间最低血氧饱和度(LaSO2)、血氧饱和度低于90%的时间占睡眠总时间百分比(TS90)作为夜间缺氧的指标;选取快眼动睡眠(REM)和深睡眠时间占比作为反映睡眠结构的指标。

2 结 果
2.13组基础资料比较 与轻度组比较,中度组和重度组平均年龄、BMI指数、AHI、MAI、TS90%明显增高,重度组高于中度组(P<0.05);LSaO2、REM睡眠及深睡眠时间占比明显降低,重度组明显低于中度组(P<0.05),见表1。
2.2OSAHS患者总体心理状况分析 对200例OSAHS患者进行量表测评,量表结果阳性患者137例,阳性率68.5%(137/200)。将OSAHS患者SCL-90量表各项得分与对应国内常模对比,结果显示:OSAHS患者心理状况较正常人差,其中:躯体化、强迫症状、人际关系敏感、抑郁、焦虑、恐怖、偏执、精神病性因子分较国内常模高,差异有统计学意义(P<0.05)。敌对因子分较常模高,但差异无统计学意义(P>0.05),见表2。
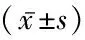
表1 3组基础资料比较
注:与轻度组比较,*P<0.05;与中度组比较,#P<0.05
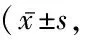
表2 OSAHS患者SCL-90问卷得分与常模对比情况分)
2.3OSAHS患者对应心理异常类型占比 对200例OSAHS患者的量表检测中,显示137例在1项或多项心理项目上出现异常,其中躯体化障碍46.3%(64/137)最高,其次为焦虑42.1%(58/137)、抑郁39.3%(54/137),其他包括强迫18.25%(25/137)、人际敏感17.52%(24/137)、精神病性13.14%(18/137)、偏执11.68%(16/137)、恐怖9.49%(13/137)、敌对4.38%(6/137)。
2.4不同程度OSAHS患者的心理状况分析 3组躯体化、强迫、人际敏感、焦虑、抑郁、恐怖、精神病性得分比较差异有统计学意义(P<0.05),敌对、偏执得分差异无统计学意义(P>0.05);轻、中度组人际敏感、恐怖、精神病性差异无统计学意义(P>0.05),与重度组比较,轻度组和中度组人际敏感、恐怖、精神病性得分明显更低(P<0.05),见表3。
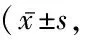
表3 不同程度OSAHS患者SCL-90问卷得分情况分)
注:与轻度组比较,*P<0.05;与中度组比较,#P<0.05
2.5OSAHS患者焦虑、抑郁得分与PSG监测指标相关性分析 焦虑、抑郁与AHI、TS90%呈正相关(P<0.05);与MAI呈正相关(P<0.01);与LSaO2、REM睡眠及深睡眠时间占比呈负相关(P<0.05),见表4。
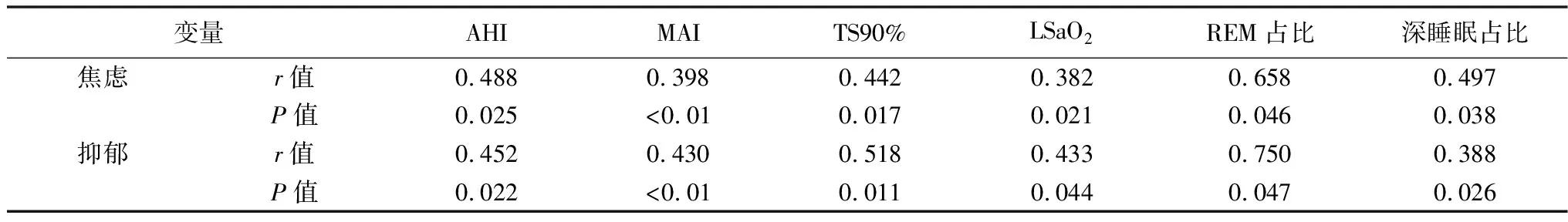
表4 焦虑、抑郁与PSG监测指标相关性分析
3 讨 论
OSAHS可导致患者心理异常已成共识,且国内外学者采用心理量表对OSAHS患者心理异常阳性率也做了统计报道。夏春鹏等[11]报道的焦虑单项量表阳性率为39.6%,抑郁单项量表阳性率为25%,国外Pierobon等[12]报道的抑郁单项量表阳性率约为30.6%,其范围多在20%~40%。而翟曜耀等[13]的研究进一步指出:不同量表的阳性率存在差异,综合量表的阳性率更高,甚至可达91.6%。本研究中SCL-90综合量表阳性率为68.5%,说明本地区OSAHS患者合并心理异常的概率偏高,提示临床应多加关注。既往研究认为慢性间歇性缺氧引起颅脑功能区损伤是产生心理异常的主要机制,本研究样本纳入的中重度患者多,其整体缺氧程度重、缺氧时间长,对颅脑损伤更重,这可能是本研究阳性率偏高的原因;同时SCL-90量表中包含9个心理症状类型,其涵盖面广是结果偏高的另一可能原因。既往研究发现OSAHS引起海马区缺氧损伤可诱发焦虑、抑郁,并推测缺氧还可能损伤其他颅脑区域产生其他心理异常类型[14]。本研究显示OSAHS患者在躯体化、强迫、人际敏感、抑郁、焦虑、恐怖、偏执、精神病性等多方面得分均高于常模,证实OSAHS可产生其他心理症状,推测OSAHS患者颅脑缺氧损伤可能是弥漫性的。进一步分析发现OSAHS患者心理异常类型中以躯体化障碍最高,其次为焦虑、抑郁,远高于强迫、人际敏感、精神病性、偏执、恐怖、敌对。既往研究证实躯体化障碍患者多伴有优势半球皮层功能缺陷及非优势半球皮层功能减退,且大脑皮层神经元对缺氧异常敏感[15]。OSAHS患者躯体化障碍发病率高可能是夜间缺氧损伤到大脑皮层所致,从社会心理角度来看,OSAHS作为慢性疾病会给患者持续带来心理负担,这种负担使患者感觉过敏化,将身体正常感觉错误的归因于某种疾病而产生躯体化障碍[16]。既往研究发现慢性间歇性缺氧极易损伤动物模型的海马区,海马是抑郁情绪的调节区,而调控焦虑的杏仁核、纹状体核也在海马,这就是OSAHS易并发焦虑、抑郁的原因[17]。同时躯体化作为机体感觉障碍,反复就诊不能得到解决会进一步加重焦虑、抑郁症状,而焦虑、抑郁的加重又增加了患者的心理负担,这种相互之间的恶性循环也进一步促进发病率的升高。强迫、人际敏感、精神病性、偏执、恐怖、敌对等心理类型对应的大脑功能区暂不明确,但猜测其产生多半也与OSAHS缺氧有关。从心理层面上来说,这些心理症状是人类面对生活压力时内心害怕紧张的外在表现,OSAHS影响生活能力,使患者对生活压力的承受力变差,从而出现这些心理症状[18]。关于病情程度对OSAHS心理状况的影响,结果可发现躯体化、强迫、焦虑、抑郁、恐怖、人际敏感、精神病性得分在不同病情程度组间差异有统计学意义。说明OSAHS患者心理状况与病情程度有关,病情越重,心理状况越差,重度OSAHS患者在症状得分更高的同时有着更多的心理异常类型(与轻、中度组相比)。说明重度OSAHS是患者心理状况恶化进程的分水岭,一旦病情进展到重度,会在加重原有心理症状的基础上诱发更多类型的心理障碍。提示对OSAHS患者要尽早开展治疗,延缓甚至避免其进展。随着OSAHS病情的进展,患者夜间缺氧更明显,会加重相应心理调节中枢神经元的损伤程度,使相应心理症状加重。而重度OSAHS患者在夜间缺氧加重的同时,开始出现REM睡眠及深睡眠时间明显的缩短,睡眠周期循环不能正常进行,是重度患者心理状况恶化明显的原因[19]。研究发现焦虑、抑郁是OSAHS患者比较常见的心理异常类型,其发生率仅次于躯体化障碍。本研究对焦虑、抑郁与PSG指标之间进行相关性分析,发现焦虑、抑郁得分与PSG指标之间有统计学相关关系。具体来看,病情程度指标AHI越大,其焦虑、抑郁的分数越高,两者呈正相关,这与国内外大部分研究方向一致[20-21]。研究表明AHI与人体神经生长因子分泌量呈负相关,AHI上升会导致神经生长因子缺乏,使机体受损的神经元不能得到修复,从而加重焦虑、抑郁[22]。夜间缺氧指标与焦虑、抑郁得分之间也有相关性,TS90%越大,夜间LSaO2越低,患者焦虑、抑郁症状越重,证实了缺氧损伤颅脑神经元是OSAHS引起心理异常的重要机制。既往研究认为慢性间歇性缺氧对大脑神经元的损伤程度远超短期缺氧损伤,TS90%能很好的反映整晚睡眠的缺氧情况,值越大代表缺氧的时间越长,对神经元损伤越大,相应心理症状加重[23]。而LSaO2作为夜间睡眠某一时刻的缺氧指标,虽不能准确反映整晚睡眠缺氧情况,但其在一定程度上反应了病情程度,病情越重其焦虑、抑郁越明显,这在本研究前后是一致的。焦虑、抑郁与MAI呈正相关,说明微觉醒会加重焦虑、抑郁,这与姜丹丹等[24]的结果一致。MAI反映的是睡眠片段化,睡眠周期的反复唤醒会导致患者不能顺利的进行睡眠循环,使非快速眼动睡眠(NREM)3~4期和REM期睡眠减少,而这两个睡眠阶段是维持人体正常心理的关键,该期睡眠时长的缩短不利于患者自身心理调节功能的恢复,促使焦虑、抑郁加重[25]。焦虑、抑郁得分与快动眼睡眠及深睡眠时间占比成负相关,这与Campabadal等[26]的结论一致。快动眼睡眠及深睡眠时间反应睡眠结构,既往研究认为合理的睡眠结构是心理调节功能恢复的基础,而快速眼动睡眠及深睡眠的剥夺会引起海马区钙调神经磷酸酶(CaN)活性下降,这会导致动物模型心理症状加重[27]。提示临床工作对OSAHS患者进行疗效评价时,需关注并优化睡眠结构。
综上所述,OSAHS患者心理异常的发生率高,症状重且类型复杂,关注OSAHS患者的心理状况并及时采取干预,在临床工作中具有一定的现实意义。但本研究仅仅分析出OSAHS患者存在心理异常,未能找到一种有效心理干预措施,这有待后续研究者进一步探讨。同时本研究选用主观自评量表作为测量工具,没有结合客观生物指标(神经递质分泌水平等),不能完全替代患者的客观心理。

