Meprin A、IL-1β与静脉丙种球蛋白无效型川崎病的关联性研究
陈铮洁,吴 菱,胡芳芳,应倩倩,狄亚珍,钟世玲
(1. 宁波大学医学院,浙江 宁波 315000;2. 宁波市妇女儿童医院 小儿风湿免疫科, 浙江 宁波 315000;3.宁波市第一医院 小儿风湿免疫科,浙江 宁波 315000)
川崎病(kawasaki disease, KD)又称皮肤黏膜淋巴结综合征,是主要累及中小型动脉的全身性血管炎,已经取代了风湿热成为儿童获得性心脏病的主要病因[1]。静脉丙种球蛋白(IVIG)是目前大家公认的治疗KD的一线药物,可将动脉瘤的风险从25%~30%,降至5%~7%[2]。据近期统计,IVIG-无效型KD的发生率呈上升趋势,并呈现出冠状动脉损害(coronary artery lesions, CAL)高风险[3]。KD患儿首次IVIG- 治疗效果欠佳, 是 KD 急性期治疗难点之一。目前KD丙种球蛋白抵抗的机制尚不明确,研究表明可能与遗传因素、炎性介质的作用(如IL-1β、IL-6等)及T淋巴细胞活化等相关[4-5]。金属蛋白酶Meprin A是炎症过程中重要的蛋白水解调节剂,可将IL-1β前体形式(pro-IL-1β)转变为有生物活性的IL-1β,引起炎症及组织损伤[6]。国外研究发现在冠状动脉炎小鼠模型的血清中发现Meprin A的水平显著升高[7]。因此, 本研究通过比较血清Meprin A、 IL-1β在KD丙种球蛋白使用前后的变化,旨在探讨Meprin A、 IL-1β在IVIG-无效型KD中的临床价值。
1 资料与方法
1.1病例选择 2016年12月至2019年3月在我院确诊的接受IVIG-标准化治疗KD患儿410例为试验组,纳入标准:诊断明确且资料完整的KD患儿,诊断标准参考AHA2017[8]。排除标准:合并有其他自身免疫性疾病、感染性疾病、肿瘤等。另外选取我院同期住院的上呼吸道感染的患儿201例作为对照组,排除自身免疫性疾病、其他感染性疾病、肿瘤等。两组患儿2周内均未给予激素、免疫抑制剂、IVIG治疗。所有试验组患儿均进行IVIG及阿司匹林治疗,根据IVIG治疗效果(首剂IVIG-治疗36 h,仍持续发热(>38 ℃),或给药后热退2~7 天甚至2周再发热,且至少具备l项KD主要表现者,定义为IVIG-无反应)分为IVIG-有效组(355例)和IVIG-无效组(55例)。本研究患儿的家属均签署知情同意书及获得医院医学伦理委员会批准,批准号【2018】伦审字(22)。
1.2检查项目 记录患儿的年龄、性别、临床特征以及首剂应用IVIG时间、热程等,同时记录实验室数据包括白细胞计数(WBC),血红蛋白(Hb),血小板计数(PLT),C反应蛋白(CRP),红细胞沉降率(ESR),丙氨酸转氨酶(ALT),白蛋白(ALB),高密度脂蛋白胆固醇(HDL-C)、NT-proBNP等。所有KD患儿入院时及随访8周内检测心脏彩色超声共3~4次。根据心脏超声提示:冠状动脉扩张或冠状动脉瘤,定义为冠状动脉损害(CAL)。
血清Meprin A、IL-1β检测:所有入组KD患儿在急性期(病程3~7 d)和缓复期(体温正常症状消失,病程2~3周)分别采取空腹静脉血4 ml,以3 000 r/min速率,离心10 min,分离出血清,保存于-80 ℃冰箱中待检。对照组患儿入院采集空腹静脉血2 ml,处理方法与KD组相同。取上述血清,分别使用Meprin A ELISA试剂盒及IL-1β ELISA试剂盒(分别购于BD公司)通过酶联免疫吸附法检测Meprin A及IL-1β水平。
1.3治疗方法 对KD患儿均提供IVIG治疗,IVIG-有效组及IVIG-无效组均采用同一公司生产的IVIG(成都蓉生药业有限公司,国药准字S19993042,50 ml:2.5 g/瓶),同时服用阿司匹林肠溶片(辰欣药业股份有限公司,国药准字H37023270,25 mg/片):首次治疗予IVIG- 2 g/(kg·次),联合阿司匹林30~50 mg/(kg·d),热退3 d后阿司匹林减量至3~5 mg/kg。IVIG-无效组:首次治疗予IVIG- 2 g/(kg·次),联合阿司匹林30~50 mg/(kg·d),无效再次予IVIG- 2 g/kg或激素2 mg/kg或IVIG- 2 g/kg加激素2 mg/kg,阿司匹林减量1/3~1/2,热退3 d后阿司匹林减量至3~5 mg/kg。

2 结 果
2.1KD组与对照组临床与实验室特点 410例KD患儿,男性226(55.1%),中位年龄2岁,最小3月,最大10岁;对照组201例,男性108(53.7%),中位年龄1.5岁,最小6月,最大10岁,两组性别、年龄差异均无统计学意义(P>0.05)。KD患儿急性期WBC、PLT、CRP、ESR、ALT、ALB、HDL-C、NT-proBNP、Meprin A及血清IL-1β水平均显著高于对照组(P<0.01),见表1。
2.2KD急性期与缓解期实验室指标变化 KD患儿急性期WBC、Hb、PLT、CRP、ESR、ALT、ALB、HDL-C、NT-proBNP、Meprin A及血清IL-1β水平均显著高于缓解期(P<0.01),见表2。

表1 KD组与对照组临床特征及实验室指标比较

表2 KD急性期与缓解期实验室指标比较(n=410)
2.3IVIG-有效组与无效组临床和实验室特点 410例KD患儿中IVIG-有效组355例(86.6%),男性193例(54.4%),中位年龄2.4岁;IVIG-无效型型有55例(13.4%),男性33例(60.0%),中位年龄2.4岁,两者之间性别、年龄差异无统计学意义(P>0.05)。与IVIG-有效组比较,IVIG-无效组首剂应用IVIG时间、热程较长,皮疹及结膜充血发生率较高,冠状动脉损害率更高(61.8%)(P<0.01);IVIG-无效组血清IL-1β、Meprin A水平均显著高于IVIG-有效组(P<0.01); IVIG-无效组及IVIG-有效组两组间WBC、CRP、ESR、NT-proBNP及MEP比较差异有统计学意义(P<0.01),而Hb、PLT、ALT、ALB、HDL-C比较差异均无统计学意义(P>0.05),见表3。

表3 IVIG-有效组与IVIG-无效组临床特征及实验室指标比较
2.4单因素进行ROC分析 在6项实验室指标中,血Meprin A曲线下面积最大(0.911),其次是NT-proBNP(0.831)及IL-1β(0.823),见图1。有统计学意义的临床指标及实验室指标对IVIG-无效型KD的诊断评价:NT-proBNP≥985.5 ng/L,预测IVIG-无效型KD的敏感性为74.5%,特异性为73.0%;Meprin A≥12.95 ng/ml,预测IVIG-无效型KD的敏感性为81.8%,特异性为89.6%;血清IL-1β≥4.05 pg/ml预测IVIG-无效型KD的敏感性为61.8%, 特异性为87.3%;当同时满足Meprin A≥12.95 ng/ml及IL-1β≥4.05 pg/ml时,预测IVIG-无效型KD的敏感性60%,特异性94.9%。见表4。
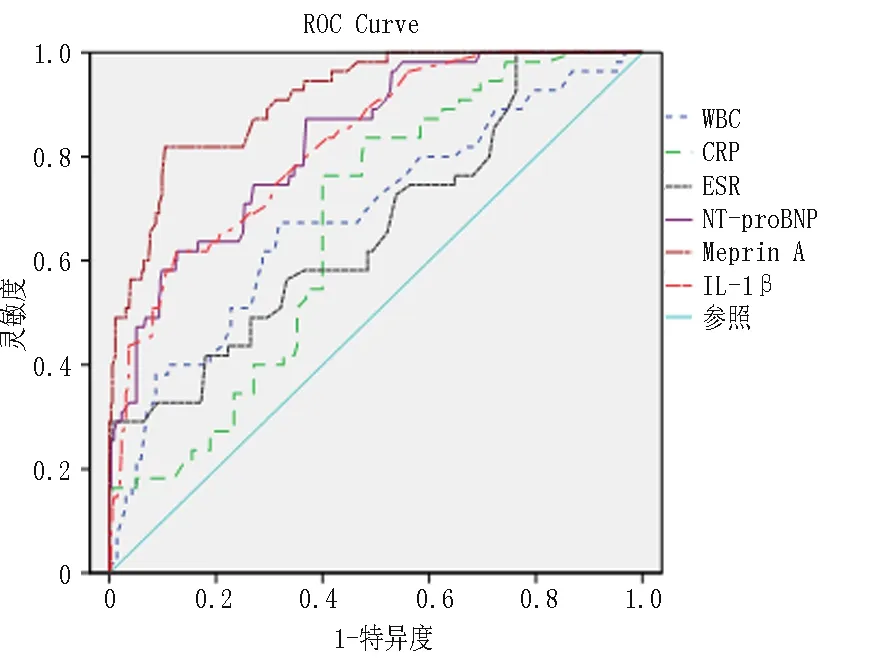
图1 6项指标ROC曲线
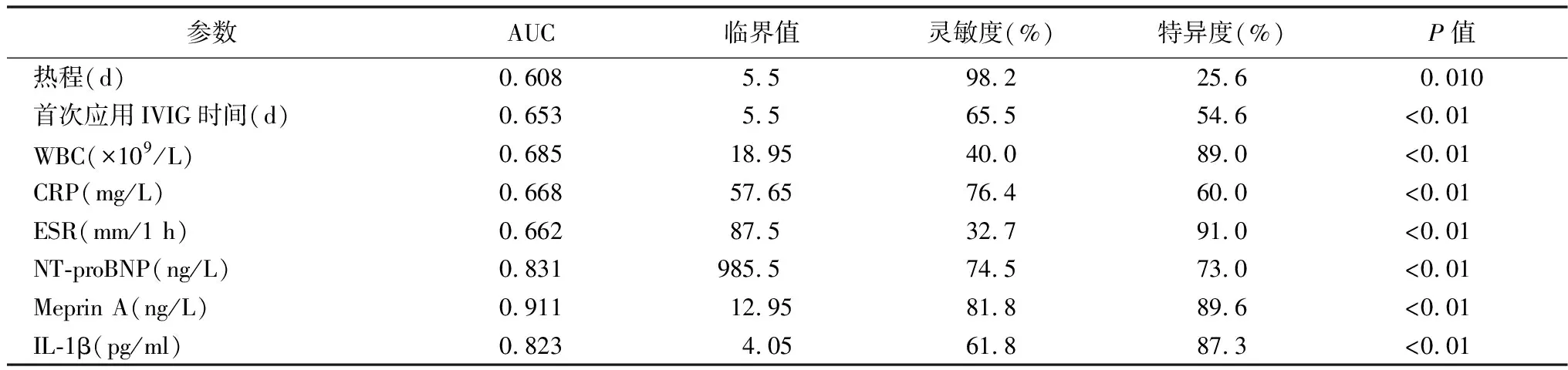
表4 临床指标(热程、IVIG应用时间)及实验室指标对IVIG无效型KD的诊断效能
2.5Meprin A与其他实验室指标的相关性分析 Spearman相关性分析发现Meprin A与IL-1β及NT-proBNP存在显著的相关(r=0.635,P<0.01;r=0.785,P<0.01), 与WBC、CRP、ESR有一定的相关(r=0.341,P<0.01;r=0.374,P<0.01;r=0.373,P<0.01), 而与Hb、PLT、ALT、ALB、HDL-C无相关性,见表5。

表5 Meprin A与其他实验室指标的相关性分析
3 讨 论
KD是一种主要发生于儿童的非特异性全身血管炎性疾病,好发于5岁以下婴幼儿,已成为儿童后天获得性心脏病的原因之一。IVIG是KD的标准治疗方法,可有效的缩短发热时间,减少全身炎症反应,减少冠状动脉病变的发生[9]。但研究表明,有5%~38.3%的KD患者可出现IVIG-无反应,且CAL作为KD 最常见且最严重的并发症,可能与IVIG-耐药有关[3]。本研究中IVIG无效型的发生率为13.4%,其中IVIG-无效组冠状动脉损害率高达61.8%。与IVIG-有效组比较,IVIG-无效组的CAL患病率增加了近5倍。IVIG-无效型KD冠状动脉损害的高风险,可能与IVIG-无反应KD炎症诱导更严重相关,但仍待进一步研究。
IVIG-无效型KD的发病机制尚不明确。目前认为IL-1β在KD的发病机制中起重要作用[10],抑制IL-1β途径以及阻断IL-1β信号传导可以抑制KD的发生发展[11]。本研究证实KD患儿急性期血清IL-1β水平明显高于对照组及缓解期(P<0.05),且与代表KD疾病活动性的实验室指标ESR、CRP、WBC正相关,或可作为评估疾病活动性的有效指标。同时还发现IVIG-无效组患儿血清IL-1β水平明显高于IVIG-有效组(P<0.05)。这提示IL-1β的水平可能决定对IVIG-的反应[4]。本研究再进一步发现当血清IL-1β≥4.05 pg/ml时预测IVIG无效型KD的敏感性及特异性均较高,因此推测IL-1β可作为IVIG无效型KD的预测指标之一。
在体外实验及死亡KD患儿的尸检中均发现冠状动脉炎中存在CD8+T细胞浸润[12-13]。同时研究还表明CD8+T淋巴细胞高度活化可能会引起IVIG的耐药[14-15],可见CD8+T细胞过度激活及其活化在IVIG-无效型KD发病及冠状动脉损害的机制中发挥了重要作用。有研究提示IL-1β负责抗原驱动的CD8+ T细胞的分化,增殖,记忆以及向包括冠状动脉壁在内的组织迁移[16-17]。因此,我们认为IL-1β可能通过介导CD8+T淋巴细胞活化的失衡及向冠状动脉的迁移,参与IVIG-无效型KD的发生及其冠状动脉损害。
本研究还发现KD患儿血清Meprin A水平明显高于对照组(P<0.01)。内脂酶Meprins是一种含锌金属肽酶,包含α及β两个亚单位,由不同的基因编码。Meprin A是α亚基(α-α)的同二聚物或α和β亚基的异二聚体(α-β)[18-19]。Meprins具有水解内源性生长因子、血管活性肽、细胞因子和细胞外基质的功能[6]。研究表明,Meprin A在冠状动脉粥样硬化及冠心病等心血管疾病患者外周血中表达增加[20]。Kentsis等[7]发现在KD患者急性期血清中及KD伴冠状动脉病变小鼠模型的冠状动脉组织中同样存在Meprin A水平升高,与本研究保持一致。同时通过对比KD患儿急性期及缓解期血清Meprin A水平,我们发现急性期血清中Meprin A表达明显升高,并与KD疾病活动性相关的实验室指标ESR、CRP、WBC呈正相关。且IVIG-无效组外周血循环中Meprin A的水平亦明显高于IVIG-有效组(P<0.001)。当血清Meprin A≥12.95 ng/L时预测IVIG-无效型KD的敏感性及特异性均较高,因此推测Meprin A不仅可作为KD患儿疾病活动性的指标之一,同时还可预测IVIG-无效型KD。
已有研究表明Meprin-A可将IL-1β前体形式(pro-IL-1β)转变为有生物活性的IL-1β,同时除了水解IL-6使其失活外,又可通过裂解细胞膜上的IL-6R产生sIL-6R介导IL-6反信号传递,促进炎症的发生发展[6]。IL-1β及IL-6高水平表达于在KD患儿外周血循环中,可能是KD致病及IVIG-无反应的重要炎性细胞因子。本研究发现Meprin A和IL-1β之间存在显著相关(r=0.635,P<0.01)。且当同时满足Meprin A≥12.95 ng/ml及IL-1β≥4.05 pg/m时,预测IVIG-无效型KD特异性可高达94.9%。故推测Meprin A可能通过调节炎症介质如IL-6途径的失衡及IL-1β的进一步释放,参与IVIG-无效型KD的发生及发展。
综上所述,Meprin A、IL-1β可能参与KD的致病过程,不仅可作为KD疾病活动性的良好指标,且可较好预测IVIG-无效型KD。当然我们仍需要进一步扩大样量,建立组织细胞水平,分子水平实验,进一步深入探讨Meprin A、IL-1β在IVIG-无效型KD中的发病机制,以期能指导临床。

