银杏内酯A的BCS分类及吸收机制研究△
李楠楠,劳元圣,高尧春,李楠,张梦雪,黎迎,刘海波,董政起*
1.哈尔滨商业大学 生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;2.中国医学科学院 药用植物研究所,北京 100193
银杏内酯是银杏叶主要成分,包括银杏内酯A、B、C、J和M(GKA、GKB、GKC、GKJ、GKM)等[1],银杏内酯具有抗炎、抗氧化、改善脑缺血以及神经保护作用[2],对中枢神经系统的作用[1],拮抗血小板活性因子PAF作用[3]等。银杏内酯注射液主要成分有白果内酯、银杏内酯A、银杏内酯B和银杏内酯C[4]。目前,银杏内酯注射液使用较为广泛,但有研究表明其存在严重胃绞痛或周身疼痛、过敏等不良反应[5]。口服制剂能够在帮助提高患者适用性的同时降低不良反应,因此本实验拟以银杏内酯A为模型药物,建立以溶解性和渗透性为指标的系统、快速、准确评价药物口服生物利用度的方法,同时分析目前市面上没有银杏内酯口服剂型的原因,并为下一步开发提供科学依据。
1 材料
1.1 仪器
Waters ACQUITY UPLC;电热恒温水浴锅(HHS型,上海博讯实业有限公司);旋涡振荡器(VORTEX-5型,海门市其林贝尔仪器制造有限公司);CO2培养箱(INC108型,德国MEMMERT公司);倒置显微镜(GX51型,奥林巴斯公司);超净台(SCB-1220型,北京东联哈尔仪器制造有限公司);微量振荡器(MM-1型,金坛市正基仪器有限公司);全自动跨膜电阻测量仪(德国Nanoanalytics公司);高压灭菌罐(DY2009X-032-00,上海博讯实业有限公司);酶标仪(Spectra max型,美国MD公司);药物渗透性检测仪(PAMPA-Evolution)。
1.2 细胞
Caco-2细胞(北京协和医学院基础医学研究所细胞中心)。
1.3 试药
银杏内酯A(成都曼斯特生物科技有限公司,批号:MUST-18031502,纯度:99.70%);荧光素钠(Coolaber公司,批号:518-47-8,纯度:98%);MEM/EBSS(Hyclone Thermo公司,批号:AC1214569);非必需氨基酸(Gibco公司,批号:1896361);胰酶(Gibco公司,批号:1933273);双抗(Gibco公司,批号:1851595);胎牛血清(Gibco公司,批号:1856032);二甲基亚砜(Sigma 公司,批号:SHBG3288V);Hank′s溶液(Solarbio公司,批号:20180713);MTT(Amresco公司,批号:298-93-1);12孔Transwell TM培养板(1.12 cm2,0.4 μm,Corning公司,批号:34717041);96孔细胞培养板(Corning公司,批号:15718601);T-25细胞培养瓶(Corning公司,批号:35216601);乙腈(色谱纯,德国默克公司,批号:75-05-8);甲醇(色谱纯,德国默克公司,批号:67-56-1)。
2 方法
2.1 样品的制备
精密称取银杏内酯A对照品10.4 mg置于0.5 mL EP管中,加入二甲基亚砜(DMSO)配成质量浓度为100 mg·mL-1的银杏内酯A对照品溶液。
2.2 银杏内酯A定量检测
色谱条件:ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);保护柱(VanGuardTMPre-Column 3/Pk,5 mm×2.1 mm Column);流动相为水-甲醇(55∶45);检测波长为220 nm;流速为0.2 mL·min-1;柱温为30 ℃;进样量为2 μL;检测器为H-class PDA。
线性关系考察:精密吸取银杏内酯A对照品溶液,用甲醇稀释成质量浓度分别为200、100、50、20、10、5、2、1 μg·mL-1的溶液,混匀后0.22 μm滤膜过滤,进样20 μL,按2.2中的色谱方法进行定量分析,以质量浓度为横坐标(X),峰面积为纵坐标(Y),得线性回归方程:Y=26 436X+49 759(r=0.999 7)线性范围为1~200 μg·mL-1。
精密度与回收率考察:选择25、50、100 μg·mL-1低、中、高3个质量浓度的银杏内酯A样品,测定5次,计算日内精密度RSD 1.08%<2%。每天使用新配制的25、50、100 μg·mL-1低、中、高3个质量浓度的银杏内酯A样品,连续3 d,计算日间精密度RSD为1.03%<2%。说明该分析方法的精密度符合方法学要求。按精密度实验操作,计算求得实测质量浓度,与理论质量浓度比较得到方法的回收率为98.6%,RSD为1.12%<2%,说明该分析方法的回收率符合方法学要求。
2.3 软件预测
实验采用MOE、Discovery Studio、StarDrop 3种软件对银杏内酯A进行预测,分别得出溶解性(lgS、lgP、lgD、ADMET_Solubility_Level)、渗透性(HIA category、ADMET_Absorption_Level)及P-gp底物判断等相关参数对银杏内酯A生物药剂学属性进行预测。
2.4 银杏内酯A溶解性实验
根据美国食品药品监督管理局(FDA)工业指导原则[6]:称取银杏内酯A溶于水(pH 5.8)、pH 1.2、4.0、6.8缓冲液中,使药物达到饱和状态,置于37 ℃摇床振荡3 h,30 000 r·min-1离心25 min(离心半径:5 cm),取上清液10 μL,适当稀释后,按2.2色谱条件检测药物浓度,重复3次,计算溶解度及D0值。
D0=(M0/V0)/Cs
(1)
式中:M0为人的最大给药剂量(mg),V0为250 mL,Cs为溶解度(mg·mL-1)。
本实验主要根据动物与人之间的等效剂量换算方法[7]来计算银杏内酯A的M0,根据文献[8]中兔的最大给药量剂量为10.64 mg,因此可得人的最大给药剂量为89.04 mg。
《中华人民共和国药典》(2015版)的溶解性测定方法[9]:精密称取药物10 mg置于具塞离心管中,加入5 mL蒸馏水,样品试管置于37 ℃水浴,每5 min振荡30 s,观察30 min内的溶解情况,充分混匀后取出部分溶,并用HPLC分析银杏内酯A的含量。
2.5 银杏内酯A的细胞毒性实验
每孔1×105个/mL的Caco-2细胞悬液接种在96孔细胞培养板,每孔100 μL。其中2组为空白组和阴性对照组,培养箱中培养24 h,弃去废液并向其中加入用不完全培养基配制的不同质量浓度的银杏内酯A溶液,每孔100 μL,培养12 h。取出培养板,每孔加20 μL质量浓度为5 mg·mL-1MTT溶液(MTT采用PBS配制),继续培养4 h,弃废液,然后向其中加入150 μL的DMSO溶液,置于摇床低速振荡10 min,将其放于酶标仪中检测各孔在570 nm处的吸光度值(A),计算细胞抑制率,本实验选取抑制率低于10%的高、中、低3个质量浓度进行转运实验。
细胞抑制率=[(A阴性对照组-A空白组)-(A实验组-A空白组)]/(A阴性对照组-A空白组)×100%
(2)
2.6 银杏内酯A渗透性实验
2.6.1 Caco-2细胞模型的建立及转运实验 首先用含1%非必需氨基酸、1%双抗、10%胎牛血清的MEM培养基复苏Caco-2细胞,然后将其置于37 ℃、5%CO2、90%湿度的培养箱中培养,隔天换液,培养3~5 d,长至80%~90%程度,进行传代。在细胞传3~4代将其冻存保存在液氮中,便于下次使用。
取40~60代长至80%~90%的Caco-2细胞每孔2×105个/mL的细胞悬液接种在12孔Traswell细胞培养板上,顶端(AP)侧加0.5 mL的细胞液,底端(BL)侧加1.5 mL的细胞液,隔天换液,培养至19~21 d,并且隔天使用全自动跨膜电阻测量仪测试细胞TEER值。
21 d时,开始进行转运实验,首先吸出两侧培养液,加入Hank′s溶液清洗1遍,然后再加Hank′s溶液在培养箱中孵育20 min,取出检测其TEER值>500 Ω进行实验,在AP侧加入不同浓度的药物溶液,BL侧加入空白Hank′s溶液,在15、30、60、90、120、150、180 min的不同时间段在BL侧取200 μL的样品,同时在相同的位置补充200 μL空白Hank′s溶液,实验结束后再次测试细胞TEER值。将样品前处理后按照2.2的色谱条件在超高效液相色谱(UPLC)中进行含量测定,计算其表观渗透系数(Papp)。
Papp=(dQ/dt)/(A×C0)
(3)
其中,dQ/dt(μg·s-1)为药物单位时间转运量,C0(mg·L-1)为药物在供给室的初始质量浓度,A(1.12 cm2)为转运膜面积。
2.6.2 吸收机制研究 在建立好的Caco-2细胞模型中取高、中、低3个质量浓度的银杏内酯A溶液和含有维拉帕米的银杏内酯A溶液进行双向转运实验,在AP侧加入0.5 mL的药物溶液,同时在BL侧加入1.5 mL的空白Hank′s溶液作为接收液,在15、30、60、90、120、150、180 min的不同时间段在BL侧取200 μL的样品,同时在相同的位置补充200 μL空白Hank′s溶液。另外,在BL侧加入1.5 mL的药物溶液,同时在AP侧加入0.5 mL的空白Hank′s溶液作为接收液,在15、30、60、90、120、150、180 min的不同时间段在BL侧取200 μL的样品,同时在相同的位置补充200 μL空白Hank′s溶液。将所取样品与UPLC进行含量测定,分析药物在AP→BL与BL→AP的不同转运中药物转运与药物浓度及时间的关系以及药物是否是P-gp底物。
2.6.3 PAMPA模型的建立及转运实验 模型建立:取配制好的磷脂溶液加在平行人工膜渗透性(PAMPA)模型的疏水网膜表面上,供室马上加入200 μL含药物的Hank′s溶液,受室加入200 μL Hank′s溶液,整个加药过程在10 min内完成。间隔30 min在供室取100 μL溶液,按2.2的色谱条件进行含量测定,计算其有效渗透率(Pe)。
Pe=-ln[1-(CA(t)/Cequilibrium]/A×(1/VD+1/VA)×t
(4)
Cequilibrium=[CD(t)×VD+CA(t)×VA]/(VD+VA)
(5)
其中,A表示人工磷脂膜面积(0.32 cm2),VD表示供体侧的体积(mL),VA表示受体侧的体积(mL),t表示渗透时间(min),CA(t)表示在t时间内受体液的质量浓度(mg·mL-1),CD(t)表示t时间内供体液的质量浓度(mg·mL-1)。
3 实验结果
3.1 软件预测的结果
在软件MOE预测结果中,lgP为0.259 7,h_lgS为-2.865,lgS为-3.26,根据FDA中的高溶解度大于或等于85%的药物,在软件中高溶解度药物的lgS的范围在-1~5,可以表明银杏内酯A为难溶性药物;在软件Discovery Studio预测结果中,在软件中可以根据ADMET_Solubility_Level对药物的水溶性高低进行判断,预测结果显示ADMET_Solubility_Level为3,ADMET_Absorption_Level为3,lgD为-0.921,ADMET_Solubility_Level>0的范围内表明药物的水溶性过高表明银杏内酯A水溶性好,ADMET_Absorption_Level为3时表明化合物在肠道内的吸收情况差;在StarDrop软件预测结果中,lgS为2.013,HIA category为“+”, P-gp category为“no”, 其中HIA表示肠道吸收,为“+”时,代表药物吸收>30%,因此预测银杏内酯A的结果为溶解性为微溶,药物吸收>30%,不受P-gp调控。其中软件MOE预测的溶解度结果与实验结果较为一致。
3.2 溶解性结果
根据美国FDA的检测方法,银杏内酯A在pH 1.2、4.0、6.8及水中的D0值分别为25.38、26.66、66.46、59.46,可以得出其D0值均大于1,因此可以判断其为低溶解性药物。根据《中华人民共和国药典》(2015版)的溶解性测定方法[9]:银杏内酯A在水中溶解度为0.006 g·mL-1,小于极微溶的标准0.01 g·mL-1,因此银杏内酯A为极微溶。
3.3 银杏内酯A的细胞毒性
采用MTT法检测不同浓度的银杏内酯A对Caco-2细胞存活率的影响,见图1。

注:与阴性对照组相比,*P<0.05,**P<0.01,***P<0.001。图1 MTT法检测不同浓度银杏内酯A的Caco-2细胞存活率
因此实验取细胞存活率>90%的高、中、低3个质量浓度为300、400、500 μg·mL-1进行实验。
3.4 药物渗透性的实验结果
3.4.1 渗透性判断 实验主要以Papp为14.96×10-6cm·s-1为临界值[10]对银杏内酯A的渗透性高低进行判断,AP→BL转运实验中银杏内酯A的Papp为8.04×10-6~13.99×10-6cm·s-1,小于该值,因此判断银杏内酯A属于低渗透性药物。
3.4.2 吸收机制 根据图2~4,可得出银杏内酯A在AP→BL与BL→AP侧的转运量伴随着时间逐步增加且在3 h内没有饱和,说明对时间具有一定的依赖性,在30 min中后不同浓度组的趋势不同,其中高浓度组较中浓度组在同一时间段内它的转运量在AP→BL与BL→AP侧明显增加,推测银杏内酯A以被动转运为主。由于BL→AP侧高、中、低浓度组在不同的时间点它们的转运量差异不大,通过对高、低2个浓度组在AP→BL侧的比较,可以得出它们的双向转运Papp:低浓度>高浓度,随着给药浓度的增加,转运速率反而减小,因此推测转运过程中可能存在主动转运的参与,从而导致Papp计算公式中的分子部分增加幅度减小,而高浓度时分母C0较大,从而导致转运速率在低浓度时较高。高、中、低3个浓度的外排系数(ER)分别为1.11、1.27、0.85,均小于1.5,说明银杏内酯A以被动转运为主。且双侧转运的Papp均小于14.96×10-6cm·s-1,说明银杏内酯A为低渗透性药物。
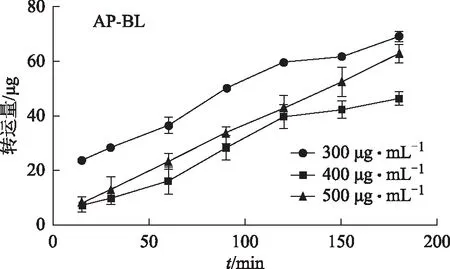
图2 银杏内酯A的AP→BL方向的转运量随时间和浓度的变化
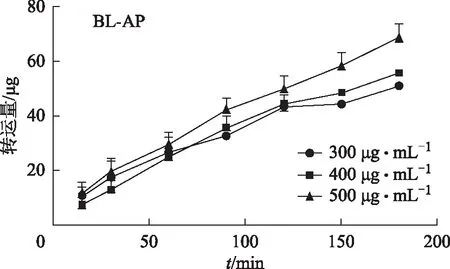
图3 银杏内酯A的BL→AP方向的转运量随时间和浓度的变化
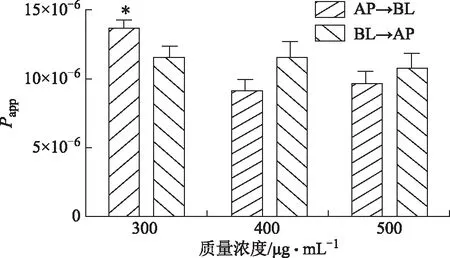
注:n=3,*P<0.05。图4 银杏内酯A的Papp在不同浓度不同方向的变化
P-gp是可以将药物从AP侧转运到BL侧的一种外排蛋白,主要存在于肠道细胞中[10]。根据图5可以得出,银杏内酯A与含有同等浓度的维拉帕米相比较,它们的Papp差异不大,且P>0.05,差异无统计学意义,说明添加P-gp抑制剂维拉帕米后,对实验组的银杏内酯A的转运速率无影响,说明银杏内酯A的转运不受P-gp的调控,银杏内酯A不是P-gp的底物。

注:n=3,P>0.05。图5 维拉帕米对银杏内酯A转运的影响
3.4.3 PAMPA膜的渗透性实验结果
荧光素钠试漏:样品取样结束后,吸出供体液,向其中加入2 mg·mL-1的荧光素钠溶液,在酶标仪中进行检测。根据图6样品与空白Hank′s溶液的A值无明显差异,说明无药物渗透,膜完整性良好。
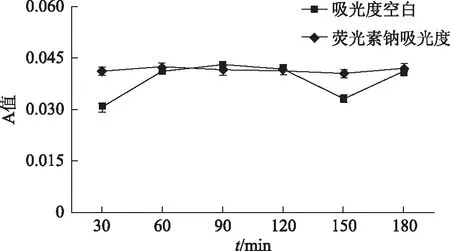
图6 荧光素钠A值与空白Hank′s溶液的A值比较
根据图7~8可得出银杏内酯A的转运量是随着时间的增加而增加,并且在3 h之内未出现饱和状态,说明具有一定的时间依赖性。比较高、中、低3组浓度的Pe差异均无统计学意义,可以判断其为被动转运。同时吸收良好的药物的Pe>10-6cm·s-1;吸收为1%~100%的药物的Pe为0.1×10-6~1×10-6cm·s-1;而吸收差的药物(即吸收<1%)的Pe<10-6cm·s-1,银杏内酯A的Pe均小于1×10-6cm·s-1,说明银杏内酯A为低渗透性药物。
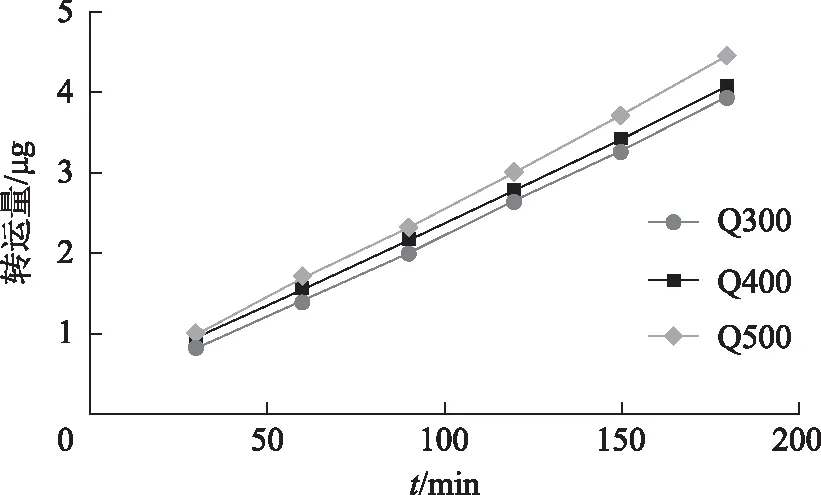
图7 银杏内酯A转运量随时间和浓度的变化

注:n=3,**P<0.01。图8 银杏内酯A的Pe在不同浓度的变化
4 结论
D0值和水中溶解度结果证明银杏内酯A为难溶性药物,Caco-2细胞及PAMPA膜转运实验结果表明银杏内酯A为低渗透性药物。根据Amidon等[11]于1995年提出的生物药剂学分类系统理论,综合判定,银杏内酯A为BCSⅣ类药物,溶解性和渗透性差是导致其口服生物利用度低的重要因素。此外,银杏内酯A的转运不受P-gp的调控,吸收机制以被动转运为主。MOE软件在预测银杏内酯A溶解性时,结果更为准确;StarDrop软件在预测银杏内酯A与P-gp相关性上也得出较为准确的结论。
5 讨论
实验从药物的溶解度和渗透性两方面展开。溶解度方面,根据美国FDA指导原则,计算其D0值,均大于1表明银杏内酯A为低溶解性药物;根据《中华人民共和国药典》的溶解度划分,银杏内酯A为难溶性药物。软件MOE、Discovery Studio、StarDrop在预测银杏内酯A的溶解性时,结果分别为难溶、易溶、微溶,相差较大,与实验结果不相符,一方面可能因为有的软件更适合预测大分子化合物,另一方面可能是软件预测主要考虑其化学结构并没有实际考虑到化学结构中的羟基在不同pH条件下发生反应,改变原有结构。软件预测可以高效简便的判断出药物的性质,但是可能与实际有所出入,软件预测仅可以作为判断的一个指标,不能作为判断的主要依据。
在渗透性方面,本实验主要采用Caco-2单层细胞模型和PAMPA模型。在Caco-2单层细胞模型中,AP→BL转运实验中银杏内酯A的Papp为8.04×10-6~13.99×10-6cm·s-1,在BL→AP转运实验中银杏内酯A的Papp为11.79×10-6~12.95×10-6cm·s-1,Volpe等[12]通过对Caco-2细胞单层模型的实验,以23个模型药物为标准,研究其Papp与其通过人体小肠吸收fa值比较,验证了BCS评价标准,因此建立以Caco-2细胞模型培养21 d时的药物转运渗透性高低评价标准,临界Papp为14.96×10-6cm·s-1。同时相关文献也有以Papp<1.0×10-6cm·s-1为吸收性差,Papp在1.0×10-6~10×10-6cm·s-1为吸收中等,Papp>10×10-6cm·s-1为吸收性好。本实验主要以Papp为14.96×10-6cm·s-1为临界值,银杏内酯A属于低渗透性药物,但是以另一个标准银杏内酯A属于高渗透性药物。在PAMPA模型中,其Papp为2.45×10-6~3.42×10-6cm·s-1,因此银杏内酯A属于低渗透性药物。综合结果判断银杏内酯A为低渗透性药物。通过细胞模型可以判断其为被动转运,因此Caco-2单层细胞模型应用更为广泛,各种规定更加完善,PAMPA模型操作更为简单快捷,且耗时短,但由于所用的磷脂膜没有蛋白的存在,更适合用于被动转运为主的药物。
实验以银杏内酯中的主要成分之一的银杏内酯A为模型药物进行研究,结果表明其渗透性较差,在其他剂型上应用具有一定的局限性。银杏内酯A结构中存在羟基可能是影响其渗透性的原因,有研究表明对羟基进行甲基化修饰可以提高具有羟基取代化合物的渗透性[13];透膜过程中氢键能力越强,滞留时间就越长也是渗透性低的原因之一[14],可以减轻氢键能力增加其渗透性。难溶性药物制备成固体分散体、纳米制剂等,均是提高其溶解度的有效方法[15]。
实验通过软件预测、美国FDA指导原则、《中华人民共和国药典》的溶解度方法、Caco-2单层细胞模型和PAMPA模型系统的对银杏内酯A的渗透性研究进行其BCS分类找出其生物利用度低的主要原因,为快速评价药物基于生物药剂学属性的成药性,进而针对性地提高生物利用度的研究提供支撑。

