中药注射剂种类及其处方饮片的原料药材统计分析△
郝利军,梁爱华,宋经元,3*
1.中国医学科学院 北京协和医学院 药用植物研究所/国家中医药管理局中药资源保护重点研究室,北京 100193;2.中国中医科学院 中药研究所/中药鉴定与安全性检测评估北京市重点实验室,北京 100700;3.中药资源教育部工程研究中心,北京 100193
中药注射剂是指以中医基础理论为指导,采用现代科学技术和方法,从中药或天然药物的单方或复方提取的有效物质制成无菌溶液、乳状液、混悬液或临用前配成液体的无菌粉末、浓溶液等注入人体的制剂[1]。其给药途径多样,包括皮内注射、皮下注射、肌内注射、静脉注射、脊椎腔注射、穴位注射、局部病灶注射等,能满足不同病症的需求。中药注射剂将传统医药理论与现代生产工艺相结合,临床上适合危重病人的抢救,生产工艺上可大规模机械化生产,是中药现代化的重要产物[2]。原料药材经过炮制制成饮片后,方可用于中药注射剂的生产,文中原料药材均指中药注射剂处方饮片的原料药材。
自20世纪40年代第一个中药注射剂问世至今[3],历经近80年的发展,国家食品药品监督管理局南方医药经济研究所米内网数据显示,中药注射剂销售总规模已达千亿元,是我国医药事业的重要组成部分。但中药注射剂大多数品种都获批于1985年之前,临床有效性、安全性数据不足,近年来不良反应事故频发[4-5],引发了患者对中药注射剂安全性的担忧。
中药注射剂种类较多,国家药品监督管理局(NMPA)数据显示,截至2019年2月22日,当前中国已上市中药注射剂共有134种,其处方饮片的原料药材亦分布广泛,品种繁多,且目前尚无关于原料药材的统计分析研究,原料药材的监督与管理工作存在一定困难,这给中药注射剂的安全性带来较大隐患。本研究系统分析了已上市中药注射剂、2017年中国城市公立医院13个畅销中药注射剂以及《中华人民共和国药典》(以下简称《中国药典》)收录中药注射剂的种类及原料药材,以期为中药注射剂安全性、有效性再评价以及原料药材的生产销售提供参考。
1 资料与方法
1.1 已上市中药注射剂
信息来源于国家药品监督管理局网站(http://www.nmpa.gov.cn/WS04/CL2042/),在首页【药品】【药品查询】【国产药品】【中药】项下检索统计。
1.2 2017年中国城市公立医院13个畅销中药注射剂
信息来源于国家食品药品监督管理局南方医药经济研究所米内网数据库(http://shuju.menet.com.cn/NEWVIPZone/KKSearch/kkSearchIndex.jsp)。
1.3 《中国药典》收录中药注射剂
信息来源于2015版《中国药典》一部。
1.4 原料药材说明
根据中药注射剂名称查询国家食品药品监督管理局发布的说明书范本及修订版本、地方药监局备案的说明书、厂家公布的说明书、新药转正标准中的说明书等数据,统计各中药注射剂的成分、给药方式、功能主治和处方饮片的原料药材。
2 结果
2.1 已上市中药注射剂
截至2019年2月22日,在国家药品监督管理局网站首页【药品】【药品查询】【国产药品】【中药】的内容列表中以“注射”为关键词搜索,共有979条记录,除去2个名称有“注射”的生产厂家、1个护肝宁胶囊。剩余976个条目中,经统计中药注射剂共有134种,涉及批准文号976个,由于表格数据较大,本研究未提供。
2.1.1 原料药材数量 统计原料药材数量,表1显示134种中药注射剂中,1味原料药材的中药注射剂76种,占比56.7%。仅有少部分中药注射剂处方饮片的原料药材在6味及6味以上(7.5%),原料药材数量最多有 12味(清热解毒注射液)。

表1 已上市中药注射剂处方饮片的原料药材数量汇总
2.1.2 功能主治 对134种中药注射剂的功能主治统计汇总见图1。图1显示用于治疗心脑血管疾病的中药注射剂最多,其次是呼吸系统疾病、肿瘤疾病、骨骼肌肉系统疾病用药。
以治疗心脑血管疾病、呼吸系统疾病、肿瘤疾病、骨骼肌肉系统疾病、感染类疾病的中药注射剂为研究对象,统计原料药材种类及使用频率,见表2。结果显示,治疗心脑血管疾病常用丹参、红花和灯盏细辛;呼吸系统疾病常用金银花、连翘和黄芩;肿瘤疾病常用黄芪和人参;感染类疾病常用金银花和板蓝根。
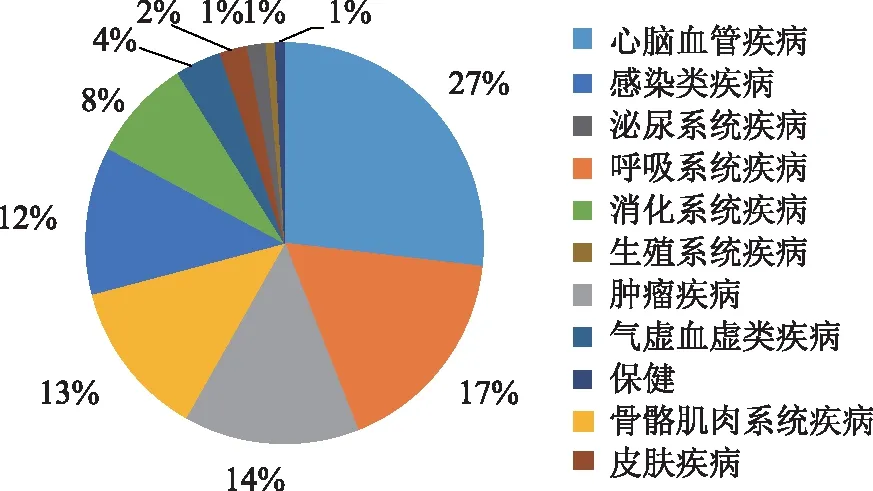
图1 中药注射剂分类(功能主治)
2.1.3 批准文号数量 药品批准文号是药品监督管理部门对特定生产企业按法定标准、生产工艺和生产条件对某一药品的法律认可凭证,每一个生产企业的每一个品种都有1个特定的批准文号。将中药注射剂根据批准文号数量从多到少进行排序,见表3。其中香丹注射液和鱼腥草注射液分别有114和111个批准文号,柴胡注射液和丹参注射液分别有77和73种,其他的注射剂批准文号都在50种以下,且近一半中药注射剂为独家品种,批准文号只有1个。
以表3中批准文号数量较多的20种中药注射剂为研究对象,分析原料药材使用情况,表4显示,金银花、黄芩、丹参使用频率最高,三七、板蓝根、红花、人参、麦冬、栀子、川芎次之。
2.1.4 中药有效部位或单一化合物组成的中药注射剂 中药有效部位是指从中药中提取的一类或几类化学成分的混合体,其可测定物质的含量达到总提取物的50%以上,且这一类或几类已知化学成分被认为是有效成分[6]。统计整理当前中国已上市、由中药有效部位或单一化合物组成的中药注射剂见表5。

表2 5类中药注射剂处方饮片的原料药材使用频率

表3 批准文号数量前20位中药注射剂汇总

表4 批准文号数量前20位中药注射剂处方饮片的原料药材使用频率
表中共有32种中药注射剂,占总体的24%。原料药材数量消痔灵注射液和芍倍注射液有2种,但两者均含有其他非天然来源的化合物,其他中药注射剂原料药材数量都为1种。功能主治方面治疗心脑血管疾病的中药注射剂最多,为20种,而全部心脑血管疾病用药的中药注射剂共有36种,56%的高占比说明用于治疗心脑血管疾病的中药注射剂研究发展被重点关注。肿瘤疾病用药有7种,运动系统疾病用药和消化系统疾病用药分别为4种和1种。静脉滴注和肌内注射给药的中药注射剂数量分别为22和13种(部分中药注射剂2种给药方式均可)。此外,虽然是由中药有效部位或单一化合物组成的中药注射剂,其成分大多仍是复杂化合物,如丹参多酚酸盐注射液的成分丹参多酚酸盐(由丹参经提取精制的多酚酸盐类化合物制备而成,其中丹参乙酸镁达80%以上),注射用血栓通(冻干)的成分三七总皂苷,益母草注射液的主要成分益母草总生物碱。单一化合物组成的中药注射剂如灯盏花素葡萄糖注射液等并不多见。国家最新发布了《中共中央国务院关于促进中医药传承创新发展的意见》中提到:“加强中药注射剂不良反应监测。推进中药企业诚信体系建设,将其纳入全国信用信息共享平台和国家企业信用信息公示系统,加大失信联合惩戒力度。完善中药质量安全监管法律制度,加大对制假制劣行为的责任追究力度”。体现了国家对降低中药注射剂不良反应的要求,有效部位或单一化合物组成的中药注射剂杂质相对较少,而杂质难以除净正是中药注射剂不良反应的主要诱因之一。

表5 中药有效部位或单一化合物组成的中药注射剂

续表5
2.2 2017年中国城市公立医院13个畅销中药注射剂
查询国家食品药品监督管理局南方医药经济研究所米内网数据库,2017年中国城市公立医院终端20个畅销中成药中除去百令胶囊、脑心通胶囊、复方丹参滴丸、蒲地蓝消毒口服液外其他16种均为注射剂,占比高达80%。其中丹参川芎嗪注射液、参芎葡萄糖注射液、丹参酮ⅡA磺酸钠注射液中虽然有中药成分,但分类是化学药品,以其余13种中药注射剂为研究对象,查询各中药注射剂的成分,统计原料药材,查询其给药方式及功能主治并对其进行分类,见表6。

表6 2017年中国城市公立医院13个畅销中药注射剂
2.2.1 原料药材数量 统计表6原料药材数量得到表7,结果显示,13种中药注射剂处方饮片的原料药材数量最多不超过5味,与NMPA数据相符,1味和2味原料药材的中药注射剂占总数的一半以上。

表7 2017年中国城市公立医院13个畅销中药注射剂处方饮片的原料药材数量统计
13种中药注射剂处方饮片的原料药材使用最多的是黄芪,有4次,丹参次之,有3次,但需注意的是丹参川芎嗪注射液、参芎葡萄糖注射液虽然被分类为化学药品,其成分中也包括丹参,而丹参酮ⅡA磺酸钠注射液的主要成分也是从丹参中分离所得。之后的人参和红花各出现2次,见图2。
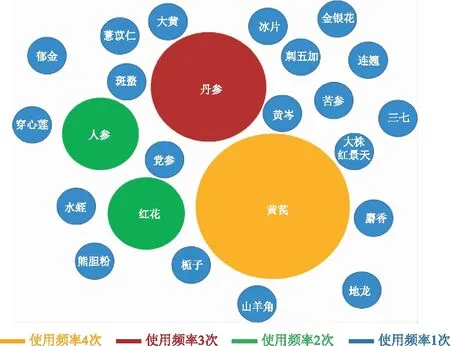
图2 2017年中国城市公立医院13个畅销中药注射剂处方饮片的原料药材使用情况
2.2.2 功能主治 统计表6中药注射剂的功能主治,发现13种中药注射剂,有46%用于治疗心脑血管疾病,肿瘤疾病用药占31%,之后是呼吸系统疾病用药,与NMPA统计所得数据相符。

表8 2017年中国城市公立医院13个畅销中药注射剂适应证
3 2015版《中国药典》收录中药注射剂
1963版《中国药典》第一次收录了中药注射剂,但被分类为化学药品部分,之后的1977版《中国药典》收录了24种中药注射剂,迄今为止仍是历史之最,且复方中药注射剂第一次出现。紧随其后的1983版《中国药典》仅收录1种盐酸麻黄碱注射液,之后1990版《中国药典》未收录,1995版《中国药典》收录止喘灵注射液,2000版《中国药典》在止喘灵注射液基础上新增注射用双黄连(冻干),2005版《中国药典》又新增了清开灵注射液、灯盏细辛注射液,2010版《中国药典》新增注射用灯盏花素,2015版《中国药典》收录情况同2010版,共收录5种:止喘灵注射液、注射用双黄连(冻干)、灯盏细辛注射液、清开灵注射液、注射用灯盏花素[7]。查询各中药注射剂的成分、给药方式、功能主治和处方饮片的原料药材并对其进行分类,汇集整理见表9。

表9 2015版《中国药典》中药注射剂汇总
由表9可知,1味原料药材的中药注射剂有2个,3味和4味各1个,清开灵注射液有7味原料药材。《中国药典》收录的5种中药注射剂除灯盏细辛注射液可直接静脉注射外,其他4种都是肌内注射。原料药材中灯盏细辛、金银花、连翘、黄芩使用频率为2次,其他为1次。功能主治方面,止喘灵注射液和注射用双黄连(冻干)用于呼吸系统疾病,灯盏细辛注射液和注射用灯盏花素用于心脑血管疾病,与NMPA和米内网的数据相符。
4 讨论
4.1 原料药材数量及给药方式
在欧盟等国,植物药制剂一般由单味药制成,复方制剂的药味也多在2~3 味,不超过5 味为其基本要求[8]。根据表1原料药材数量数据作图,同时分析原料药材数在5味及以上的17种中药注射剂的给药方式。图3显示,单一药味的中药注射剂超过一半,药味数量在3味及以下的中药注射剂超过80%,8味及以上的中药注射剂有4种,只占总数不到3%。说明多数中药注射剂成分相对单一,成分复杂的中药注射剂只占很少部分。崔宏玉等[9]研究发现,原料药材数量与不良反应报告数间无明显关系,分析可能是原料药材数量多的中药注射剂应用较少的原因。中药注射剂直接以饮片而非单一化合物制备,其成分复杂多样,因此原料药材以1味或2味居多,一方面其质量易于控制,另一方面成分相对简单也可避免不良反应的发生。原料药材在5味及以上的中药注射剂共17种,其中14种可以肌内注射,6种可以静脉滴注,只有1种可以静脉注射(血必净注射液)。原料药材7味及以上的除了注射用清开灵(冻干)外其他5种都是只能肌内注射。崔宏玉等[9]研究发现,静脉注射比肌内注射更容易产生不良反应,而且产生严重不良反应的风险比肌内注射高,复杂成分中药注射剂采用肌内注射,旨在降低不良反应的发生率。

图3 中国已上市中药注射剂原料药材数量汇总
4.2 原料药材质量不稳定且标准待完善
中药注射剂不良反应的主要原因之一是药材本身的问题,一方面产地气候、采摘季节不同等因素造成药材质量参差不齐。如应用于心脑血管疾病的原料药材丹参,林佳等[10]对不同地区、不同生长方式的13 个丹参样品作了定性、定量分析,结果发现不同品种丹参酮ⅡA含量最多相差15倍。为解决这一问题,部分生产厂家建设相应中药材生产质量管理规范(GAP)生产基地,控制种植、采摘和加工运输的各个环节,保证了原料药材质量的稳定性[11]。另一方面中药材本身成分复杂,而当前制备工艺无法完全去除其中杂质且较难分辨有效和有害成分[12],部分原料药材本身含有毒性成分,如伊通舒注射液、元秦止痛注射液、柴辛感冒注射液的原料药材之一细辛中含有马兜铃酸类物质,是否存在安全隐患需要格外关注[13]。原料药材标准不完善也是不良反应的潜在原因之一,经统计134种已上市中药注射剂共涉及原料药材158种,其中部分药材各版《中国药典》均未收录,如勒马回注射液的的原料药材水蔓青,消痛宁注射液的原料药材青藤,复方苦参注射液的原料药材白土苓,痰热清注射液中的山羊角,去感热注射液中的芦竹根和竹叶柴胡等。还有部分原料药材1977版《中国药典》收录,但2015版《中国药典》无收录,如痰热清注射液中的熊胆粉,胆木注射液中的胆木等。少数中药注射剂还存在原料药材名称混乱的问题,如痛安注射液的原料药材之一是汉桃叶,1977版《中国药典》收录,2015版《中国药典》未收录,复方风湿宁注射液的原料药材之一是七叶莲,与汉桃叶都是鹅掌藤ScheffleraarboricolaHay.的茎和叶片,却在入药时使用不同的名称。此外,部分中药注射剂处方饮片的原料药材属于民族药,如复方风湿宁注射液的原料药材之一宽筋藤属于藏药,健骨注射液的原料药材战骨属于壮族药,2味药材2015版《中国药典》均未收录。原料药材的安全性与有效性是中药注射剂安全性与有效性的基础,而原料药材标准不完善、不规范,部分药材使用混乱,给中药注射剂的安全性带来了巨大隐患。
4.3 功能主治及市场分析
综合分析已上市中药注射剂和2017年中国城市公立医院13个畅销中药注射剂数据,用于治疗心脑血管疾病的中药注射剂占比均最大。中药注射剂在心脑血管疾病的治疗中有广泛的应用,对冠心病、心肌梗死、心律失常、心力衰竭等疾病疗效显著[14-15],笔者于2019年7月于北京某院实地调研发现,应用较多的中药注射剂品种有注射用血栓通(冻干)、舒血宁注射液、冠心宁注射液、丹参多酚注射液、银杏内酯注射液、双黄连注射液、喜炎平注射液等。其中多数中药注射剂用于治疗心脑血管疾病,且用量较大,与大数据分析结果相符。张金彦等[16]研究结果显示,2015—2016年某院用于治疗心脑血管疾病的中药注射剂种类及销售额均为最大占比。治疗心脑血管疾病的中药注射剂使用较多的原料药材有丹参、红花等。丹参作为传统药材研究的药用模式植物,前人做了大量关于其药用价值、基因组学和分子生物学的研究,为阐明其活性成分、基因调控以及优良品种选育提供了坚实的基础[17]。之后是用于治疗肿瘤疾病的中药注射剂,使用较多的原料药材有黄芪、人参等。治疗呼吸系统疾病的中药注射剂上市品种较多,但销售额低于治疗肿瘤疾病的中药注射剂,其使用较多的原料药材有金银花和连翘,喜炎平注射液销售额很高,原料药材穿心莲需要额外关注。用于治疗骨骼肌肉系统疾病中药注射剂销售额较低,其中有止痛、补血活血之效的当归和川芎应用很多。治疗感染类疾病中药注射剂中金银花、板蓝根和柴胡应用较多。
4.4 政策引导规范使用
除了原料药材的问题,使用不当等人为因素也是中药注射剂不良反应的重要原因。在中药注射剂的使用过程中,存在适应症、使用方法和用药疗程与说明书不符等现象[18],2008年的“刺五加注射液事件”经国家食品药品监督管理局调查、中国食品药品检定研究院初步检验结果显示,该厂生产的刺五加注射液部分批号的部分样品被细菌污染,系人为因素[19]。2009年的“双黄连注射液事件”经调查可能是未按说明书要求,违规与禁忌联用的西药联用所致[20]。为避免此类不良反应的发生,国家和各省市层面先后出台相关政策引导中药注射剂的规范使用。2017年2月23日人力资源社会保障部印发了《2017年版国家基本医疗保险、工伤保险和生育保险药品目录》,目录中共有49个中药注射剂,但26个中药注射剂限用于二级及以上医疗机构,部分中药注射剂还对适应证做了严格的限制,有各种限用条件的中药注射剂共计38个。2019年3月15日,江西省首个公布省级重点药品监控目录,随后全国范围内多地发布重点监控目录(辅助用药目录)。据药智网数据(https://news.yaozh.com/archive/26229.html),已公布的目录含400多个药品,如河北省120个辅助用药目录、河南洛阳市80个重点监控目录、安徽省46个生产重点监控目录。汇总发现目录中中药注射剂占比接近80%,其使用将被重点监控,避免因使用不当造成的不良反应。2017年11月28日至今,先后有生脉注射液、参麦注射液、柴胡注射液、丹参注射液、双黄连注射液等中药注射剂被国家药品监督管理局修订说明书。修订内容多为增加警示语,对不良反应、禁忌、注意事项进行修订。明确告知不良反应发生的临床症状、应对措施及禁用人群,引导中药注射剂的临床合理应用。在国家政策引导和企业积极推动下,相信中药注射剂的安全问题将得到有效解决。
4.5 启动上市后再评价
早在2009年7月16日,国家食品药品监督管理局就发布了《关于开展中药注射剂安全性再评价工作的通知》,启动中药注射剂安全性再评价工作,但由于各种原因进展较慢。2015年8月9日国务院印发了《关于改革药品医疗器械审评审批制度的意见》,意见中再次提到了要积极推进中药注射剂的再评价。2017年10月8日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中不仅提到要严格药品注射剂审评审批,还强调要加强中药注射剂的再评价,并力争用5~10年时间基本完成。2018年3月23日,国家食品药品监督管理局发布《2017年度药品审评报告》。报告提到将启动中药注射剂再评价工作,制定再评价技术指导原则。中药注射剂的再评价除了 “安全、有效”这2个标准外,还应考虑其必要性,即在当前已有药物的基础上,是否有必要开发和使用相关中药注射剂[21]。虽然中药注射剂的市场不可避免会受影响而有一定收缩,但只有真正开展再评价工作并取得实质成果的中药注射剂才能在优胜劣汰的市场中立足。

