L-天冬酰胺酶的补料分批发酵
王云龙, 刘 松, 冯 岳, 堵国成, 陈 坚*
(1. 江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2. 江南大学 生物工程学院,江苏 无锡214122)
L-天冬酰胺酶(L-Asparaginase,EC 3.5.1.1,LASNase)是一种酰胺基水解酶,可以将天冬酰胺脱氨基生成天冬氨酸和氨[1]。 该酶具有抗肿瘤活性,已被用于治疗淋巴系统恶性肿瘤、儿童急性淋巴细胞白血病、网状细胞肉瘤及霍金森病等疾病[2]。 最新报道中显示该酶也可用于油炸食品中以减少丙烯酰胺的生成[3-4]。 由于L-ASNase 在食品与医药领域中的重要应用,已引起国内外广大学者的极大兴趣。
L-ASNase 广泛存在于动植物及微生物中[5]。 但是由于动植物中L-ASNase 含量少, 分离提取操作困难,而微生物发酵法具有培养简单、提取纯化简便以及易于大规模生产等优点, 已成为商品化LASNase 的主要来源[6]。 由于野生菌发酵L-ASNase产量往往较低[7-8],国内外学者开始构建L-ASNase酶重组菌并对其发酵条件进行优化。 Khushoo 等人通过指数流加策略控制重组菌E.coliBLR(DE3)比生长速率并优化诱导剂添加时间, 使L-ASNase 酶活达到870 U/mL[9]。 龙水清通过双阶段控制溶氧策略促进B. subtilis168/pMA5-ansz产酶,总酶活达到112.61 U/mL[10]。 Chityala 等人 在B.subtilisWB800N中表达P.carotovorumMTCC 1428 来源的L-ASNase基因, 通过统计学方法及持续诱导策略使LASNase 的产量达到525.98 U/mL[11]。
本研究以研究室前期构建的菌株Bacillus subtilis/ASNΔ25/B2 为生产菌株[12],拟在优化搅拌转速的基础上对其补料分批发酵条件进行研究,考察了补料时间、补料培养基组成、补料量以及流加方式对菌体生长和产酶的影响, 建立了3 L 发酵罐发酵工艺,为L-ASNase 工业化生产提供重要参考。
1材料与方法
1.1 材料与仪器
菌株:Bacillus subtilis/ASNΔ25/B2[12],由江南大学生物系统与生物加工工程研究室构建并保藏。
XWY-240 恒温摇床: 上海智诚仪器有限公司产品;3 L 发酵罐:迪必尔生物工程(上海)有限公司产品;Agilent 1260 System 高效液相色谱仪: 美国Agilent 公司产品;台式高速离心机:德国eppendorf公司产品;UV-2450 型紫外-可见分光光度计:日本Shimadzu 公司产品;pH 计:瑞士Mettler 公司产品。
1.2 培养基
1.2.1 卡那平板培养基(g/L) 胰蛋白胨10,酵母粉5,氯化钠10,琼脂20,硫酸卡那霉素0.05。
1.2.2 种子培养基(g/L) 胰蛋白胨10,酵母粉5,氯化钠10,硫酸卡那霉素0.05。
1.2.3 发酵培养基(g/L) 酵母蛋白胨28.0,硫酸铵4.0, 玉 米 浆11.0,K2HPO4·3H2O 22.5,KH2PO411.5,MgSO4·7H2O 1.0,NaCl 3.3,L-天冬酰胺2,蔗糖65.0,硫酸卡那霉素0.05;初始pH 7.5。
1.2.4 补料培养基(g/L) 碳源:蔗糖800;混合氮源:酵母蛋白胨200,玉米浆80。
1.3 培养方法
1.3.1 种子活化 取适量保存在冷冻甘油管中的菌液涂布至卡那平板上,37 ℃培养过夜。
1.3.2 种子培养 将活化好的种子接种至装有60 mL种子培养基的500 mL 三角瓶中,添加60 μL的50 mg/mL 硫酸卡那霉素,摇床温度37 ℃,转速220 r/min,培养8~10 h。
1.3.3 摇瓶发酵培养 按体积分数4%的接种量将种子培养基接入装有25 mL 发酵培养基的250 mL摇瓶中,温度37 ℃,转速220 r/min。
1.3.4 发酵罐发酵培养 按体积分数4%的接种量将种子培养基接入装有1.5 L 发酵培养基的3 L 发酵罐中,通气量2 vvm,温度37 ℃,初始pH 7.5。 本研究中所有实验重复3 次取其平均值。
1.3.5 补料分批发酵 0~8 h 搅拌转速为700 r/min,8 h 以后搅拌转速为900 r/min。16 ~28 h 以32 mL/h平均流速进行恒速流加酵母蛋白胨和玉米浆混合氮源。
间歇性流加:16 h 开始每隔2 h 补加37.5 mL 蔗糖。
恒速流加:16~28 h 以平均流速18.75 mL/h 恒速流加蔗糖。
指数流加:蔗糖流加速率按如下公式计算:
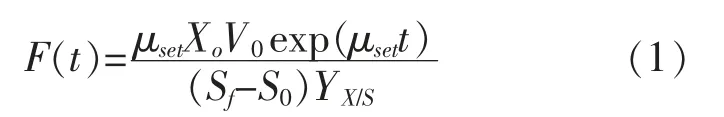
式中F(t)为蔗糖流加速率(L/h),μset为设定的比生长速率(0.2 h-1),X0代表初始菌体干质量浓度(g/L),V0为初始发酵液体积(L),t为指数流加的时间(h),Sf为补加的蔗糖质量浓度(800 g/L),S0为指数流加开始时的残留蔗糖质量浓度(g/L),YX/S为菌体对底物的得率系数(0.29 g/g)。
1.4 分析方法
1.4.1 菌体浓度的测定 采用浊度法测定。 取适量发酵液稀释到适当倍数后使用紫外分光光度计于波长600 nm 下测定吸光度,即OD600。
1.4.2 L-ASNase 粗酶液制备 取一定量的发酵液12000 r/min 离心10 min,上清液即为L-ASNase 粗酶液。
1.4.3 L-ASNase 酶活测定 采用奈氏试剂法[13]。取900 μL 磷酸盐缓冲液 (20 mmol/L K2HPO4-KH2PO4缓冲液,pH 7.5)加入200 μL 底物(L-天冬酰胺,0.15 mol/L)于37 ℃保温10~20 min 后, 加入100 μL 稀释到适当倍数的L-ASNase 粗酶液,37 ℃反应10 min 后加入100 μL 终止剂(三氯乙酸,1.5 mol/L)终止反应,对照组在保温前即加入终止剂。 反应结束后12000 r/min 离心2 min,取100 μL 上清液,加入3400 μL 去离子水和500 μL 奈氏试剂, 混匀后在波长436 nm 下测定吸光度。
酶活力单位定义:37 ℃每分钟水解L-天冬酰胺生成1 μmol 氨所需要的酶量定义为一个LASNase 活力单位。
1.4.4 蔗糖质量浓度测定 采用高效液相色谱法[12]。液相仪:Agilent 1260;检测器:RID;色谱柱:Aminex HPX-87H,300 mm×7.8 mm 柱(250 mm×4.6 mm,5 μm); 流动相:5 mmol/L 硫酸; 流速:0.6 mL/min;柱温:40 ℃,进样体积为10 μL。
1.4.5 比速率的计算 使用Origin 软件处理[14]。
2 结果与讨论
2.1 搅拌转速对L-ASNase 分批发酵过程的影响
在发酵过程中搅拌转速一方面会影响到环境中溶氧(DO)的变化,另一方面过大的转速产生剪切力也会影响到细胞的生长[15],发酵液中的溶氧水平对L-ASNase 的合成影响较大[16-17]。 故在3 L 发酵罐水平进行分批发酵, 考察搅拌转速对B.subtilis/ASNΔ25/B2 菌体生长和产酶的影响,共选取了600、700、800、900 r/min 4 个转速进行研究。 不同搅拌转速发酵过程中溶氧的变化情况如图1(a)所示,在整个发酵过程中溶氧呈先下降后上升的趋势。 在0~20 h,由于菌体生长代谢作用需要消耗大量溶解氧,溶氧水平一直呈下降趋势, 而后期需氧量明显下降。 不同的搅拌转速所能提供的溶氧水平差异较大,600 r/min 在8 h 时DO 只有10.9%,8~24 h DO一直处于很低的水平, 接近于0;700 r/min 在12 h之后溶氧迅速下降到0.9%;800 r/min 能维持DO 在20%以上;900 r/min 能维持DO 在30%以上。
不同搅拌转速下OD600随时间变化情况如图1(b)所示。 与搅拌转速600 r/min 相比,700、800、900 r/min 条件下OD600分别提高了4.9%、14.5%、14.9%。 这是因为枯草芽孢杆菌是好氧微生物[10],而600 r/min 和700 r/min 溶氧均在16~24 h 处于较低水平,影响了菌体生长。
不同搅拌转速下菌体比生长速率变化情况如图1(c)所示,比生长速率均呈现先增大后减小的趋势,600、700、800、900 r/min 比生长速率分别在6.5、5、5、5.5 h 达到最大。在8 h 前由于溶氧充足,而700 r/min剪切力小,故其比生长速率高于其他转速。在8 h 以后,菌体已经进入对数生长期,对溶氧要求较高,而高转速能提供更高的溶解氧, 更适合菌体生长,故900 r/min 比生长速率高于700 r/min。
结合图1(b)和图1(d)可知B.subtilis/ASNΔ25/B2 产L-ASNase 属于延续合成型。在0 ~ 24 h,随着菌体的生长L-ASNase 酶活也逐渐增加, 当菌体进入稳定期后产酶依然继续,且酶活和生物量呈正相关。 与搅拌转速600 r/min 相比,700、800 r/min 和900 r/min 条件下酶活分别提高9.4%、25.4%和25.9%。发酵前期, 不同搅拌转速下L-ASNase 的比产酶速率接近,8 h 之后900 r/min 的比产酶速率要明显高于其他转速。 这说明较高的溶氧不仅对菌体生长有利,也可促进菌体产酶。
根据上述结果, 为了进一步提高L-ASNase 产量, 提出两阶段控制搅拌转速策略即0~8 h 将搅拌转速控制在700 r/min,8 h 之后将搅拌转速控制在900 r/min。 发酵过程曲线如图1(f)所示,溶氧水平能维持在30%以上, 可以满足菌体对溶氧的要求,发酵周期由40 h 提前到36 h,最大酶活也进一步提高,达到850.6 U/mL。 不同搅拌转速下发酵过程参数见表1,与恒定转速600 r/min 相比,两阶段控制转速条件下菌体OD600、酶活和生产强度分别提高了18.8%、31.9%、46.6%。
2.2 补料时间对L-ASNase 补料分批发酵过程的影响
两阶段控制搅拌转速分批发酵过程中蔗糖消耗情况如图2(a)所示,随着发酵过程的进行,蔗糖不断消耗,在20 h 即将耗尽。如果增加蔗糖供应,可能会进一步提高菌体量和酶产量。 在分批发酵过程中,发酵液中残留蔗糖质量浓度一直在减小,菌体对蔗糖的消耗速度也在不断发生变化,在不同时间开始补加蔗糖, 对菌体生长可能会产生不同的影响。 因此,为了确定蔗糖的最佳补料时机,分别研究了在发酵过程进行到16、18、20 h 开始每隔2 小时间歇性流加蔗糖,补糖总量为80 g/L,分4 次补加到发酵罐中,结果如图2 所示。

图1 搅拌转速对L-ASNase 分批发酵过程的影响Fig. 1 Influence of stirring speed on the production of L-asparaginase in batch fermentation

表1 不同搅拌转速下L-ASNase 分批发酵过程参数比较Table 1 Comparison of fermentation parameters among batches with different stirring speed conditions

图2 补料时间对L-ASNase 补料分批发酵过程的影响Fig. 2 Influence of feeding time on the production of L-asparaginase in fed-batch fermentation
当发酵过程进行到16 h 时发酵液中的蔗糖质量浓度减少到10 g/L 左右, 此时溶氧还没反弹,菌体正处于对数生长期,对蔗糖的消耗速度较快。 由图2(b)可知,在此时补加蔗糖能很好的满足菌体对蔗糖的需求, 菌体OD600进一步提高, 在28 h 达到60.3,和分批发酵相比提高了12.1%,酶活在44 h 达到972.1 U/mL,和分批发酵相比提高了14.3%。当发酵过程进行到18 h 时发酵液中的蔗糖质量浓度减少到4 g/L 左右,菌体对蔗糖的消耗速度和16 h 相比减小很多。 在此时开始补加蔗糖(图2(c)),和分批发酵相比,OD600和酶活分别提高了5.1%、11.8%。当发酵过程进行到20 h 时发酵液中的蔗糖质量浓度仅剩1 g/L 左右,菌体开始进入稳定期,在此时开始补加蔗糖(图2(d)),由于补料太迟,菌体所需的能量不能及时供给,OD600无明显提高, 酶活仅提高了9.9%。 故选择在16 h 开始补加蔗糖。
2.3 补料培养基组成对L-ASNase 补料分批发酵过程的影响
由补料时间结果可知, 在16 h 单一补加蔗糖,菌体量虽然有所提高,但提高幅度不大。 菌体生长还需要其他营养物质,仅仅补加碳源对提高菌体量和酶产量作用有限[14]。 故进一步研究了补料培养基组成对L-ASNase 补料分批发酵过程的影响。
首先在摇瓶水平上通过蔗糖、酵母蛋白胨和玉米浆的不同组合研究补料培养基组成对B.subtilis/ASNΔ25/B2 产L-ASNase 的影响, 以此作为在发酵罐上进一步放大的基础,结果如图3(a)所示。 和对照组相比,实验组的OD600和酶活均有提高,说明补加培养基对菌体生长和产酶有利。 比较实验组可知,补加蔗糖的同时再补加酵母蛋白胨或玉米浆效果都比单一补加蔗糖更好,三者一起补加时效果最好,这可能是因为酵母蛋白胨和玉米浆中除了含有菌体生长需要的营养物质外还含有产酶的前体物质[18]。 和对照组相比,三者一起补加使OD600提高了45.5%,酶活提高了43.8%。 故在3 L 发酵罐上选择同时补加蔗糖、酵母蛋白胨和玉米浆进行补料分批发酵,发酵过程曲线如图3(b)所示。OD600在32 h 达到91.1,酶活在48 h 达到1136.9 U/mL,和16 h 单一补加蔗糖相比,分别提高了51.1%、17%。
2.4 补料量对L-ASNase 补料分批发酵过程的影响
由上述结果可知,同时补加蔗糖、酵母蛋白胨和玉米浆,OD600和酶活都有较大的提高, 如果延长补料时间, 继续补加新鲜培养基,OD600和酶活可能会进一步提高,故有必要对培养基补加量进行研究。

图3 补料培养基组成对L-ASNase 补料分批发酵过程影响Fig. 3 Influence of composition of feed medium on the production of L-asparaginase in fed-batch fermentation
在发酵过程进行到16 h 时开始每隔2 小时补加一次蔗糖,分别补加4、6、8 次,蔗糖补加总量分别为80、120、160 g/L。在补加蔗糖的同时,按发酵培养基中的蔗糖、 酵母蛋白胨和玉米浆的比例,以32 mL/h 恒速补加酵母蛋白胨和玉米浆混合氮源,实验结果如图4 所示。 当蔗糖补加量为80 g/L 时,在消耗蔗糖的同时OD600逐渐增加, 发酵32 h 时蔗糖耗尽,OD600在32 h 达到最大值91.1,L-ASNase 酶活在48 h 达到最大为1136.9 U/mL。 当蔗糖补加量为120 g/L 时,发酵40 h 蔗糖耗尽,在细胞耗糖的同时OD600逐渐平稳增加, 在40 h 达到最大值119.7,酶活也随着菌体生长不断增加,在48 h 达到最大值1279.6 U/mL。当蔗糖补加量增加到160 g/L 时,蔗糖在44 h 才消耗完全,OD600在40 h 达到最大为121.6, 和补糖总量120 g/L 时所能达到的OD600接近,L-ASNase 酶活在48 h 达到最大值1294.6 U/mL。虽然酶活最大值比补糖总量120 g/L 时有少量增加,但不是很显著,且消耗了更多的原料。 故为了节约成本,选择蔗糖补加量为120 g/L。
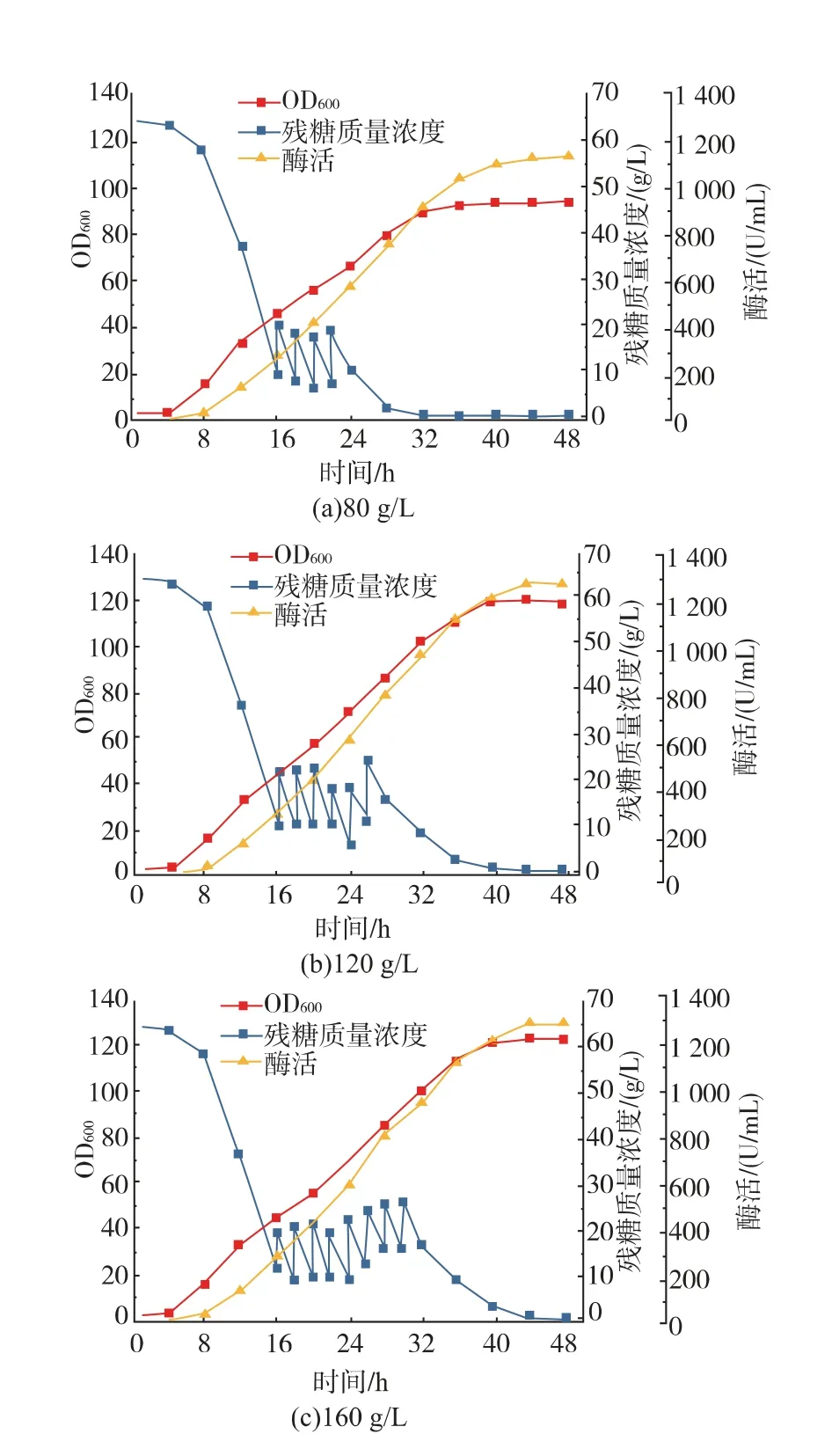
图4 补料量对L-ASNase 补料分批发酵过程的影响Fig. 4 Influence of feeding quantity on the production of L-asparaginase in fed-batch fermentation
2.5 流加方式对L-ASNase 补料分批发酵过程的影响
碳源的流加方式对补料分批发酵过程有着重要影响。 非反馈式流加主要包括脉冲式流加、恒速流加、指数流加和间歇性流加等[19],不同的产物、不同的菌体适合不同的补料策略。 为了进一步研究蔗糖流加方式对补料分批发酵的影响,在间歇性流加的结果之上采用恒速流加和指数流加进行发酵培养,发酵过程曲线如图5 所示。
由图5(b)可知,当在16~28 h 以18.75 mL/h 平均流速恒速流加蔗糖时,细胞OD600一直平稳增加,在44 h 达到最大值128.6,L-ASNase 酶活在48 h达到最大值1413.6 U/mL,和间歇性流加(图5(a))相比,酶活进一步提高。 由图5(c)可知,当发酵16 h时开始指数流加蔗糖时, 菌体OD600在32 h 达到最大值81.2,L-ASNase 酶活在44 h 达到最大值1048.9 U/mL,和间歇性流加相比酶活下降。 这可能是因为蔗糖并非发酵培养基中的唯一碳源,且流加速率是通过理论计算得到的[20],导致蔗糖没能及时消耗,使菌体浓度减小,干扰了菌体的生长代谢,故最终没有达到较好的效果。 不同流加方式发酵过程参数如表2 所示, 和间歇性流加相比, 恒速流加OD600、酶活、生产强度都进一步提高。 指数流加虽然发酵周期较短,但是蔗糖转化率、OD600和酶活较低,导致其生产强度也较低。 在补料量相同的情况下,恒速流加蔗糖能取得更高的产酶量、底物转化率和生产强度,故最终采用恒速流加。

图5 流加方式对L-ASNase 补料分批发酵过程的影响Fig. 5 Influence of feeding mode on the production of L-asparaginase in fed-batch fermentation
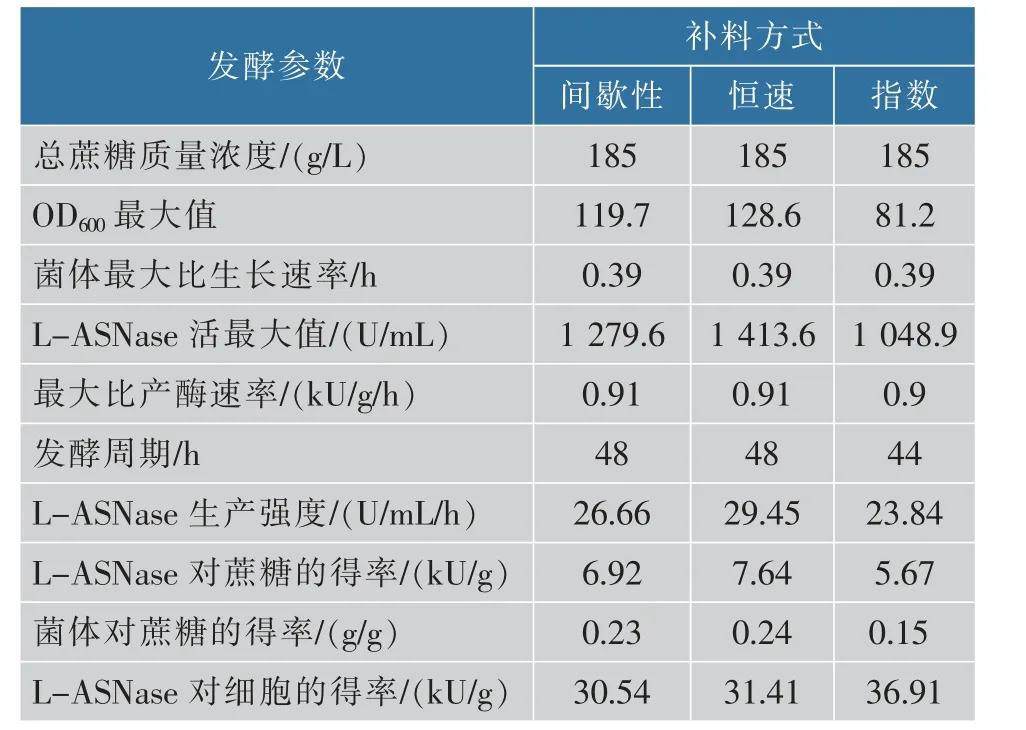
表2 不同流加方式L-ASNase 补料分批发酵过程参数比较Table 2 Comparison of fermentation parameters among batches on different feeding mode
3结 语
在B. subtilis/ASNΔ25/B2 产L-ASNase 发酵过程中, 通过两阶段控制搅拌转速的培养策略即0 ~8 h 控制搅拌转速700 r/min,8 h 以后搅拌转速恒定在900 r/min,使菌体OD600、酶活和生产强度与恒定转速600 r/min 相比, 分别提高了18.8%、31.9%、46.6%。 通过对补料时间、补料培养基组成、补料量、蔗糖流加方式的研究,得出:当在16~28 h 以平均流速18.75 mL/h 恒速流加蔗糖、 以平均流速32 mL/h恒速流加酵母蛋白胨和玉米浆混合氮源时效果最好,OD600最高达到128.6,L-ASNase 酶活在48 h 达到最大1413.6 U/mL。和分批发酵相比,提高幅度高达66.2%。 和Khushoo[9](870 U/mL)、 龙 水 清[10](112.61 U/mL)、Chityala[11](525.98 U/mL)等人报道的L-ASNase 产量相比,本研究的L-ASNase 最终产量高于目前报道的水平, 为实现国内L-ASNase 工业化生产提供了数据支撑。

