褪黑素对鸡成骨细胞增殖和分化的影响
王 涵,岳巧娴,许利军,周荣艳*,陈 烨,陈 辉,张振红
(1.河北农业大学 动物科技学院,河北 保定 071001;2.保定市畜牧工作站,河北 保定 071001)
蛋鸡在产蛋期存在独特的骨代谢过程,骨吸收时髓质骨被破骨细胞黏附并分解释放蛋壳形成所需要的钙[1];骨形成时髓质骨吸收多余的钙,被成骨细胞重建[2]。骨代谢过程中,成骨细胞是主要功能细胞,负责骨基质的合成、分泌和矿化,参与骨的形成和重建[3];骨涎蛋白(bone sialoprotein,BSP)为髓质骨的主要组成成分,促进成骨细胞的分化和矿化,诱导成骨细胞和破骨细胞对髓质骨的黏附,在骨代谢中起重要作用[4-7]。当外源钙长期供应不足时,骨代谢平衡被打破,髓质骨被过度吸收,引发蛋鸡骨质疏松症,造成骨折和瘫痪,降低产蛋性能和经济效益。
褪黑素是由脊椎动物脑部松果体合成分泌的一类吲哚类激素,在机体的代谢方面发挥着重要的生理学效应[8]。研究发现,蛋鸡产蛋率与血液中褪黑素水平呈正相关[9],在饲料中补充褪黑素可增加蛋重并提高蛋鸡胫骨和股骨断裂强度[10],提升蛋鸡生产经济效益,但褪黑素提高蛋鸡骨骼质量的具体机制尚不明确,推测可能与成骨细胞分化、增殖和BSP表达水平相关。本试验通过体外分离培养原代鸡成骨细胞,研究褪黑素对鸡成骨细胞增殖和分化的影响,为褪黑素调节蛋鸡骨代谢和产蛋性能提供理论依据。
1 材料与方法
1.1 试验动物15胚龄鸡胚(种蛋)10只,不计大小,不分雌雄。试验过程符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。
1.2 主要试剂0.25% Trypsin-EDTA(Gibco,US)、青链霉素(Gibco,US)、胎牛血清(Gibco,US)、DMEM培养基(Gibco,US)、PBS缓冲液(Gibco,US)、褪黑素(Sigma,US)、Cell Counting Kit-8试剂盒(日本同仁,日本)、瑞氏-姬姆萨复合染液(索莱宝,北京)、茜素红染色液(索莱宝,北京)、BCIP/NBT碱性磷酸酯酶显色试剂盒(碧云天,上海)、碱性磷酸酶检测试剂盒(碧云天,上海)。
1.3 成骨细胞的分离、培养与纯化用酒精浸泡消毒15胚龄鸡胚,再用PBS缓冲液清洗以去除残留酒精;剪开头部皮肤,取出颅骨,刮去骨膜及骨缝间结缔组织,剪成约1 mm×1 mm大小的骨片,并用PBS缓冲液清洗;加入2 mL 0.25% Trypsin-EDTA(1×)进行消化处理(37℃,10 min)后,加入2 mL培养液(10%胎牛血清,1%青链霉素)终止消化;将碎骨片均匀铺于6孔板中,每孔6~7块,翻转置于培养箱中(37℃,5% CO2,饱和湿度),使骨片贴壁;3 h后转正6孔板,加入2 mL培养液培养;每3天更换培养液1次,待细胞长满(约21 d)后传代培养,采用差速贴壁法纯化细胞。
1.4 成骨细胞的鉴定
1.4.1成骨细胞形态学观察 用倒置相差显微镜观察培养成骨细胞形态,以了解其生长状况。
1.4.2成骨细胞染色鉴定 将纯化后的F2代细胞以6×104个/孔接种到6孔板中,每3 d更换1次培养液,待细胞均匀分布、融合度为80%~90%时染色。用4%多聚甲醛固定细胞,0.5% Triton X-100通透处理。
姬姆萨染色:加入瑞氏-姬姆萨复合染液染色2 h;弃染色液,PBS洗3次,在倒置相差显微镜下观察拍照。
甲苯胺蓝染色:加入0.5%甲苯胺蓝溶液染色30 min;弃染色液,PBS洗1次;加入0.5%冰乙酸分化1 min;弃分化液,PBS洗3次,在普通相机和倒置相差显微镜下拍照并观察。
碱性磷酸酶(ALP)染色:使用BCIP/NBT碱性磷酸酯酶显色试剂盒(进行ALP染色。按照商家提供的说明书配制BCIP/NBT染色工作液(现用现配),加入BCIP/NBT染色工作液室温避光孵育2 h;弃染色液,PBS洗3次,在普通相机和倒置相差显微镜下拍照并观察。
茜素红染色:加入0.2%茜素红染色液染色2 h;弃染色液,PBS洗3次,在倒置相差显微镜下观察拍照。
1.5 褪黑素对成骨细胞分化和增殖的影响
1.5.1褪黑素对成骨细胞增殖的影响 将纯化后的F3代细胞以3 000个/孔接种于96孔板,并添加0,10,50,100 μmol/L褪黑素进行培养。用CCK-8试剂盒,从第1天开始,每2天更换培养液并进行检测,连续测7次,每次每个梯度设置3个重复。在酶标仪上检测450 nm波长处测定D值,取平均值±标准差,以时间为横轴,D值为纵轴,绘制细胞生长曲线。
1.5.2褪黑素对成骨细胞分化的影响 将纯化后的F4代细胞以1.5×104个/孔接种到24孔板中,24 h 后更换添加10 mmol/L β-甘油磷酸钠、100 mg/L 维生素C的细胞培养液,再过24 h后添加0,10,50,100 μmol/L褪黑素进行培养,每3 d更换1次培养液,每天每个梯度设置3个重复,分别培养1,3,7,14 d后,裂解细胞,使用碱性磷酸酶检测试剂盒进行ALP活性检测。
1.5.3褪黑素对成骨细胞BSP基因表达的影响 将纯化后的F4代细胞以6×104个/孔接种到6孔板中,24 h后更换添加10 mmol/L β-甘油磷酸钠、100 mg/L维生素C的细胞培养液,再过24 h后添加0,10,50,100 μmol/L褪黑素进行培养,每3 d更换1次培养液,每个梯度设置3个重复,培养14 d后,提取RNA,反转录cDNA。
以NCBI基因组数据库鸡的BSPmRNA序列(登录号:NM_205162.1)作为参考序列,用在线软件Primer3设计荧光定量PCR引物,引物设计和合成由宝生物工程有限公司完成。正向引物序列为:5′-GGGCGATGAGGACAGTGAT-3′;反向引物序列为:5′-ATGGGGTGTGTGTGCTGTG-3′。选取18S 基因作为内参基因,其正向引物序列为:5′-CGAAAGCATTTGCCAAGAAT-3′;反向引物序列为:5′-GGCATCGTTTATGGTCGG-3′。
荧光定量PCR体系总体积为25 μL:12.5 μL Evagreen®qPCR Master Mix,1 μL正向引物(10 μmol/L),1 μL反向引物(10 μmol/L),2 μL cDNA,3.75 μL ROX,加入RNase-Free water补足至25 μL。反应条件:95℃预变性2 min;95℃变性5 s,60℃变性30 s,40个循环。
1.6 数据统计分析通过SPSS21.0软件进行数据统计分析,结果以“平均值±标准误”表示,数据服从正态分布时,采用单因素方差分析,多重比较采用Duncan法;数据不服从正态分布时,采用非参数检验。折线图、柱状图由GraphPad Prism5软件绘制。
2 结果
2.1 成骨细胞形态学特征颅骨骨片贴壁后2~21 d(图1A,B,C),细胞爬出的数量逐渐增加,直至铺满底部。第2天和第10天的细胞大多呈梭形、三角形或不规则多边形,第21天的细胞因过于密集,看不出细胞形态。纯化后的子代细胞(图1D,E)也呈梭形、三角形或不规则多边形,与MC3T3-E1细胞形态(图1F)相似,有成骨细胞的典型特征。

图1 原代和子代成骨细胞(标尺为2 μm) A.颅骨骨片贴壁后第2天,已有少数细胞爬出;B.颅骨骨片贴壁后第10天,爬出细胞数增多;C.颅骨骨片贴壁后第21天,爬出细胞铺满底部,细胞数过多,以至于看不出细胞形态;D.纯化后F1代细胞第3天;E.纯化后F2代细胞第3天;F.MC3T3-E1细胞第3天
2.2 姬姆萨染色F2代细胞姬姆萨染色后,细胞质染成浅紫红色,细胞核染成紫红色(图2)。细胞形态更清晰,呈梭形、三角形或不规则多边形,具有成骨细胞特征(图2)。细胞核呈现不明显,可能是由细胞核和细胞质的染色接近造成。
2.3 甲苯胺蓝染色F2代细胞甲苯胺蓝染色结果(图3A,C)与MC3T3-E1(图3B,D)一致。6孔板有蓝色沉淀(图3C),细胞质染成浅蓝色,细胞核染成深蓝色,区分明显(图3A)。细胞呈梭形、三角形或不规则多边形(图3A),具有成骨细胞特征。
2.4 碱性磷酸酶(ALP)染色F2代细胞的6孔板中有紫黑色沉淀(图4C);倒置相差显微镜下,F2代细胞中存在黑色沉淀(图4A),这与MC3T3-E1(图4B,D)一致。

图2 姬姆萨染色的F2代细胞形态特征图

图3 F2代细胞、MC3T3-E1甲苯胺蓝染色(标尺为1 μm) A,C.F2代细胞甲苯胺蓝染色;B,D.MC3T3-E1甲苯胺蓝染色

图4 F2代细胞、MC3T3-E1 ALP染色(标尺为2 μm) A,C.F2代细胞ALP染色;B,D.MC3T3-E1ALP染色
2.5 茜素红染色F2代细胞(图5A)存在矿化结节(箭头所指),被染成深红色,与MC3T3-E1(图5B)一致。

图5 F2代细胞、MC3T3-E1茜素红染色(标尺为2 μm) A,F2代细胞茜素红染色;B.MC3T3-E1茜素红染色
2.6 褪黑素对成骨细胞增殖的影响在图6中,0 μmol/L 褪黑素处理组的曲线即为成骨细胞的生长曲线,发现F3代成骨细胞在第1~5天生长缓慢,第5天生长加快,进入对数生长期;第11天进入平台期;随着培养时间的增加,不同浓度褪黑素处理(0,10,50,100 μmol/L)的细胞均在在第11天进入增殖平台期,不同浓度褪黑素处理间细胞的增殖差异不显著(P>0.05)。

图6 不同浓度褪黑素对成骨细胞增殖的影响
2.7 褪黑素对成骨细胞分化的影响由图7可知,ALP活性在第3天有所降低,但随着培养时间的增加,ALP的活性逐渐升高。由图8可知,第1天,10 μmol/L 组和50 μmol/L组ALP活性显著(P<0.05)高于0 μmol/L组和100 μmol/L 组的ALP活性极显著(P<0.01)高于0 μmol/L组;第3天,10 μmol/L 组的ALP活性显著(P<0.05)高于0 μmol/L 组;第7天,10 μmol/L组的ALP活性显著(P<0.05)高于100 μmol/L组;第14天,100 μmol/L 组的ALP活性极显著(P<0.01)高于0 μmol/L组。

图7 鸡成骨细胞ALP活性变化图
2.8 褪黑素对成骨细胞BSP基因表达的影响数据不服从正态分布,采用独立样本非参数检验,渐进显著性水平P=0.09。结果见图9,随着褪黑素浓度的增加,BSP基因的相对表达量升高;100 μmol/L组的BSP基因相对表达量最高,0 μmol/L组的相对表达量最低。
3 讨论
成骨细胞主要由骨髓基质中的间充质干细胞分化而来,是骨代谢过程中重要的功能细胞,调节并影响骨的形成和重建过程,其体外培养是研究骨代谢的重要部分。目前,研究鼠和兔成骨细胞分离培养及鉴定的文章较多[11-12],仅江莎等[13]对酶消化法、组织块贴壁法和诱导骨髓间充质干细胞法3种鸡成骨细胞培养方法进行了比较,成功从15胚龄鸡胚颅骨、18胚龄鸡胚胫骨和1月龄青年鸡胫骨中分离培养得到鸡成骨细胞。本试验采用组织块贴壁法,成功从15胚龄鸡胚颅骨中分离得到成骨细胞。

图8 不同培养时间、不同褪黑素浓度处理的成骨细胞ALP活性变化
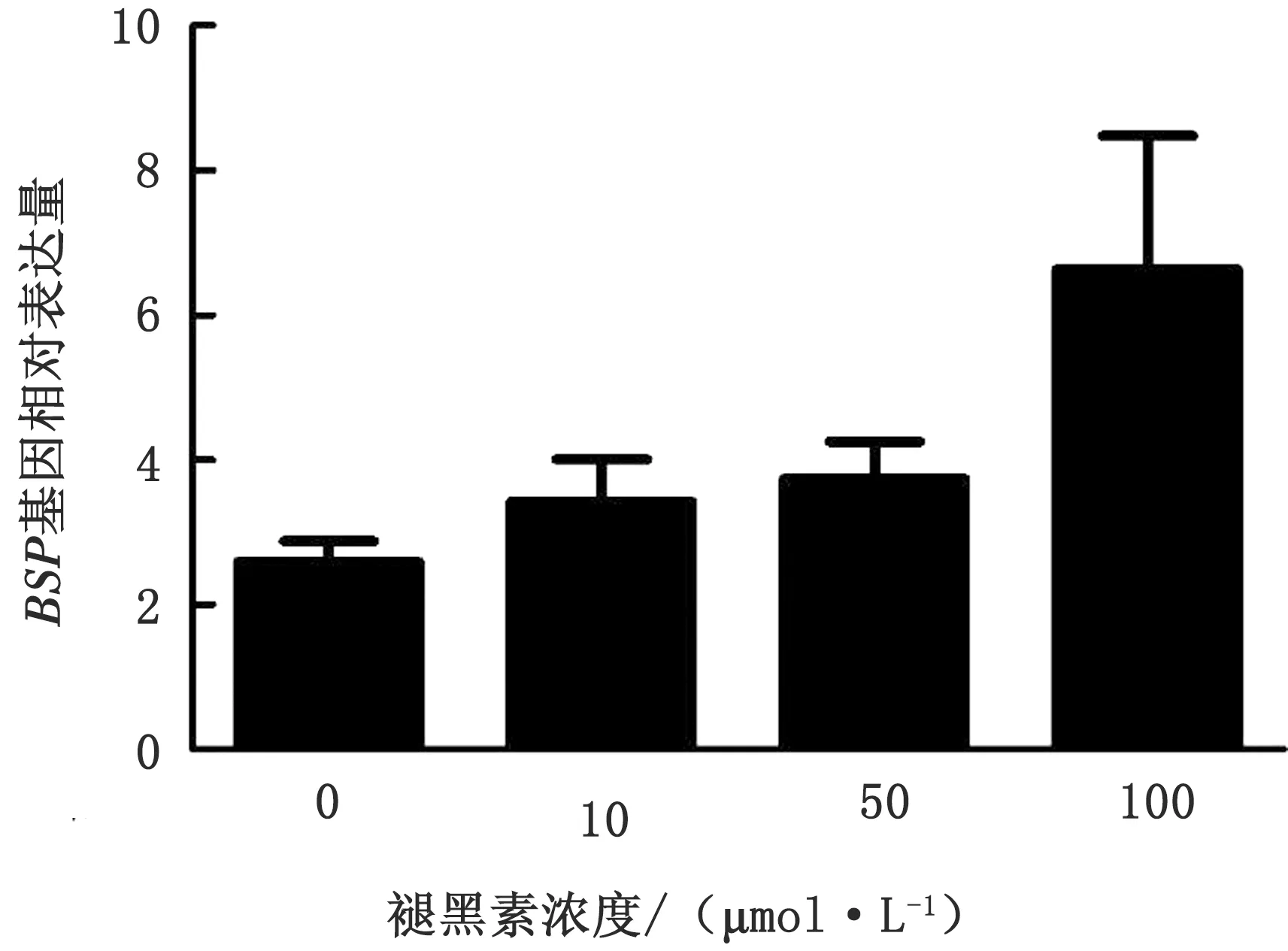
图9 不同褪黑素浓度处理14 d成骨细胞BSP基因表达变化
成骨细胞一般通过观察细胞形态特征和甲苯胺蓝、碱性磷酸酶和茜素红等染色鉴定。碱性磷酸酶(alkaline phosphatase,ALP),参与骨骼钙化,常被作为成骨细胞活性的生物标志物,其染色强阳性是成骨细胞的重要特征之一[14-16]。矿化能力是成骨细胞的一项重要生物学特征,主要通过茜素红染色检测。通过相差显微镜观察发现,原代细胞和纯化后的子代细胞均呈梭形、三角形或不规则多边形,具有成骨细胞的典型特征。姬姆萨染色使细胞形态更加清晰,明确了鸡成骨细胞的细胞特征。碱性磷酸酶和茜素红染色表明分离所得的细胞能生成碱性磷酸酶,且有良好的矿化功能,证实了该细胞具有典型的成骨细胞功能。甲苯胺蓝使细胞质染成浅蓝色,细胞核染成深蓝色,并且产生蓝色沉淀,与MC3T3-E1染色结果一致,证实了分离所得细胞为成骨细胞。
本试验通过对鸡成骨细胞生长曲线的绘制发现,鸡成骨细胞的生长分为3个阶段,第1~5天为缓慢生长期,生长缓慢;第5天生长加快,进入对数生长期;第11天进入平台期。这表明分离所得鸡成骨细胞具有良好的生殖能力。大鼠和兔分离的成骨细胞第7天进入生长平台期[17-18],小鼠分离的成骨细胞增殖第6天达到高峰[19],这与我们分离的鸡成骨细胞存在差异,可能是由于物种差异造成的。
使用不同浓度的褪黑素处理成骨细胞,发现0,10,50,100 μmol/L褪黑素处理间细胞的增殖差异不显著(P>0.05),表明褪黑素对成骨细胞的增殖没有影响。ALP活性的高低与成骨细胞的分化程度呈正相关,常作为成骨细胞早期分化的标志物[20]。本试验中,所有褪黑素处理组的ALP活性均先下降,随后随着培养时间的增加而升高,表明成骨细胞的ALP活性存在时间依赖性,成骨细胞的分化随着时间的增加而增强。在添加褪黑素的第1天和第14天,随着褪黑素浓度的增加,ALP活性升高,表明褪黑素促进成骨细胞分化,且具有浓度依赖性,当褪黑素浓度升高至100 μmol/L时,促进成骨细胞分化作用差异达到极显著水平(P<0.01)。而在第3天和第7天添加褪黑素后,促进成骨细胞分化的作用减弱,可能是因为成骨细胞正处在增殖阶段,增殖的细胞越来越多,分化的细胞较少。而第1天增殖的细胞较少,第14天成骨细胞已经处在增殖平台期以后,此时成骨细胞可能大多数都进行分化,因而褪黑素促进其分化的效果显著。
使用0,10,50,100 μmol/L褪黑素处理培养成骨细胞14 d,发现随着浓度的增加,BSP基因的相对表达量升高,表明褪黑素的添加促进了成骨细胞BSP基因的表达,且具有浓度依赖性。BSP是成骨细胞分化的生物标志物之一[7],因而上述结果也表明了褪黑素的添加促进了成骨细胞的分化,且分化效果随褪黑素浓度的增加而增强。
本试验通过组织块贴壁法从15胚龄鸡胚的颅骨中成功分离得到成骨细胞。成骨细胞ALP活性先降低,后升高,具有时间依赖性。褪黑素对成骨细胞的增殖无影响,但提高了成骨细胞ALP活性,促进了成骨细胞BSP基因表达和成骨细胞分化,且随浓度增加而作用增强。

