人参皂苷Rg5对胃癌细胞周期和侵袭的影响及其机制*
赵翔宇,何振宇, 宰守峰△
(1.新乡市中心医院肿瘤外科(普瘤一科),河南 新乡 453000;2.中山大学附属肿瘤医院放疗科,广东 中山 528400)
胃癌是全球第四大最常见的癌症,也是全球癌症相关死亡的主要原因,特别是在东亚国家,如日本和中国。虽然胃癌的治疗方法很多,如化疗、放疗和手术,临床疗效逐渐改善,但副作用和死亡率仍然很高。主要是因为胃癌早期症状不明显,癌基因的突变[1]以及患者被诊断时已是晚期或者错过了最佳治疗机会,因此患者5年生存率较低[2]。因此,开发高效、副作用小的抗肿瘤药物对胃癌患者至关重要。由于天然产物对抗癌药物发现的巨大贡献,天然产物已经是研究潜在抗癌药物的重要资源[3]。人参是一种很受欢迎的中草药已被报道具有多种生物活性,包括免疫调节、抗炎和抗肿瘤作用。其主要活性成分为人参皂苷,其中有药理活性的大约有30多种,主要包括参皂苷(G)-Rb1,G-K,Rb2,G-Rd,G-Re,G-Rg1,G-Rg3,G-Rg5,G-Rh1,G-Rh2[4]。众所周知其中Rh2,Rg3和G-K具有抗癌作用。人参皂苷Rh2通过caspase依赖的结直肠癌细胞凋亡诱导细胞死亡。人参皂苷Rg3抑制A549细胞增殖,引发细胞凋亡。人参皂苷K抑制BGC823和SGC7901细胞的活性,并触发G2期阻滞。然而,关于Rg3和Rg5抗胃癌的作用及机制尚不清楚。本研究旨在比较Rg3和Rg5抗胃癌的活性,筛选出抗胃癌活性高的化合物并对其机制进行研究,为抗胃癌药物提供新的依据。
1 材料与方法
1.1 实验材料
人参皂苷Rg3和Rg5均购于Sigma公司,纯度大于等于98%,其他试剂在下述实验方法中具体说明。
1.2 细胞培养
人正常胃粘膜细胞GES-1和胃癌细胞株AGS、MKN-45来源于中国科学研究院上海研究所。GES-1和AGS细胞在DMEM培养基(上海源培生物有限公司)培养,MKN-45细胞在RPMI-1640培养基(上海源培生物有限公司)中培养,DMEM 和RPMI-1640培养基均添加10% FBS(Thermo公司)和1%的青霉素和链霉素(Gibco公司),培养条件是在37℃,5% CO2。
1.3 实验设计
将细胞种于96孔板中,密度为1×104cells/well,加入不同浓度梯度的Rg3和Rg5(10、20、30、40、50 μmol/L)培养24 h,每组设置三个复孔,通过CCK-8检测细胞存活率。通过流式细胞仪检测细胞周期、Transwell小室分析迁移和免疫印迹法及ELISA法检测相关蛋白。
1.4 CCK-8检测细胞的存活率
用CCK-8试剂盒(东仁化学科技有限公司)测定了Rg3和Rg5对胃癌细胞和GES-1细胞生长的影响。药物处理后用PBS清洗后加入10 μl 的 CCK-8 溶液,经过 2 h 37℃ 培养后,使用酶标仪在 450 nm 的吸光度测定其吸光度值。
1.5 流式细胞仪检测细胞周期
细胞周期检测采用细胞周期检测试剂盒(贝博生物有限公司),采用流式细胞仪(BD Accuri C6l)按照说明书进行检测。收集经过不同浓度Rg5(5、10、20 μmol/L)处理的人胃癌MNK-45细胞,细胞用PBS清洗三次后,以1 000 r/min离心3~5 min至沉淀细胞。将上述收集的细胞加入500 μl 70% 的乙醇在-20℃过夜。第2日弃去乙醇加入PBS清洗三次后在黑暗中加入2 μl 20 μg/ml溶液(PI)避光染色30 min。用流式细胞仪分析细胞周期分布。
1.6 Transwell小室分析
MKN-45细胞在无血清RPMI-1640培养基含有不同浓度的Rg5(0、5、10、20 μmol/L),加入上层小室中,下室加入而500 μl完全培养基。37℃孵育24 h后,取膜上表面细胞,4%多聚甲醛固定膜下表面细胞,0.1%结晶紫室温染色10 min。在100倍放大的显微镜下,随机选择每个Transwell膜的6视野个进行拍照。迁移通过计算迁移到Transwell膜下的细胞数,评估MKN-45细胞迁移率。
1.7 蛋白免疫印迹法检测细胞周期相关蛋白的表达
取生长状况良好的MKN-45细胞,以1×106cells/ml接种于6孔板中,第2日加入分别加入不同浓度的Rg5(0、10、20 μm)。细胞继续培养24 h后弃去培养基,用PBS 清洗后离心收集细胞。加入RIPA细胞抽提试剂盒(Sigma公司)提取细胞蛋白,采用BCA蛋白定量试剂盒(Thermo Fisher Scientific)测定蛋白的浓度。用10% SDS-PAGE分离后转移到PVDF膜上(Bio-Rad, USA)。5%脱脂牛奶液中封闭,在4℃条件下加入相应的一抗孵育过夜,一抗包括Notch1,CyclinA1,CDK2,PCNA和P21CIPI(Bioss生物技术有限公司),一抗孵育完后用三羟甲基氨基甲烷缓冲液中含0.1% Tween-20(TBST)清洗三次后将膜置于含对应二抗的TBST中,室温孵育1 h。孵育完后清洗,最后将PVDF膜置于Super ECL Plus 超敏发光液中2 min,避光进行曝光显影定影处理。结果用Image-Pro Plus软件(6.0版本)对目标蛋白条带的密度进行分析。
1.8 ELISA检测基质金属蛋白酶活性
Rg5不同浓度治疗细胞后取上清液进行ELISA检测基质金属蛋白酶MMP2、MMP9。实验步骤按照试剂盒厂家说明进行(上海仁捷生物有限公司)。
1.9 统计学处理
2 结果
2.1 人参皂苷Rg3和Rg5对胃细胞及正常胃粘膜细胞增值的影响
CCK8实验结果显示不同浓度的人参皂苷Rg3和Rg5处理胃癌细胞株AGS、MKN-45 24 h后,对卵巢癌细胞增殖有抑制的作用,且呈剂量依赖性。但是对人正常胃粘膜细胞GES-1没有明显的毒副作用(表1)。Rg3对AGS和MKN-45 的IC50值分别为(33.93±1.14)μmol/L和(28.05±0.90)μmol/L。Rg5对AGS和MKN-45 的IC50值分别为(29.41±1.84)μmol/L和(22.50±1.60)μmol/L。MNK-45细胞是两种细胞系中最敏感的癌细胞。Rg5对两种胃癌细胞株的抗癌活性均明显强于Rg3(P<0.05)。因此本研究通过Rg5继续研究其抗胃癌的机制。

Tab. 1 The cell viabilities of MKN-45, AGS and GES-1 cells treated with various concentrations of Rg3 and Rg5 for 24 h
*P<0.05vsRg3
2.2 人参皂苷Rg5对胃癌细胞MNK-45周期的影响
为了验证Rg5是否通过周期阻滞来抑制卵巢癌细胞的增殖,本研究通过流式细胞仪检测细胞周期,通过观察细胞周期中哪一期细胞比例增多来直接反映细胞停滞在相应的周期。如图1实验结果显示,药物处理24 h后,相对于对照组,Rg5可以使胃癌细胞MNK-45 停滞在S期使其的积累显著性增多。当Rg5浓度为20 μmol/L时,MNK-45细胞S期比例由对照组的(15.48±2.44)%上升到(37.84±1.58)%。实验结果说明Rg5治疗可以诱导癌细胞发生S期阻滞。
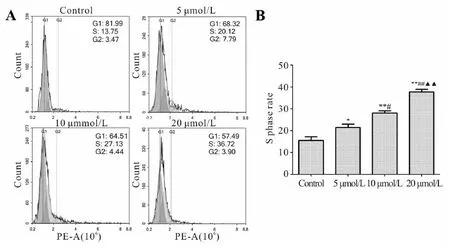
Fig. 1 Effect of Rg5 on cell cycle distribution of MNK-45 cell
A: Cell cycle distribution was examined by flow cytometry; B: Statistical analysis of S phase rates
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs5 μmol/L group;▲▲P<0.01vs10 μmol/L group
2.3 人参皂苷Rg5抑制胃癌细胞侵袭
绝大多数癌症患者死于肿瘤的侵袭与转移。本研究通过Tranwell小室检测了Rg5对胃癌细胞的侵袭的影响。实验结果如图2显示了加入0, 5, 10, 20 μmol/L Rg5后胃癌细胞的侵袭能力。如图2所示,当Rg5浓度为20 μmol/L时,与对照组相比侵袭细胞显著性减少。
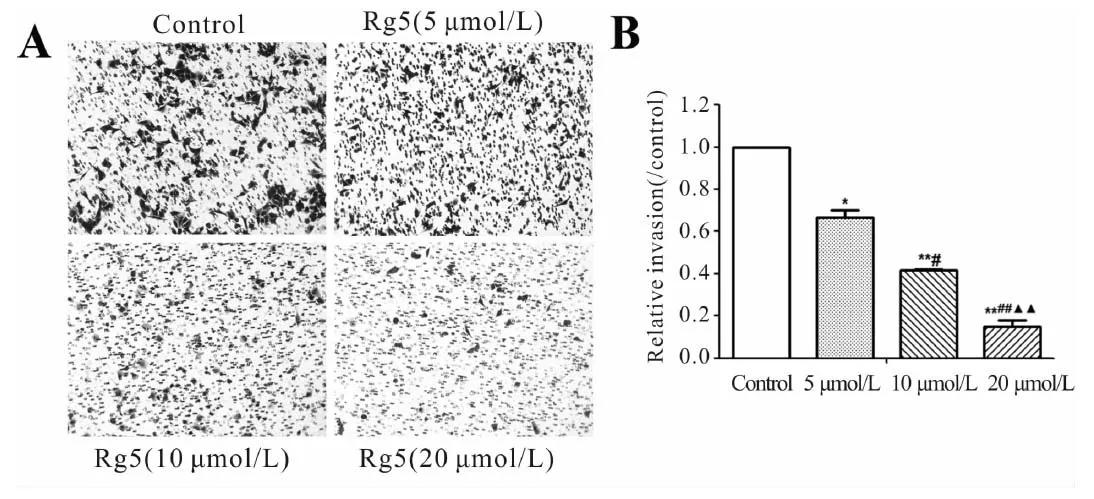
Fig. 2 Rg5 inhibited gastric cancer cell invasion
A: MKN-45 cells were treated with Rg5 24 h.Cells were collected and seeded in the up-chamber of transwell system coated with Matrigel(×200); B:Quantification of(A)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs5 μmol/L group;▲▲P<0.01vs10 μmol/L group
2.4 人参皂苷Rg5抗胃癌机制的研究
由于Notch1在多种恶性肿瘤中均被检测出表达量异常,本研究通过WB检测Notch1以及受该通路调控的周期相关蛋白CyclinA1,CDK2,PCNA和P21CIPI以及通过ELISA检测侵袭相关蛋白金属基质蛋白酶MMP2和MMP9来验证Rg5是否通过调控Notch1蛋白从而诱导胃癌细胞发生S期阻滞和抑制胃癌细胞侵袭。实验结果如图3A所示,随着Rg5浓度的升高,Notch1蛋白显著性降低。Rg5可以下调调控细胞周期S期的相关蛋白复合体CyclinA1/CDK2/PCNA(图3B)及上调P21CIPI蛋白的表达。ELISA结果如表2所示,侵袭转移相关蛋白MMP-2和MMP-9的表达随着人参皂苷Rg5的浓度的增加其表达下降。
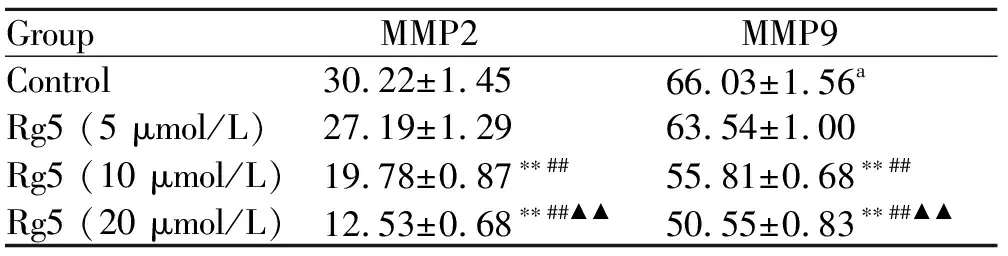
GroupMMP2 MMP9 Control30.22±1.4566.03±1.56aRg5(5μmol/L)27.19±1.2963.54±1.00Rg5(10μmol/L)19.78±0.87∗∗##55.81±0.68∗∗##Rg5(20μmol/L)12.53±0.68∗∗##▲▲50.55±0.83∗∗##▲▲
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs5 μmol/L group;▲P<0.05,▲▲P<0.01vs10 μmol/L group
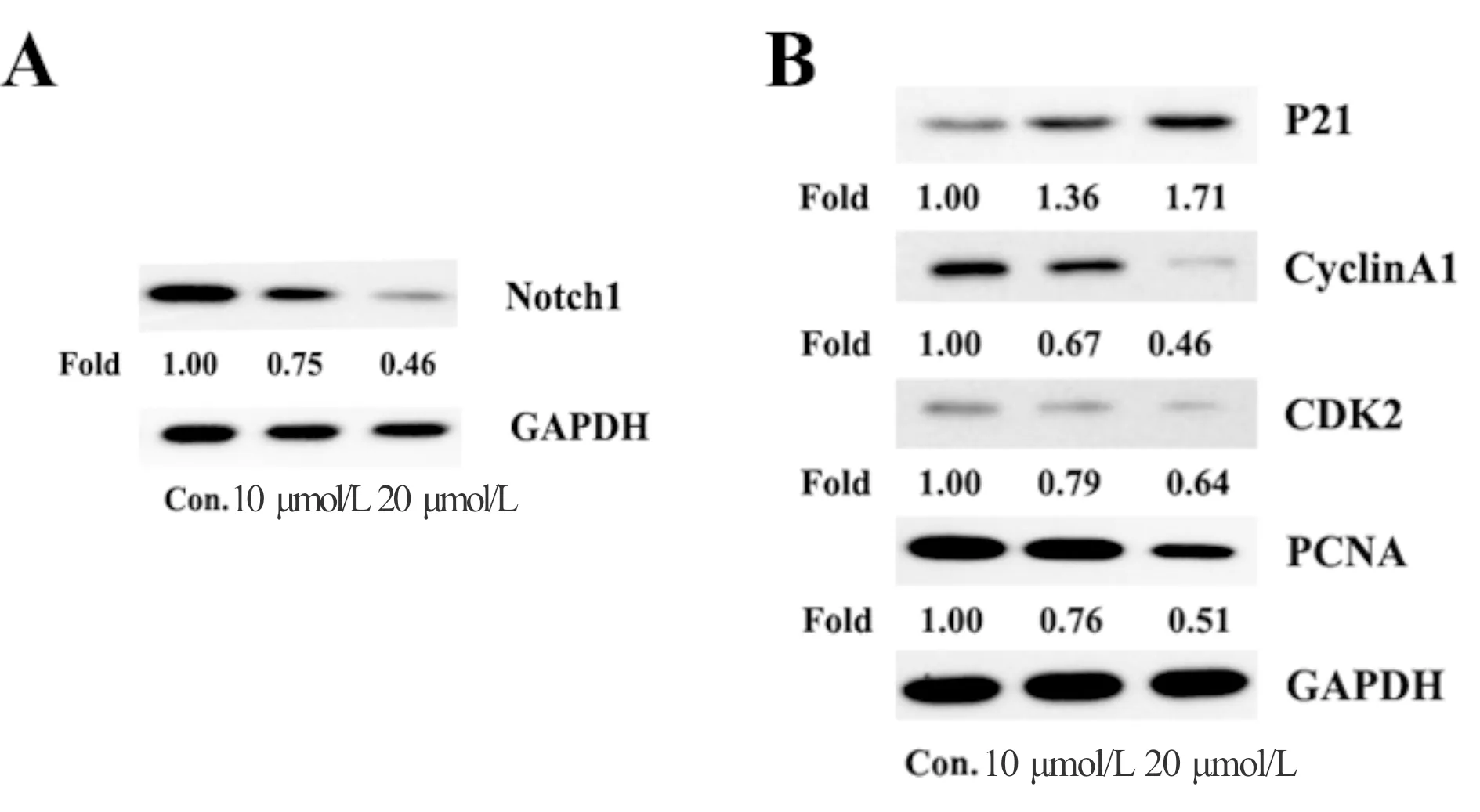
Fig. 3 Effects of Rg5 on the expression of Notch1(A)and cycle-related proteins(B)
3 讨论
人参皂苷Rg3已被证实是相对安全的药物,在体内和体外癌症模型中有着显著的抗癌活性[5]。前期研究表明人参皂苷Rg3能够诱导细胞凋亡,减弱细胞迁移和侵袭,增强癌细胞对化疗的敏感性。Rg5的抗癌作用研究较少,先前的一项研究表明与人参皂苷Rg3相比,Rg5具有多途径促进乳腺癌细胞凋亡的作用[6]。但是Rg3和Rg5在胃癌中的研究较少且机制尚不明确,本研究发现Rg5表现出比Rg3更强的抗癌活性且对正常胃粘膜细胞无毒副作用,因此Rg5可能成为改善胃癌的一种有效的天然新物质。
作为一种上游信号通路,Notch的激活已被报道在许多癌症中。越来越多的证据表明Notch1在胃癌组织中异常活化并高度表达。Notch1在胃癌中起重要的肿瘤进展作用[7]。研究表明植物化学物质可以通过调节癌症中异常的信号通路参与癌症的治疗与化学预防。张等[8]发现苦参碱能够通过提高细胞和体液免疫、减轻炎症反应抑制乳腺癌细胞的生长。先前研究表明Rg5通过抑制PI3K/Akt信号通路诱导乳腺癌细胞凋亡和自噬[9]。抑制Notch1可以诱导PTEN磷酸化,进而诱导胃癌细胞G2/M周期阻滞[10]。有研究发现, 通过激活Notch1信号通路, 可以调节炎症反应及氧化应激有关的生理活动, 进而发挥对心脏的保护作用[11]。在本研究中发现Rg5在胃癌细胞MNK-45中通过抑制Notch1蛋白的表达胃癌细胞发生周期阻滞和抑制癌细胞侵袭转移。诱导细胞周期阻滞是抑制癌细胞生长的有效方法,调控细胞周期相关蛋白的表达,尤其是细胞周期蛋白、CDKs和CDK抑制剂的表达,在抑制肿瘤生长中起着至关重要的作用[12]。有证据表明PCNA、P21、CyclinA1和CDK2是导致S期细胞阻滞的原因[13]。以往的研究表明,人参皂苷能诱导细胞周期阻滞。人参皂苷Rh2通过下调CyclinD1和CDK4,诱导A549人肺腺癌细胞G0/G1期细胞周期阻滞[14]。人参皂苷Rf通过线粒体途径诱导MG63人骨肉瘤细胞G2/M期细胞周期阻滞和凋亡[15]。还有研究发现Notch1促进癌细胞的侵袭和转移[16]。侵袭和转移是胃癌患者死亡的重要原因。因此,开发针对侵袭转移的新治疗方法具有重要意义。先前研究发现Rg1可以通过调控NF-κB抑制MMP9表达从而抑制乳腺癌细胞的侵袭和迁移能力[17]。在本研究中发现人参皂苷Rg5能有效抑制胃癌细胞的侵袭和迁移。人参皂苷Rg5通过抑制MMP-2和MMP-9的蛋白来抑制其的分泌,由于MMP-2和MMP-9被认为是转移功能的关键调控因子,因此人参皂苷Rg5对侵袭转移的抑制作用可能是通过抑制MMP-2和MMP-9介导的。
综上所述,与Rg3相比,人参皂苷Rg5有较强的抗胃癌活性,其能够诱导胃癌细胞发生S期阻滞并抑制其迁移,作用机制可能是通过调控Notch1蛋白的下调而发挥作用。

