CaSR表达在大鼠糖尿病性肝硬化损伤和纤维化发生中的作用*
邵毅英,范玉琪,李思葳,赵冰冰,邵小婷,扈 敬,徐长庆,魏 璨
(哈尔滨医科大学病理生理学教研室,哈尔滨 150086)
糖尿病(diabetesmellitus,DM)是胰岛素分泌减少或胰岛素抵抗而引起以血糖升高为主要特征的代谢性疾病,也是全球日益严峻的公共健康挑战[1,2]。文献报道,全球估计约有3.82亿人患有糖尿病,到2040年该数字将达到6.42亿[3]。糖尿病对机体的危害主要源于其并发症的发生,例如,糖尿病性肾病引起肾功能不全,糖尿病性心肌病引起的心功能障碍,糖尿病性视网膜病变导致的视力下降甚至失明等[2]。肝脏是糖代谢的主要场所,也是胰岛素的主要靶器官。学术界关注糖尿病和肝脏疾病之间的联系,已有较长时间。人们观察到糖尿病患者常发生一系列肝脏病变,包括肝酶异常、非酒精性脂肪性肝病、肝硬化、肝细胞癌和急性肝衰竭[4]。因此,进一步探究糖尿病性肝病的发生机制,并寻求有效的防治手段成为我们的关注点。
糖尿病性肝病的确切机制不详,主要与糖代谢紊乱、胰岛素抵抗、炎症等引起肝脏结构损伤,影响肝脏功能有关。因此,需要从新的视角进行发病机制的探讨。钙敏感受体(calcium-sensing receptor, CaSR)是 G 蛋白耦联受体C家族成员,体内分布广泛,主要参与调控Ca2+稳态、细胞增殖、分化、凋亡、激素分泌和离子通道开启等[5]。文献报道,肾衰时血管钙化伴血管平滑肌细胞 CaSR 功能性丢失[6]。本课题组前期研究发现:CaSR参与糖尿病心肌病的发生;CaSR在大鼠肝细胞有功能性表达,通过Gq-PLC-IP3通路可诱导BRL细胞发生缺血/再灌注损伤和细胞凋亡[7-9]。迄今为止,CaSR在糖尿病肝脏的表达变化及其作用,国内外尚未见报道。
本文复制了1型糖尿病大鼠模型和高糖处理的星形细胞损伤模型,观察CaSR是否参与糖尿病性肝损伤,并探讨可能的机制。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠(200~250 g,购自哈尔滨医科大学实验动物中心),饲养条件为22~24℃、12 h昼夜规律,自由饮水进食,随机分成四组(每组n=10):正常对照组(Control),糖尿病2周模型组(2W),4周模型组(4W),8周模型组(8W)。本实验采用60 mg/kg STZ(溶于0.1 mol/L 柠檬酸-柠檬酸钠缓冲液)一次性腹腔注射,复制1型糖尿病模型;对照组注射相同体积的柠檬酸-柠檬酸钠缓冲液;糖尿病组注射STZ前禁食12 h;随后立即喂24 h 10% 蔗糖水。注射 STZ一周后,大鼠尾静脉采血测定空腹血糖浓度(fasting blood glucose, FBG),如果FBG≥16.7 mmol/L 则确定为糖尿病大鼠造模成功。2周、4周和8周后,整晚禁食,腹腔注射戊巴比妥钠30 mg/kg 麻醉,处死各组大鼠。血样收集到含有抗凝剂的试管中。分离肝脏,一部分用2.5% 戊二醛固定,用于透射电镜观察;一部位置于10% 的甲醛溶液,用于形态学观察;其余部分储于-80℃,用于其他实验。
1.2 主要试剂
链脲佐菌素(streptozotocin,STZ,Sigma);血糖仪及试纸(美国强生),CaSR一抗,强效RIPA裂解液,PAGE凝胶快速制备试剂盒,超敏ECL显色液,SDS-PAGE蛋白上样缓冲液,AST、ALT测定试剂盒(南京建成),BCA定量试剂盒等。
1.3 主要器材
高速低温离心机(Beckman), US-640 型紫外分光光度计(Beckman),Western blot 电泳槽(美国 BIO-RAD)。
1.4 透射电镜检测肝脏超微结构
取肝脏组织切成1mm3,4℃,2.5% 戊二醛固定,1% 锇酸固定,常规乙醇、丙酮逐级脱水,环氧树脂包埋,超薄切片,铅铀双重染色,透射电镜下观察肝脏组织的超微结构并摄片。
1.5 HE和Masson染色检测肝脏组织学变化
取肝组织固定部位置于10% 的甲醛溶液中,常规苏木素-伊红(HE)和马松(Masson)染色,光镜下观察肝组织形态学变化,其中Masson以蓝色为阳性表达。
1.6 测定转氨酶ALT和AST浓度
将收集到的血样以4℃、3 000 r/min离心15 min,留取上清。利用试剂盒(南京建城生物工程研究所)测定血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)的含量,所有试验均按照试剂盒说明书进行。
1.7 细胞模型建立及其分组
HSC系大鼠肝星形细胞购自上海斯信生物科技有限公司。将该细胞在含10%胎牛血清(fetal bovine serum, FBS)、100 U/ml 青霉素和100 mg/ml链霉素的 DMEM 培养基中培养。当细胞达到 70%~80% 融合时传代至6~10代进行实验。将HSC细胞随机分成3组(n=5):正常对照组(Control),用含10%胎牛血清的DMEM 培养,培养基中的葡萄糖含量为5.6 mmol/L;高糖组(HG),培养基中加入40 mmol/L葡萄糖;CaSR抑制剂组(HG+Calhex231),培养基中加入2.5 μmol/L的Calhex231和40 mmol/L葡萄糖共同培养48 h。
1.8 Western blot 检测蛋白表达情况
取冷冻保存的肝脏组织,称量100 g置于组织匀浆器中,加入1 ml含PMSF(蛋白酶抑制剂)的RIPA裂解液在冰上匀浆,4℃、13 500 r/min离心25 min,取上清制备组织蛋白提取液;处理48 h后各组肝星形细胞,按类似方法处理,同样留取上清,用 BCA 法测定蛋白含量。用SDS-PAGE 电泳分离蛋白,根据目的蛋白分子量选择配制不同浓度的分离胶,上样,电泳,至溴酚兰抵达凝胶底部时,停止电泳。采用湿转法将蛋白转移至PVDF膜上,室温,5% 脱脂牛奶封闭 1 h 后,裁剪目的蛋白所在的条带。将目的条带分别置于抗体盒中,加入相应的一抗(CaSR、COⅠ、COⅢ、MMP1、MMP2、MMP9按1∶1 000比例配制),4℃过夜。次日用TBST洗膜,然后加入稀释过的二抗(1∶10 000),室温孵育 1 h,TBST洗膜,ECL法进行显色。应用 Image J 图像处理软件对条带进行分析,测量灰度值,计算各组目的蛋白的相对表达量。
1.9 统计学处理
2 结果
2.1 各组大鼠体重、血糖及肝功能的变化
与正常组相比,糖尿病大鼠(2W,4W和8W)空腹血糖明显升高,体重减轻;ALT、AST也有不同程度的升高(表1)。

Tab. 1 Changes of blood glucose, body weight, ALT and AST in each group ,n=8)
ALT:Alanine aminotransferase; AST:Aspartate aminotransferase
*P<0.05vscontrol group
2.2 各组大鼠肝脏形态学变化
HE染色光镜观察显示,正常对照组肝小叶结构清晰,肝索排列整齐,呈放射状分布,肝细胞无明显变性、坏死,核结构清晰,汇管区未见淋巴细胞浸润;模型组肝小叶结构紊乱,肝细胞肿大变圆,胞浆疏松,部分肝细胞呈大泡样改变,中央静脉周围或汇管区出现炎性细胞浸润(图1)。
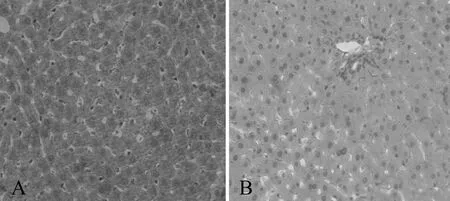
Fig. 1 HE staining to observe the changes of liver tissue structure(×40)
A: Control; B: 8W
Masson染色主要用于观察胶原纤维增生情况,以蓝色为阳性表达。结果显示,正常组肝小叶结构完整,仅中央静脉和汇管区有少量细小的胶原纤维;模型组肝小叶结构破坏,胶原纤维增多增粗,呈弥漫性分布(图2)。
大鼠肝脏超微结构结果显示:正常大鼠肝细胞内细胞器和内含物丰富,线粒体数量多,与正常组相比,糖尿病大鼠肝细胞变性,线粒体肿胀,肝内出现少量脂肪滴,细胞间隙产生胶原纤维,细胞核轻微固缩(图3)。

Fig. 2 Masson staining to observe the proliferation of collagen fibers in liver tissue
A, C: Control; B, D: 8W; A, B: ×20;C, D: ×40
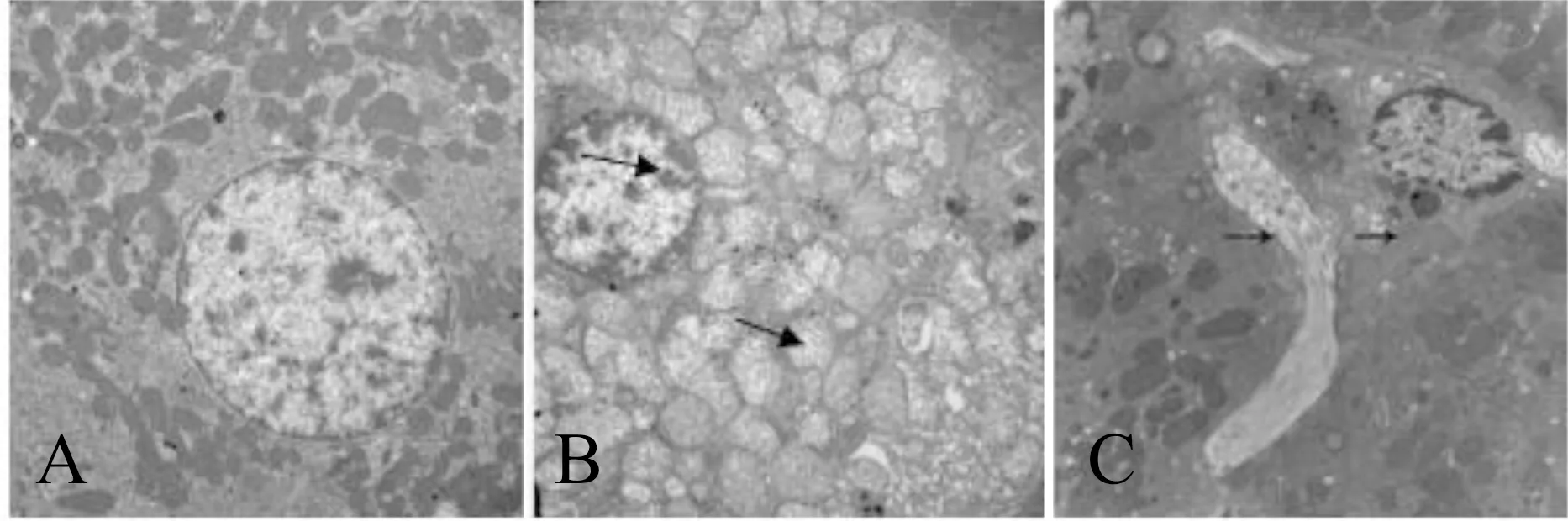
Fig. 3 Transmission electron microscopic observation of hepatic ultrastructure in each group(×10 000)
A: Control; B: 4W; C: 8W
2.3 Western blot检测各组相关蛋白的表达
2.3.1 糖尿病大鼠CaSR及纤维化相关蛋白表达变化 以CaSR及纤维化相关蛋白与β-Tubulin的比值为参数:与正常组相比,模型组胶原Ⅰ(COⅠ)、胶原Ⅲ(COⅢ)、基质金属蛋白酶1、2和9(MMP1、MMP2和MMP9)蛋白表达增加,CaSR蛋白表达同样增加(图4,表2)。
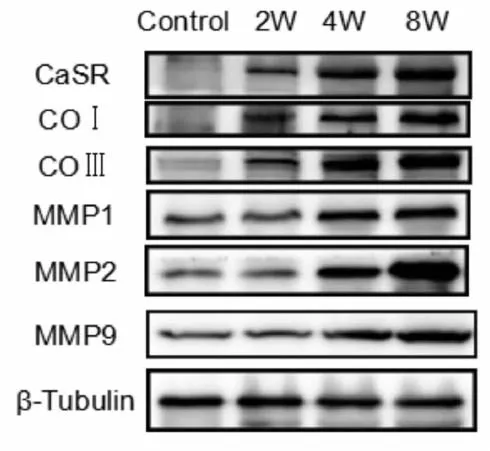
Fig. 4 Comparison of expressions of CaSR and liver fibrosis-related proteins in each group
CaSR:Calcium sensing receptor;COⅠ:Collagen Ⅰ;COⅢ:Collagen Ⅲ;MMP1:Matrix metalloproteinase I;MMP2:Matrix metalloproteinase II;MMP9:Matrix metalloproteinase 9
2.3.2 Calhex231对高糖处理HSC细胞CaSR及纤维化相关蛋白表达的影响 以CaSR及纤维化相关蛋白与β-Actin的比值为参数:与正常组相比,HG组α-平滑肌肌动蛋白(α-SMA)、COⅠ、COⅢ、MMP9蛋白表达增多,HG+Calhex231组上述变化减轻(图5,表3)。
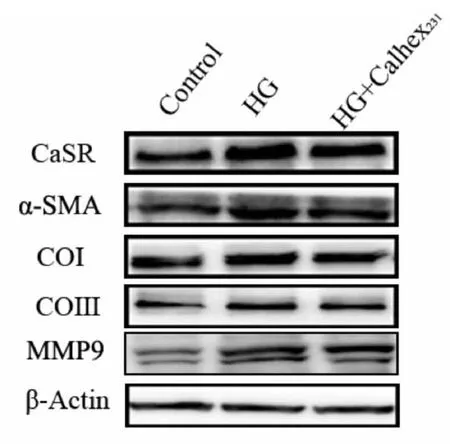
Fig. 5 Comparison of expressions of CaSR and liver fibrosis-related proteins in each group(n=5)
CaSR:Calcium sensing receptor;α-SMA:Alpha-smooth muscle actin;COⅠ:Collagen Ⅰ;COⅢ:Collagen Ⅲ;MMP9:Matrix metalloproteinase 9
Tab. 2 Analysis of CaSR and fibrosis-related protein expressions in each group, n=5)
*P<0.05,**P<0.01vscontrol group;▲P<0.05,▲▲P<0.01vs2W group;#P<0.05,##P<0.01vs4W group
Tab. 3 Analysis of CaSR and liver fibrosis-related proteins expressions in each group, n=5)
α-SMA: α-smooth muscle actin
**P<0.01vscontrol group;#P<0.05vsHG group
3 讨论
糖尿病主要分为1型糖尿病和2型糖尿病[2]。1型糖尿病的胰岛自身免疫可导致胰岛β细胞丢失[10]。据文献报道,1型糖尿病也可以发生胰岛素抵抗[3]。但是,胰岛素缺乏对肝脏造成的后果知之甚少。最近,越来越多的数据支持糖尿病的代谢状况与病理学定义的非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)存在复杂的联系[11]。有学者发现,正常人、单纯性肥胖患者及肥胖伴2型糖尿病患者内脏脂肪组织中存在表达差异的基因[12]。Targher G等人的研究表明,1型糖尿病患者中NAFLD的患病率高达50%[13],糖尿病似乎通过现有的相关代谢途径加速了NAFLD向非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的进展,其表现为坏死性炎症,并伴有不同程度的肝纤维化[11]。肝纤维化是肝脏因各种慢性损伤而发生的常见过程,是组织发生修复反应时细胞外基质(extracellular matrix, ECM)合成、降解与沉积不平衡而引起的病理过程。与肝损伤相关的因素,例如,病毒性肝炎、脂肪性肝炎(包括酒精性和非酒精性)、自身免疫性肝病、胆汁淤积性疾病以及遗传和代谢疾病,均可导致肝纤维化[14]。
本实验通过一次性腹腔注射STZ建立大鼠1型糖尿病模型。实验结果显示,模型组大鼠空腹血糖在连续观察的8周时间里始终明显升高,造模2周后模型鼠的体重较正常对照组大鼠显著降低。可见1型糖尿病大鼠模型复制成功,这为后续研究打下了基础。
谷丙转氨酶(ALT)和谷草转氨酶(AST)是诊断肝脏疾病最常用的酶。ALT主要存在于肝细胞浆中,在肝内酶活性明显高于血清,因此,少量肝细胞坏死即可导致血清ALT水平明显增高。AST主要分布在肝细胞线粒体内,当肝细胞坏死,AST可从线粒体中释放出来,进而导致血清AST明显升高[15]。本实验采用试剂盒测定血清中ALT和AST的含量,结果显示,糖尿病大鼠2周开始ALT和AST均较正常组显著升高,提示糖尿病大鼠发生了肝功能障碍。
文献报道,糖尿病引起的肝脏病理学表现主要有肝糖原沉积,脂肪肝,肝硬变,非特异性的细胞变性及微血管病变[16]。本实验透射电镜观察显示,糖尿病模型组肝细胞出现坏死,线粒体肿胀,细胞间隙存在大量胶原纤维。HE染色和Masson染色显示,糖尿病可导致模型大鼠肝脏发生明显的形态学和超微结构损伤,尤其以纤维化为主要特征。
为探讨CaSR在糖尿病性肝纤维化中的作用,本研究还观察了模型组肝组织中CaSR与纤维化指标的变化。Western blot结果显示,模型组COⅠ、COⅢ、MMP1、MMP2、MMP9蛋白表达随时间推移逐渐升高,CaSR的表达同步上升。这提示,CaSR的表达上调可能参与糖尿病大鼠肝纤维化的发生发展。为证实我们的推论,本文又初步观察了CaSR抑制剂对肝星形细胞活化的影响。结果显示,CaSR、α-SMA、COⅠ、COⅢ和MMP9表达升高,HG+Calhex231可减少上述蛋白的表达,提示CaSR对糖尿病大鼠肝损伤可能存在一定的调控机制。
综上本实验结果初步观察到CaSR的激活参与了1型糖尿病肝损伤的过程,这可能与促进肝星状细胞活化有关,其具体的机制尚待进一步研究。

