添加罗望子果肉及真空处理对鱼糜凝胶特性的影响
裴志胜 薛长风 房佳琪 文攀 徐云升


摘 要:为研究真空处理条件下罗望子果肉添加量对鱼糜凝胶特性的影响,利用质构仪、低场核磁共振等对鱼糜凝膠强度、水分状态及蛋白质分子间作用力变化进行测定。结果表明:在真空度0.09 MPa、罗望子果肉添加量3%时,真空油浴组鱼糜凝胶强度最大,为(861.36±15.32)g·mm,该组鱼糜凝胶白度及pH值也呈现下降趋势;低场核磁共振结果显示,该组自由水峰值也出现下降,二硫键含量降低,疏水相互作用力增加,有利于鱼糜凝胶结构的形成。
关键词:鱼糜;真空处理;罗望子果肉;水分分布;凝胶特性
Effects of Tamarindus indica Fruit Flesh Combined with Vacuum Treatment on Gel Characteristics of Surimi
PEI Zhisheng, XUE Changfeng*, FANG Jiaqi, WEN Pan, XU Yunsheng
(Collaborative Innovation Center of Marine Food Deep Processing, Marine Food Engineering Technology Research Center of Hainan Province, College of Food Science and Engineering, Hainan Tropical Ocean University, Sanya 572022, China)
Abstract: This study researched the effect of Tamarindus indica fruit flesh addition combined with vacuum treatment on the gel characteristics of surimi. The gel strengthen, water state, and protein-protein interactions were determined by a texture analyzer and low-field nuclear magnetic resonance (LF-NMR). The results showed that with a vacuum degree of
0.09 MPa and addition of 3% Tamarindus indica fruit flesh, the maximum gel strength of (861.36 ± 15.32) g·mm was obtained. The whiteness and pH of this group were lower than those of the other groups. The NMR results indicated a decrease in the maximum peak of the transverse relaxation time of free water (T23) and disulfide bond content and an increase in hydrophobic interactions, which was beneficial to the formation of surimi gel structure.
Keywords: surimi; vacuum treatment; Tamarindus indica fruit flesh; water distribution; gel properties
DOI:10.7506/rlyj1001-8123-20201120-268
中图分类号:TS254.5 文献标志码:A 文章编号:1001-8123(2020)12-0024-06
引文格式:
裴志胜, 薛长风, 房佳琪, 等. 添加罗望子果肉及真空处理对鱼糜凝胶特性的影响[J]. 肉类研究, 2020, 34(12): 24-29. DOI:10.7506/rlyj1001-8123-20201120-268. http://www.rlyj.net.cn
PEI Zhisheng, XUE Changfeng, FANG Jiaqi, et al. Effects of Tamarindus indica fruit flesh combined with vacuum treatment on gel characteristics of surimi[J]. Meat Research, 2020, 34(12): 24-29. DOI:10.7506/rlyj1001-8123-20201120-268.
http://www.rlyj.net.cn
凝胶化是鱼糜制品加工过程中的重要步骤之一,肌原纤维蛋白等蛋白质具有受热凝胶的性质,可以形成具有弹性的产品[1]。鱼糜凝胶品质与凝胶化方式密切相关,有效改善凝胶特性是目前鱼糜加工过程中的焦点和难点问题[2-3]。到目前为止,鱼糜凝胶形成已经不止有传统的二段加热方法,微波加热[4]、电阻加热[5-6]、酸致凝胶[7]、发酵鱼糜凝胶[8]、超高压技术[9-10]及超声波处理技术[11]等也被应用于鱼糜凝胶制作过程中。真空条件下可以使鱼糜蛋白分子内部的束缚作用减弱,二硫键减少,有利于蛋白分子结构的伸展,促进肌动球蛋白和原肌球蛋白的解离[12],增加鱼糜蛋白的表面疏水性,有利于形成更为均匀、有序的鱼糜蛋白网络结构,更好地截留水分子[13-14]。水分含量的降低也可有效提高高温处理鱼糜凝胶的凝胶特性,同时降低水分活度,改变水分状态,稳定高温处理鱼糜凝胶[15]。关于鱼糜凝胶形成的研究报道已有很多,但关于真空处理对鱼糜凝胶形成的研究鲜有报道。
罗望子果肉中不仅含有罗望子胶,还富含膳食纤维、酒石酸、果胶等物质,且果肉pH值约为3.15[16-19]。相关研究[20]表明,罗望子胶的添加可以显著提高鱼糜弹性模量,提高鱼糜凝胶强度,而外源物的添加目前也是鱼糜制品凝胶强度的研究热点之一[21-22]。将罗望子果肉作为外源添加物直接添加进鱼糜制品的研究较少。
本研究拟以传统二段式加热凝胶过程作为对照,添加不同比例罗望子果肉的同时进行真空(水浴、油浴)凝胶化处理,通过测定鱼糜制品凝胶强度、水分状态、蛋白分子间作用力等指标,研究真空处理对添加罗望子果肉的鱼糜制品凝胶特性的影响,为鱼糜凝胶强化研究提供基础论据,为未来拓展鱼糜制品的应用提供新思路。
1 材料与方法
1.1 材料与试剂
冷冻鲢鱼糜 湖北省洪湖市井力水产食品股份有限公司;罗望子果肉(达到食用成熟度) 海南三亚荔枝沟市场;罗望子粉(10∶1提取,10 份原料得1 份浓缩提取物,下同) 潮昂食品专营店;罗望子浸膏(10∶1
提取) 語果食品专营店。
甲醇、尿素 上海科昌精细化学品公司;双缩脲试剂、亚硝酸钠、无水乙醇 天津市福晨化学试剂厂;硝酸铝、β-巯基乙醇 酷尔化学科技有限公司;氢氧化钠 广州市番禺力强化工厂;氯化钠 宁夏夏盛实业集团有限公司;三氯乙酸 天津市永大化学试剂有限公司。
1.2 仪器与设备
T6-1650E紫外分光光度计 北京普析通用仪器有限责任公司;ME204E电子分析天平 梅特勒-托利多仪器(上海)有限公司;TMS-PRO质构仪 美国FIC公司;MesoMR23-060H-I核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;WSC-100全自动测色色差计 北京
光学仪器厂;ST2100-E pH计 奥豪斯仪器(上海)有限公司;FM100雪花制冰机 北京长流科学仪器有限公司;S2-A81斩拌机 九阳股份有限公司;HH-2数显恒温水浴锅 江苏省金坛市盛蓝仪器制造有限
公司;DZF-6030真空干燥箱 上海一恒仪器有限公司;MultifugeX1-R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;8400电子温度计 上海精科天美科学仪器有限公司。
1.3 方法
1.3.1 鱼糜凝胶制备工艺流程
鱼糜凝胶制作参考常莉莉等[23]的方法,并略作修改。制备工艺流程:冷冻鲢鱼糜→解冻→空斩→加入添加物→斩拌→盐斩→真空脱气→成型→凝胶化→
鱼糕化→冷却→4 ℃保存待测。操作要点:解冻后鱼糜置于斩拌机中空斩3 min,加入一定比例的罗望子果肉斩拌3 min,加入3%食盐,盐斩3 min,将鱼糜包裹于锡箔纸中,隔水隔油,进行凝胶化处理和鱼糕化处理,放置于4 ℃保存待测。
对照组(A组):常压凝胶化处理(40 ℃、60 min),常压鱼糕化处理(90 ℃、30 min),罗望子果肉添加量分别为0%、1%、2%、3%、4%、5%,其中A0组代表罗望子果肉添加量为0%,依次类推。
实验组(B组):采用真空水浴进行凝胶化处理(40 ℃,真空度分别为0.06、0.07、0.08、0.09 MPa,处理60 min),常压鱼糕化处理(90 ℃、30 min),罗望子果肉添加量分别为0%、1%、2%、3%、4%、5%,其中B93组代表真空度0.09 MPa、罗望子果肉添加量3%,依次类推。
实验组(C组):采用真空油浴进行凝胶化处理(40 ℃,真空度分别为0.06、0.07、0.08、0.09 MPa,处理60 min),真空油浴鱼糕化处理(90 ℃、30 min),罗望子果肉添加量分别为0%、1%、2%、3%、4%、5%,其中C93组代表真空度0.09 MPa、罗望子果肉添加量3%,依次类推。
1.3.2 凝胶强度测定
采用TMS-PRO型质构仪球形探头对鱼糜进行凝胶强度测定[24]。参数:力感应元800 N,触发力0.1 N,测试速率60 mm/min,样品高度30 mm,形变量70%。每组测定3 个平行样品,取平均值。凝胶强度按式(1)计算。
(1)
1.3.3 白度测定
将样品切成厚度3 mm的薄片,在室温下采用色差计测定样品色泽,仪器采用标准白板校正,将样品覆盖整个平板进行测定。每组测定3 个平行样品,取平均值[25]。白度按式(2)计算。
(2)
1.3.4 pH值测定
取10 g鱼糜凝胶样品,加入90 mL蒸馏水,放入烧杯中,在匀浆机中8 000 r/min、5 ℃均质3 min,倒入离心管中,5 000 r/min离心15 min,过滤取上清液,用pH计测定pH值[26]。每组测定3 个平行样品,取平均值。
1.3.5 水分分布状态测定
将标准油样放入磁圈中,选用Q-FID序列开机预热20 min,进行参数校正,模拟增益20 dB,数字增益3 dB,前置放大倍数0,采样频率100 kHz,射频延时0.08 μs,起始脉冲宽度10,终止脉宽36,累加步长1。取出油样,放入待测样品,采样频率200 kHz,射频延时0.002 μs。选取Q-CPMG序列,等待时间5 000 ms,回波时间0.65 ms,回波数2 000,累加后导出数据,批量反演。选用纽迈成像软件,统一映射,伪彩后得出成像图。每组测定3 个平行样品,求平均值[27]。
1.3.6 持水性测定
参考秦影等[28]方法,取约2.0 g样品,用滤纸包裹好后置于离心管中,5 000 r/min离心15 min,离心后称质量。每组测定3 个平行样品,取平均值。持水性按式(3)计算。
(3)
式中:m1为离心前质量/g;m2为离心后质量/g。
1.3.7 分子间作用力测定
称取1.0 g样品,加入10 mL S1溶液(0.6 mol/L NaCl),8 000 r/min匀浆3 min,4 ℃放置1 h,取出样品,4 ℃、10 000 r/min离心10 min,取上清液4 ℃存放;取上述沉淀加入10 mL S2溶液(0.6 mol/L NaCl+1.5 mol/L
尿素),重复上述操作,取上清液4 ℃存放;取上一步骤所得沉淀加入10 mL S3溶液(0.6 mol/L NaCl+8 mol/L尿素),重复上述操作,取上清液4 ℃存放;取上一步骤所得沉淀加入10 mL S4溶液(0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇),重复上述操作,取上清液4 ℃存放。将以上每步离心后所得上清液分别加入等体积20 g/100 mL 三氯乙酸,10 000 r/min离心10 min,弃上清液,向沉淀中加入1 mL 1 mol/L NaOH溶液放置于4 ℃,采用雙缩脲法测定蛋白质质量浓度[29-30]。
离子键作用力:以溶解于S1溶液的蛋白质质量浓度表示;氢键作用力:以溶解于S2溶液的蛋白质质量浓度表示;疏水相互作用力:以溶解于S3溶液的蛋白质质量浓度表示;二硫键作用力:以溶解于S4溶液的蛋白质质量浓度表示。每组测定3 个平行样品,取平均值。
1.4 数据处理
采用SPSS 19.0软件进行数据分析,利用Origin 8.6软件和Excle 2003软件绘图,实验结果表示为平均值±标准差(n=3)。
2 结果与分析
2.1 不同凝胶条件下罗望子果肉添加量对鱼糜凝胶强度的影响
由表1可知:随着罗望子果肉添加量的增加,在常压水浴处理时,添加量2%时,鱼糜凝胶强度达到最高,为(710.25±11.61) g·mm;真空水浴凝胶化处理后,真空度0.09 MPa、罗望子果肉添加量3%时,鱼糜凝胶强度最大,为(749.25±12.21) g·mm,较常压水浴处理最优组增加5.49%;真空油浴凝胶化处理后,真空度0.09 MPa、罗望子果肉添加量3%时,鱼糜凝胶强度最大,为(861.36±15.31) g·mm,较常压水浴处理最优组增加21.28%。真空处理后鱼糜凝胶强度均有一定程度的提高,尤其是真空油浴处理后,鱼糜凝胶强度有较大提高,但当罗望子果肉添加量超过3%后,鱼糜凝胶强度呈现下降趋势。罗望子果肉中含有罗望子胶等多糖类物质,同时罗望子果肉呈酸性[16],均有利于鱼糜凝胶结构的形成,故罗望子果肉的适量添加有利于鱼糜凝胶结构形成,但当罗望子果肉添加过多时,起到稀释鱼糜蛋白的作用,使其凝胶强度下降。故后续实验中选取A0、A2、B93、C93组进行指标测定。
在真空凝胶化处理鱼糜时,油浴处理明显优于水浴处理,可能是由于真空油浴条件下,鱼糜中的水分由于真空环境的作用从鱼糜凝胶的网络结构中析出,且随着真空度的提高,水分析出效应愈加明显,使鱼糜凝胶网络中存在大量的空洞;同时由于水分的析出,鱼糜pH值变小,酸性效应愈加明显,二者可能共同促使鱼糜凝胶强度增大。
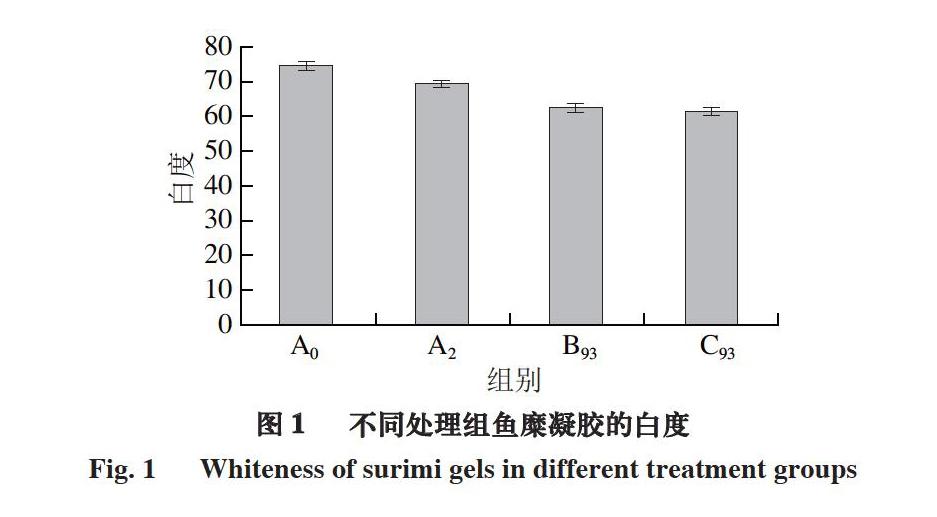
2.2 不同凝胶条件对鱼糜凝胶白度的影响
由图1可知,将罗望子果肉加入鱼糜中,由于罗望子果肉呈棕黄色,鱼糜整体呈现黄色,白度下降。由A0、A2、B93组凝胶白度可知,鱼糜凝胶白度的下降主要是由于罗望子果肉添加量的增加引起的,而B93、C93组对白度的影响较为一致,可见凝胶方式对鱼糜凝胶白度影响较小。
2.3 不同凝胶条件对鱼糜凝胶pH值的影响
由表2可知,鱼糜凝胶的pH值随着罗望子肉果的添加呈现降低趋势,真空油浴处理组pH值降低最大,可能是由于真空油浴处理后鱼糜凝胶中水分含量降低,提高了pH值。
2.4 不同凝胶条件对鱼糜凝胶中水分分布的影响
图2为鱼糜凝胶伪彩图的颜色分布,可以直观比较出鱼糜凝胶中的水分分布情况。水分含量越高,质子密度越高,红色越深;反之,质子密度越低,蓝色越深。由图2可知,真空凝胶处理会使鱼糜凝胶中的水分发生一定的扩散,尤其在真空油浴处理后,红色信号变散变小,质子密度减小。可见真空油浴处理对鱼糜凝胶内部水分的分布产生了一定的影响。
横向弛豫时间T21(0.1~10 ms)、T22(10~100 ms)、T23(100~1 000 ms)分别代表结合水、不易流动水和自由水3 种水分在鱼糜凝胶中的存在状态。由图3可知,4 种不同凝胶化处理的鱼糜凝胶中水分分布状态类似,均存在3 种状态的水分,但在真空凝胶处理后,B93组和C93组的T23(自由水)分布均发生一定变化,呈现减少的趋势,C93组真空油浴凝胶处理后,T23(自由水)峰值变化愈加明显。可能是由于真空凝胶处理时,由于真空负压的影响,鱼糜凝胶中的水分被析出,T23(自由水)作为最容易被析出的部分,从鱼糜凝胶中析出,造成T23峰值的明显下降。
2.5 不同凝胶条件对鱼糜凝胶持水性的影响
鱼糜凝胶的持水性越好,则表示其结合水的能力越强,有利于其良好品质的形成。由图4可知,罗望子果肉的添加有利于鱼糜凝胶持水性的提高,且真空油浴处理后,鱼糜凝胶的持水性最高,可能是由于真空油浴处理后,一方面鱼糜凝胶网络结构由于真空作用发生强化,锁水能力提高,另一方面鱼糜凝胶中自由水含量降低,在离心处理时析出的水分明显减少,使其持水性提高。
2.6 不同凝胶条件对鱼糜凝胶分子间作用力的影响
由图5可知,罗望子果肉的添加及真空凝胶化处理对鱼糜凝胶离子键和氢键的影响不大,可能是由于离子键和氢键的形成主要与蛋白结构变化有关,温度对蛋白结构的影响起主导作用。而不同处理条件下,二硫键和疏水相互作用则变化较大。二硫键含量的变化可能是由于真空凝胶处理在低氧下进行凝胶,活性巯基氧化受到一定抑制,但由于真空的物理作用力使蛋白质伸展[14],暴露出较多的活性疏基,从而形成一定量的二硫键。疏水相互作用的变化可能是由于真空的物理作用力使蛋白质疏水基团暴露,促进了疏水作用力的增加。
3 結 论
常压凝胶化处理时,罗望子果肉添加量为2%时,鱼糜凝胶强度最大,为(710.25±11.60) g·mm,罗望子果肉中含有膳食纤维、多糖、酒石酸等,添加适量的罗望子果肉可以促使鱼糜凝胶强度增大,但添加过多的果肉则减弱了鱼糜凝胶强度。真空处理条件下,鱼糜凝胶强度均发生不同程度的增强,尤其是在真空油浴处理后,可能是由于在真空条件下蛋白结构发生伸展,同时自由水比例下降,导致鱼糜凝胶pH值下降,均有利于鱼糜凝胶网络结构的增强。蛋白分子间作用力测定结果表明,不同处理条件下二硫键和疏水相互作用力变化较大,可能为真空处理条件下影响鱼糜凝胶的主要作用力。真空条件下,鱼糜蛋白分子内部的束缚作用减弱,二硫键减少,有利于蛋白分子结构的伸展,增加鱼糜蛋白的表面疏水性,同时水分状态的变化可以起到浓缩效应,增强酸凝胶效果,这均有利于鱼糜凝胶网络的形成。
参考文献:
[1] WANG Guan, LIU Manman, CAO Liwei, et al. Effects of different NaCl concentrations on self-assembly of silver carp myosin[J]. Food Bioscience, 2018, 24: 1-8. DOI:10.1016/j.fbio.2018.05.002.
[2] 桥本昭彦, 吴成业. 鱼糜制品的弹性和质量管理[J]. 渔业研究, 1989(2): 82-84.
[3] 朱玉安, 刘友明, 张秋亮, 等. 加热方式对鱼糜凝胶特性的影响[J]. 食品科学, 2011, 32(23): 107-110.
[4] CAO Hongwei, FAN Daming, JIAO Xidong, et al. Effects of microwave combined with conduction heating on surimi quality and morphology[J]. Journal of Food Engineering, 2018, 228: 1-11. DOI:10.1016/j.jfoodeng.2018.01.021.
[5] TADPITCHAYANGKOON P, PARK J W, YONGSAWATDIGUL J. Gelation characteristics of tropical surimi under water bath and ohmic heating[J]. LWT-Food Science and Technology, 2012, 46(1): 97-103. DOI:10.1016/j.lwt.2011.10.020.
[6] MOON J H, YOON W B, PARK J W. Assessing the textural properties of pacific whiting and Alaska pollock surimi gels prepared with carrot under various heating rates[J]. Food Bioscience, 2017, 20: 12-18. DOI:10.1016/j.fbio.2017.07.008.
[7] XU Yanshun, JIANG Qixing, XIA Wenshui. Effect of glucono-δ-lactone acidification and heat treatment on the physicochemical properties of silver carp mince[J]. LWT-Food Science and Technology, 2011, 44(9): 1952-1957. DOI:10.1016/j.lwt.2011.05.008.
[8] HEMUNG B O, CHIN K B. Evaluation of acid-treated fish sarcoplasmic proteins on physicochemical and rheological characteristics of pork myofibrillar protein gel mediated by microbial transglutaminase[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(1): 50. DOI:10.5851/kosfa.2015.35.1.50.
[9] LIANG Yan, GUO Baoyan, ZHOU Aimei, et al. Effect of high pressure treatment on gel characteristics and gel formation mechanism of bighead carp (Aristichthys nobilis) surimi gels[J]. Journal of Food Processing and Preservation, 2017, 41(5): e13155. DOI:10.1111/jfpp.13155.
[10] ZHU Zhiwei, LANIER T C, FARKAS B E, et al. Transglutaminase and high pressure effects on heat-induced gelation of Alaska pollock (Theragra chalcogramma) surimi[J]. Journal of Food Engineering, 2014, 131: 154-160. DOI:10.1016/j.jfoodeng.2014.01.022.
[11] 张梦玲, 樊瑶, 张晋, 等. 鲢鱼糜凝胶力学性能对热处理方式的响应性研究[J]. 现代食品科技, 2017, 33(2): 129-135. DOI:10.13982/j.mfst.1673-9078.2017.2.020.
[12] WANG Zhenyu, XU Weiwei, KANG Ning, et al. Microstructural, protein denaturation and water holding properties of lamb under pulse vacuum brining[J]. Meat Science, 2016, 113: 132-138. DOI:10.13982/j.mfst.1673-9078.2017.2.020.
[13] MA Yaolan, XIONG Shanbai, YOU Juan, et al. Effects of vacuum chopping on physicochemical and gelation properties of myofibrillar proteins from silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2018, 245: 557-563. DOI:10.1016/j.foodchem.2017.10.139.
[14] LI Man, ZHU Kexue, PENG Jing, et al. Delineating the protein changes in Asian noodles induced by vacuum mixing[J]. Food Chemistry, 2014, 143: 9-16. DOI:10.1016/j.foodchem.2013.07.086.
[15] ZHANG Lili, XUE Yong, XU Jie, et al. Effects of high-temperature treatment (≥100 ℃) on Alaska pollock (Theragra chalcogramma) surimi gels[J]. Journal of Food Engineering, 2013, 115(1): 115-120. DOI:10.1016/j.jfoodeng.2012.10.006.
[16] 李德骏. 罗望子(酸角)文献综述[J]. 山西农经, 2017(17): 82-83.
[17] 赵静, 冯叙桥, 吴永娴. 酸角的营养成分分析[J]. 营养学报, 2001(4): 378-379. DOI:10.3321/j.issn:0512-7955.2001.04.041.
[18] 赵元藩. 罗望子多糖的提取及应用[J]. 西部林业科学, 2006(4):
109-111; 133. DOI:10.3969/j.issn.1672-8246.2006.04.019.
[19] 蒲彪, 邓继尧, 蒋华曾, 等. 罗望子果肉的营养成分分析[J]. 四川
农业大学学报, 1994(4): 455-457.
[20] 陈海华, 薛长湖. 亲水胶体对竹荚鱼鱼糜流变特性的影响[J]. 食品科学, 2009, 30(17): 52-55.
[21] 邓立青. 不同辅料添加量对铜盘鱼鱼糜凝胶强度的影响[J]. 肉类工业, 2020(8): 19-22.
[22] 周阳, 胥伟, 陈季旺, 等. 小麦淀粉和马铃薯淀粉对鱼丸品质的影响[J].
肉类研究, 2018, 32(2): 15-19. DOI:10.7506/rlyj1001-8123-201802003.
[23] 常莉莉, 崔浩哲, 张志慧, 等. 海水鱼丸加工工艺及外源添加剂对高温杀菌后鱼丸品质保持研究[J]. 食品工业科技, 2020, 41(23):
195-202. DOI:10.13386/j.issn1002-0306.2020030024.
[24] 谢三都. 提高鲢鱼鱼丸品质技术的研究[D]. 福州: 福建农林大学, 2010.
[25] 张浩, 李丹辰, 洪佳敏, 等. 漂洗条件对蓝圆鯵鱼糜特性的影响[J]. 食品工业, 2014, 35(3): 18-21.
[26] 吴润锋, 袁美兰, 赵利, 等. 不同辅料对草鱼鱼糜品质的影响[J]. 食品科学, 2014, 35(7): 53-57. DOI:10.7506/spkx1002-6630-201407011.
[27] 裴志胜, 薛长风, 文攀, 等. 芋頭添加物对金鲳鱼鱼糜凝胶的影响[J].
肉类研究, 2019, 33(11): 12-17. DOI:10.7506/rlyj1001-8123-20190823-194.
[28] 秦影, 汤海青, 欧昌荣, 等. 超高压处理对大黄鱼鱼糜水分状态和蛋白质结构的影响[J]. 农业工程学报, 2015, 31(23): 246-252. DOI:10.11975/j.issn.1002-6819.2015.23.033.
[29] 刘书成, 郭明慧, 刘媛, 等. 高密度CO2处理过程中虾肌球蛋白分子间作用力的变化[J]. 食品科学, 2018, 39(7): 153-159. DOI:10.7506/spkx1002-6630-201807023.
[30] 张洪超, 薛张芝, 丁源, 等. 不同解冻方式反复冻融对金乌贼蛋白质分子间作用力的影响[J]. 水产学报, 2019, 43(8): 1839-1849.

