HNF3β对SW480细胞株增殖、侵袭和转移的影响
徐君毅,宋学民,以敏
结肠癌是一种常见的恶性肿瘤,发病率和死亡率都很高,近年来随着我国高脂肪低纤维饮食结构的变化,结肠癌成为了消化道最常见的恶性肿瘤之一[1,2]。目前治疗结肠癌的方法较多,主要包括统开腹手术切除及化疗、放疗治疗;虽然开腹手术有较为先进的完整结肠系膜切除术等但术中出血量较多,有较多的并发症等[3,4]。放化疗法虽然对患者有不错的治疗效果,但其毒副作用明显,不仅严重影响患者的生活质量,更有患者因承受不了化疗辅助用而选择终止治疗,对患者的治疗十分不利[5,6],因此寻求相关的基因或因子抑制直肠癌细胞的恶性肿瘤特征显得尤为重要。肝细胞核因子3β(HNF3β)又称为FOXA2(forkhead box A2),属于肝细胞核因子(HNF)家族[7]。但目前关于HNF3β对结直肠癌SW480细胞株细胞增殖、侵袭和转移的机制尚不完全统一。本文旨在研究HNF3β对结直肠癌SW480细胞株细胞增殖、侵袭和转移的影响,以期了解其作用效果及机制。
1 材料与方法
1.1 主要细胞
结直肠癌SW480细胞株购自中国科学院细胞库。
1.2 主要试剂与仪器
包含HNF3β蛋白全长的peDNA3.1质粒购自由谷歌生物科技有限公司;HNF3β单克隆抗体(货号:sc-6554)、E-cadherin(货号:sc-8426)、N-cadherin抗体(货号:sc-8424)、Ki67抗体(货号:sc-6554)、Vimentin抗体(货号:sc-6260)、JAK抗体(货号:sc-376996)、STAT3抗体(货号:sc-8019)购自美国Santa Cruz公司;PCNA抗体(货号:ab29)购自艾博抗公司;RPMI1640 培养基购自广州威佳科技有限公司;青霉素钠购自哈药集团制药总厂;磷酸缓冲液PBS购自天津科密欧有限公司;CCK 试剂盒购自上海抚生实业有限公司;胎牛血清购自杭州四季青公司;脂质体LipofectamineⅢ3000购自Invitrogen公司;Transwell小室购自Corning Corstart公司。
TGL-16M低温离心机购自济南来宝医疗器械有限公司;光学显微镜购自东莞市同创仪器有限公司;酶联免疫检测仪购自北京诺亚威仪器仪表有限公司;细胞培养箱购自美国Forma公司;蛋白电泳及转膜仪购自美国Bio-Rad公司。
1.3 方法
1.3.1 分组干预 体外培养结直肠癌SW480细胞株细胞,并分为对照组(Control)、HNF3β转染组(HNF3β)和空转质粒组(NC)。
1.3.2 细胞培养及转染 将直肠癌SW480细胞培养于含10% FBS、100 U/mL青霉素和100 U/mL链霉素RPMI 1640 培养基中,保存在温度为37 ℃、CO2浓度为5%的培养箱内培养,取对数生长期细胞进行实验。使用Lipofectaminel 3000转染试剂在细胞对数生长期转染pcDNA3.1质粒。HNF3β转染组将含有目的基因的质粒进行转染;空转质粒组使用空白质粒转染,对照组不做任何处理。转染过程依据转染试剂说明书进行。
1.3.3 Western blot检测蛋白表达水平 将对数期细胞按照1×105个接种至6空白,贴壁生长后使用BCA蛋白浓度测定试剂盒检测各孔蛋白总量。将样本经10%的SDS-聚丙烯酰胺凝胶电泳在100 v条件下分离,按照凝胶面积0.65 mA/cm2恒定电流转移1.5 h至PVDF膜后使用5%的脱脂奶粉很稳封闭2 h,加入稀释比例1∶500的HNF3β抗体E-cadherin抗体、N-cadherin抗体、Ki67抗体、Vimentin抗体、PCNA抗体、JAK抗体、STAT3抗体,在4 ℃条件下孵育过夜,TBST漂洗后使用稀释比例为1∶2 000的辣根过氧化物没标记的羊抗兔IgG二抗孵育1.5 h;曝光后以β-actin内参蛋白,目的蛋白条带灰度值/内参条带灰度值为相对蛋白表达水平,实验重复3次。
1.3.4 采用克隆形成实验检测细胞生长情况 取对数期直肠癌SW480细胞,制作1×103个/mL单细胞悬液,六孔板中加入2.6 mL的细胞培养液,置于培养箱中平衡后,每孔加入0.4 mL的细胞悬液(约400个细胞),2周后微镜下可见明显克隆形成,结晶紫染色后拍照,并计算克隆形成率。
1.3.5 Transwell小室检测各组细胞侵袭能力 取直肠癌SW480细胞在Transwell小室培养 24 h后,调整细胞数目为1×105个/ml并制成无 FBS 悬浮液,小室下层加入含血清的细胞培养液,恒温培养1 d后,随机选取视野使用显微镜观察细胞形态,同时统计细胞数量。
1.3.6 划痕实验法检测人直肠癌SW480细胞迁移能力 取对数生长期直肠癌SW480细胞,使用枪头在单层肠癌SW480细胞划横,拍照;培养1 d后显微镜下再次观察拍照。
1.4 统计学方法
本研究数据分析采用软件为SPSS 22.0,作图采用软件为GraphPad Prism5,多组间比较使用单因素方差分析,组间两两比较采用LSD-t法;若P<0.05则表明数据差异有统计学意义,本研究所有检验均为双侧检验。
2 结果
2.1 各组细胞HNF3β表达情况
由蛋白质印记实验可以看出,相比对照组,HNF3β转染组HNF3β蛋白表达显著升高(P<0.01),相比HNF3β转染组空转质粒组HNF3β蛋白表达显著降低(P<0.01),见图1。
图1 各组细胞HNF3β表达情况 与对照组相比,**P<0.01;与HNF3β转染组相比,##P<0.01
2.2 各组细胞增殖情况检测结果
由图2(A)细胞克隆形成实验可以看出,相比对照组,HNF3β转染组结直肠癌细胞SW480克隆形成率显著降低(P<0.01),相比HNF3β转染组空转质粒组结直肠癌细胞SW480克隆形成率显著升高(P<0.01)。由图2(B)蛋白质印记实验形成实验可以看出,相比对照组,HNF3β转染组PCNA蛋白相对表达、Ki67蛋白相对表达水平显著降低(P<0.01),相比HNF3β转染组空转质粒组PCNA蛋白相对表达、Ki67蛋白相对表达水平显著升高(P<0.01)。
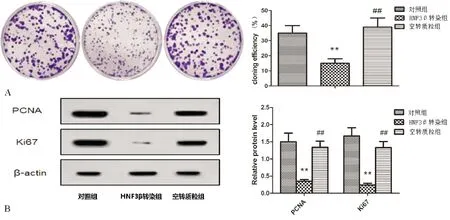
图2 各组细胞增殖情况检测结果 A:克隆形成实验结果;B:蛋白质印记检测增殖相关蛋白表达结果;与对照组相比,**P<0.01;与HNF3β转染组相比,##P<0.01
2.3 各组细胞侵袭和转移检测结果
由图3(A)Transwell小室实验可以看出,相比对照组,HNF3β转染组结直肠癌细胞SW480单位面积侵袭细胞数目显著降低(P<0.01),相比HNF3β转染组,空转质粒组结直肠癌细胞SW480单位面积侵袭细胞数目显著升高(P<0.01)。由图2蛋白质印记实验检测细胞侵袭迁移相关蛋白可以看出,相比对照组,HNF3β转染组E-cadherin蛋白相对表达水平显著升高、N-cadherin蛋白相对表达、Vimentin蛋白相对表达水平显著降低(P<0.01),相比HNF3β转染组,空转质粒组E-cadherin蛋白相对表达水平显著降低、N-cadherin蛋白相对表达、Vimentin蛋白相对表达水平显著升高(P<0.01)。
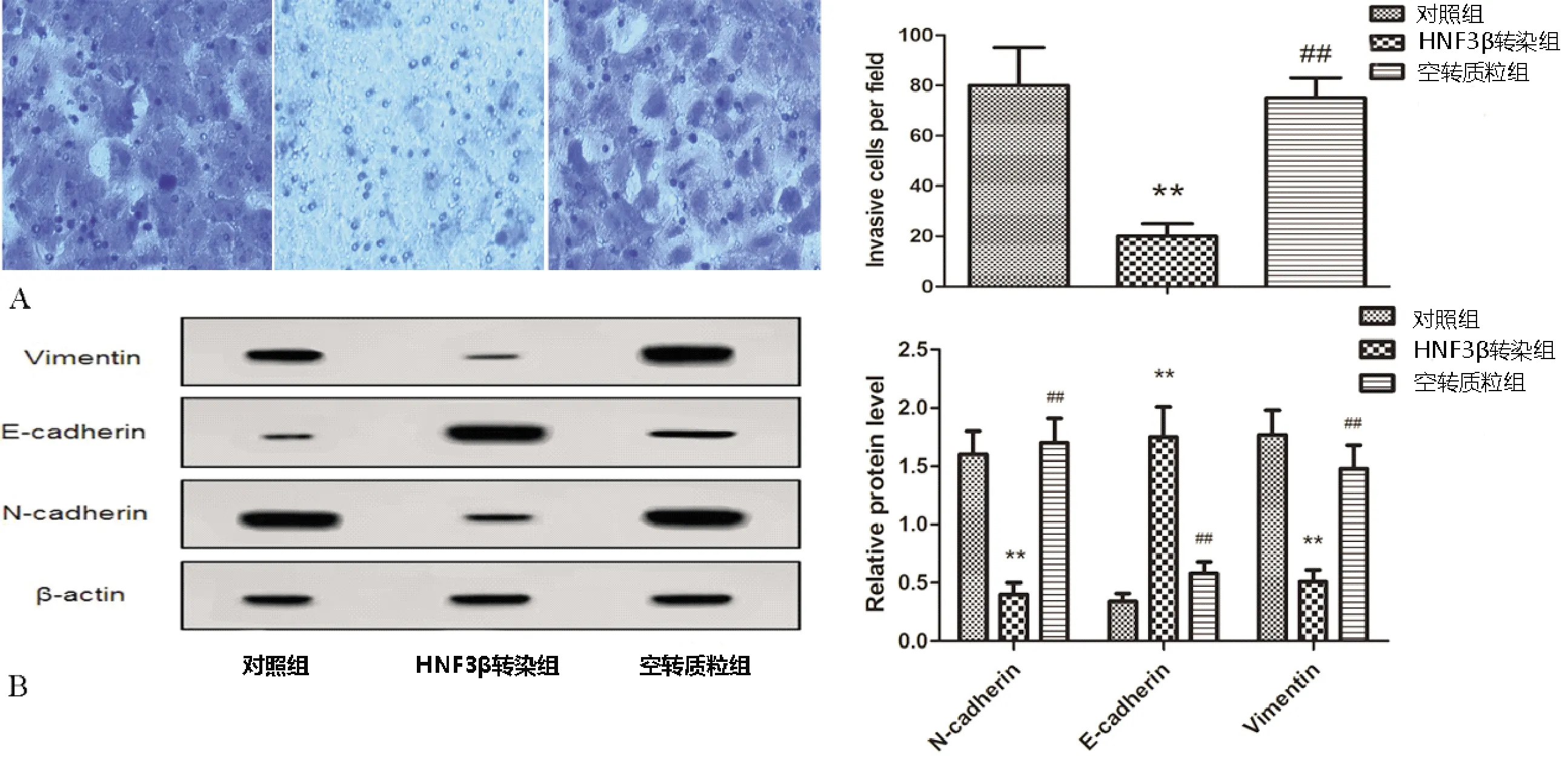
图3 各组细胞侵袭和转移检测结果 A:Transwell小室结果;B:蛋白质印记检测侵袭、迁移相关蛋白表达结果;与对照组相比,**P<0.01;与HNF3β转染组相比,##P<0.01
2.4 HNF3β对结直肠癌SW480细胞JAK/STA信号通路影响检测结果
由蛋白质印记实验可以看出,相比对照组,HNF3β转染组JAK1蛋白相对表达、STAT3蛋白相对表达显著降低(P<0.01),相比HNF3β转染组,空转质粒组JAK1蛋白相对表达、STAT3蛋白相对表达显著升高(P<0.01),见图4。
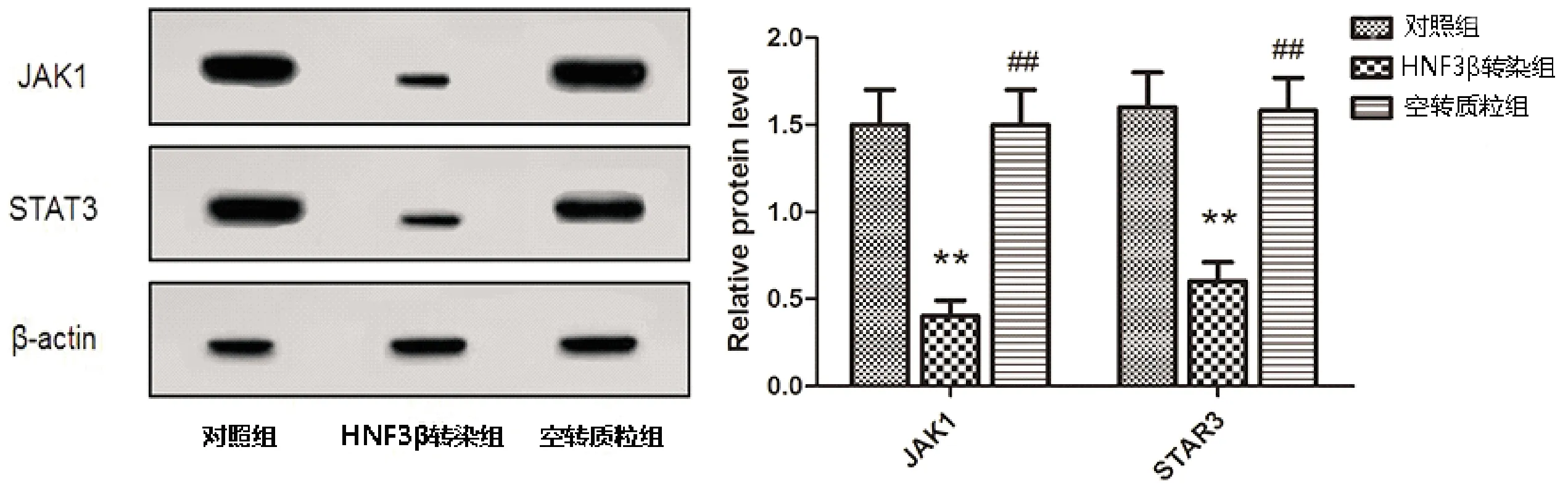
图4 HNF3β对结直肠癌SW480细胞JAK/STA信号通路影响检测结果 与对照组相比,**P<0.01;与HNF3β转染组相比,##P<0.01
3 讨论
癌细胞的增殖是其重要的恶性生物学特征之一[8],目前较为常见的细胞增殖相关蛋白包括:PCNA和Ki67。其中PCNA是增殖细胞核抗原PNCA指数越高,细胞的分裂增殖越快,最终会让细胞获得无限增殖的能力并使细胞在形态和结构机能上改变,达到细促进细胞增殖的作用[9]。Ki67是一种细胞周期相关核抗原,是细胞核内与细胞分裂增殖相关的蛋白抗原,其表达水平反映细胞增殖的敏感指标同时这种基因在维持结构方面起着重要作用[10]。本研究通过克隆形成实验发现,相比对照组,HNF3β转染组结直肠癌细胞SW480克隆形成率显著降低。同时通过蛋白质印记实验发现,相比对照组,HNF3β转染组PCNA蛋白相对表达、Ki67蛋白相对表达水平显著降低。说明结直肠癌细胞导入HNF3β基因后细胞增殖能力显著降低,其作用机理可能是通过抑制增殖相关蛋白的表达,抑制细胞的有丝分裂,导致细胞的细胞周期受到阻滞。卢浩[11]研究表明,HNF3B高表达可以抑制结直肠癌细胞的增殖,与本研究得出的结论相一致。
细胞的侵袭和迁移能力也是癌细胞的重要恶性生物学特征之一[12]。细胞的侵袭和迁移受到上皮间质转化(Epithelial mesenchyml transition,EMT)的调节[13]。EMT是指上皮细胞能暂时丧失细胞极性获得间质细胞移动能力。肿瘤细胞能够通过细胞极性丧失,改变自身细胞形态与其他细胞分离[14-15];同时通过下调细胞黏附因子E-钙黏蛋白(E-Cadherin)的表达,促进N-钙黏蛋白(N-Cadherin)和Vimentin蛋白相对表达将角蛋白细胞骨架变为波形细胞骨架,使得细胞穿透胞间连接,增强细胞的侵袭能力[16]。本研究Transwell小室实验可以看出,相比对照组,HNF3β转染组结直肠癌细胞SW480单位面积侵袭细胞数目显著降低,同时相比对照组,HNF3β转染组E-cadherin蛋白相对表达水平显著升高、N-cadherin蛋白相对表达、Vimentin蛋白相对表达水平显著降低。说明HNF3β可以有效抑制结直肠癌细胞的侵袭和迁移能力,其作用机制可能是HNF3β可以通过调节癌细胞的EMT过程,并通过抑制EMT过程中的蛋白表达,增加黏附相关蛋白的表达,抑制肿瘤细胞的侵袭和迁移相关。朱宏明等[17]研究表明,一种肿瘤细胞的EMT过程可有效抑制肿瘤的侵袭和迁移,与本研究得出的结论相一致。
JAK-STAT3信号通路可参与细胞分化、增殖、凋亡及免疫调节[18]。JAK-STAT信号通路主要依靠调控相关靶点的磷酸化水平达到激活和抑制的效果。STAT3的信号传导具有内在酪氨酸激酶活性的生长因子受体,如STAT3蛋白[19]。缺乏内在酪氨酸激酶活性的受体,例如 IL-6可以聚集JAK家族成员使得自身磷酸化而激活,同时磷酸化受体胞浆区的酪氨酸残基可以形成STAT3识别的SH2结构域,促进胞浆中相应的STAT成员与之结合,并在JAK激酶的作用下形成同源或异源二聚体,激活细胞周期调节基因,达到调节肿瘤的效果。本研究发现,相比对照组,HNF3β转染组JAK1蛋白相对表达、STAT3蛋白相对表达显著降低。说明HNF3β可以抑制肿瘤细胞的增殖,其作用机制可能是参与JAK-STAT3信号通路的调控,抑制相关蛋白的表达,从而激活细胞周期调节基因实现抑制肿瘤细胞的增殖。王霄等[20]研究表明,通过调节JAK-STAT3信号通路可以有效抑制细胞的增殖及迁移能力,与本研究得出的结论相一致。
综上所述HNF3β是结直肠癌的抑癌基因,可能通过调控JAK/STAT3信号通路抑制SW480细胞的增殖、侵袭和转移,但影响癌细胞的增殖和侵袭、迁移涉及到的信号通路和蛋白较多,在后续的实验中将进一步探讨HNF3β对其他蛋白和信号通路的调节作用。
——一道江苏高考题的奥秘解读和拓展

