硫代硫酸钠标准溶液浓度的影响因素
热孜万古丽·玉努斯,马续娟
(新疆中泰(集团)有限责任公司,新疆 乌鲁木齐 830009)
1 配制对硫代硫酸钠标准溶液浓度的影响
1.1 硫代硫酸钠标准溶液的配制过程[1]
称取26 g五水合硫代硫酸钠(或16 g无水硫代硫酸钠),加0.2 g无水碳酸钠,溶于1 000 mL水中,缓缓煮沸10 min,冷却;放置2周后,过滤,待用。
1.2 配制过程中的不稳定因素及分析[2]
(1)硫代硫酸钠可以与溶解在水中的二氧化碳发生反应,在中性或弱碱性溶液中比较稳定,在酸性溶液中不稳定。当溶液中存在二氧化碳时,硫代硫酸钠会分解,导致溶液浓度的改变。

NaHCO3+NaHSO3+S↓。
(2)可以与空气中的O2发生反应。

(3)可以与水中的微生物发生反应,这也是硫代硫酸钠标准溶液分解的主要原因。

1.3 配制过程注意事项
在日常工作中,因使用硫代硫酸钠标准溶液的用量非常大,个别实验室甚至需要一次配制18 L。在配制过程中,一般是先配制高浓度硫代硫酸钠标准溶液,然后将其煮沸,放置2周过滤后,用水稀释、定容至18 L后,再标定。为避免产生较多微生物,保证标准溶液浓度的准确性,在稀释前一定要加入少量Na2CO3。笔者在实验室进行试验采用稀释后再加Na2CO3的方式,发现溶液标定结果忽高忽低,不稳定,得不到标定浓度的平行结果,测定结果常常超出允差值范围而重新处理或标定,增加了操作人员的工作量。改变Na2CO3的加入顺序后,标定结果理想。稀释后加碳酸钠及使用煮沸后放置过久的蒸馏水标定Na2S2O3标准溶液的结果如表1所示,稀释前加碳酸钠及使用新煮沸冷却蒸馏水时标定Na2S2O3标准溶液的结果如表2所示。
1.4 配制过程应采取的相应措施
规定配制过程所用的水必须为新煮沸并冷却的蒸馏水,以去除水中的CO2和杀灭水中的微生物;规定配制过程中加入少量Na2CO3,使溶液呈弱碱性,保证微生物的低活动力,相对保持溶液浓度的稳定;将配制溶液置于棕色瓶中放置2周,再用基准试剂K2Cr2O7进行标定;配制过程中各步骤一定要认真、仔细,所用仪器必须洁净且用新煮沸并冷却的水彻底清洗。
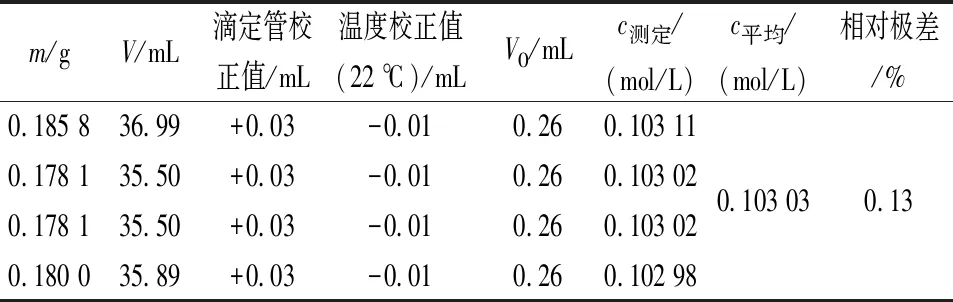
表1 稀释后加碳酸钠及使用煮沸后放置过久的蒸馏水时Na2S2O3标准溶液的标定结果
注:表中m为基准试剂K2Cr2O7的质量,g;c测定为待标定Na2S2O3标准溶液浓度的测定值,mol/L;c平均为待标定Na2S2O3标准溶液浓度4次测定的平均值,mol/L;V0为空白样滴定消耗待标定Na2S2O3标准溶液的体积,mL;V为滴定K2Cr2O7消耗待标定Na2S2O3标准溶液的体积,mL。
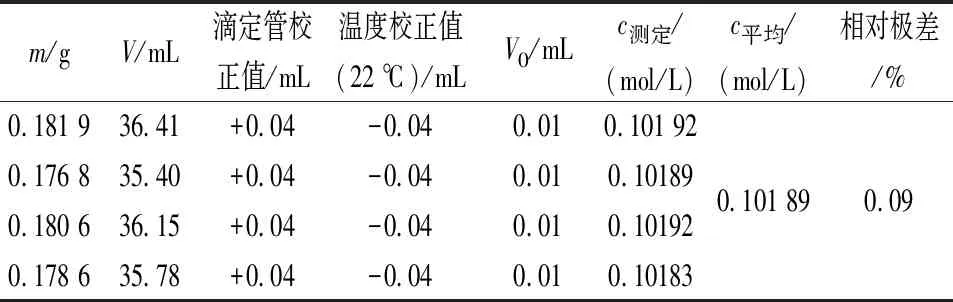
表2 稀释前加碳酸钠及使用新煮沸冷却的蒸馏水时Na2S2O3标准溶液的标定结果
2 标定对硫代硫酸钠标准溶液浓度的影响
2.1 标定过程
称取0.18 g工作基准试剂K2Cr2O7置于(120±2)℃干燥至质量恒定的碘量瓶中,加25 mL水溶解,加入2 g KI及20 mL质量分数为20%的H2SO4溶液,摇匀置于暗处放10 min后,加入150 mL 15~20 ℃的水,用配制好的硫代硫酸钠标准溶液滴定,近终点时加2 mL淀粉指示液,继续滴定至溶液颜色由蓝色变为亮绿色,同时做空白试验。
2.2 标定过程中的不稳定因素及分析
标定反应分两步进行。
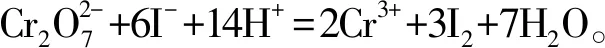
该反应过程要加入过量的KI和H2SO4溶液,摇匀后在暗处放置10 min。

该反应须加入大量的水稀释,因反应(1)要求在强酸性溶液中进行,而反应(2)须在弱酸性或中性溶液中进行,加入大量水稀释以降低酸度,防止Na2S2O3分解;另外,稀释后溶液中Cr3+的浓度降低,避免了显墨绿色的Cr3+妨碍终点观察。
2.3 标定过程中应采取的相应措施
用碘量瓶加水封,规定准确的放置时间并避光处理,减少碘的挥发;标定过程的滴定速度适宜,不宜过慢,严禁剧烈摇动;淀粉指示液要在近终点时加入,以免过早加入导致淀粉过多的包裹I2而使滴定终点延迟,影响滴定结果的准确度;标定过程一定要使用新煮沸并冷却的蒸馏水,防止因水中溶解较多的氧而使空白值偏大。
3 储存及使用不当造成的影响
针对硫代硫酸钠标准溶液易分解的特点,在保存和使用过程中须严格管理。
(1)对储存环境的明确要求:温度一般为15~25 ℃,不允许放置在有光照、温度较高的储存场所,不允许放置在与其反应的其他溶液、试剂附近。
(2)对储存容器的明确要求:将标准溶液全部放置于密封的棕色玻璃瓶中。瓶子容积要适宜,并要求缩短开盖时间和减少开盖次数,以降低对标准溶液浓度的影响。
(3)在使用过程中每次取用量不宜过多,并要采取避光、低温措施,减少开盖次数,缩短开盖时间。
(4)若观察到溶液浑浊或表面有悬浮物时,须过滤并重新标定,再根据标定的结果决定是否需要重新配制。
4 结语
综上所述,在实验室中可以采取一定的措施,将对硫代硫酸钠标准溶液浓度准确性的影响降至最小,为客户提供更接近真实的数据,并指导后续生产的安全平稳运行。
——硫代硫酸钠

